臨床研究中核病院の承認要件固まる、医師主導治験3年間で4件以上など
2015.1.26.(月)
厚生労働省の「医療法に基づく臨床研究中核病院の承認要件に関する検討会」は23日、新たな「臨床研究中核病院」の承認要件を固めました。各病院の能力や施設、人員配置の観点から臨床研究中核病院としてふさわしいかどうかを見る内容で、このうち能力面では、過去3年間の実績として医師主導治験4件以上か臨床研究80件以上の実施を求めます。
2014年6月に成立した医療介護総合確保推進法では、「日本発の革新的医薬品・医療機器の開発などに必要となる質の高い臨床研究を推進するため、国際水準の臨床研究や医師主導治験の中心的な役割を担う医療機関」として、臨床研究中核病院を15年4月から医療法に位置付けることとしています。これを受けて検討会では、新たな臨床研究中核病院の具体的な要件を議論してきました。
現在の臨床研究中核病院(臨床研究品質確保体制整備病院)は、12、13両年度に10病院(北大病院、京大病院、九大病院など)が整備されましたが、厚労省は、一定の機能を持つ病院を新たな臨床研究中核病院として、この4月から指定し直す考えです。
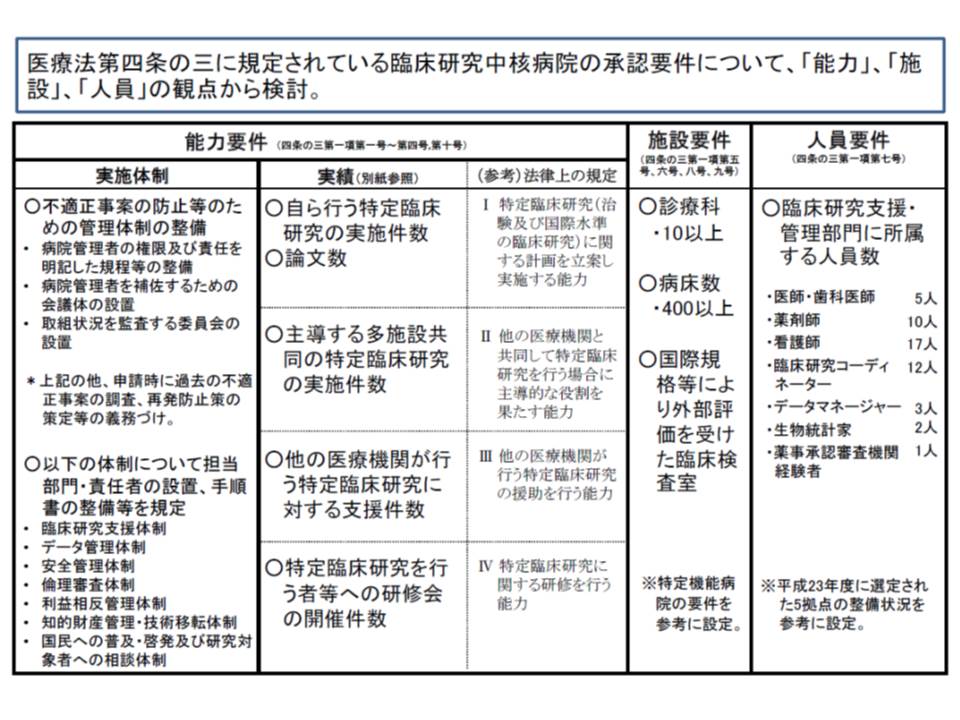
23日の会合で固められた承認要件は、能力、施設、人員という3つの観点で、臨床研究中核病院としてふさわしいかどうかを見極めるものと言えます。
まず、能力面では臨床研究の「実施体制」と「実績」という2つの側面から規定されています。このうち「実施体制」では、▽不適正事案の防止などのための管理体制を整備▽「臨床研究支援」や「データ管理」「安全管理」「倫理審査」などについて担当部門・責任者を設置し、手順書の整備などを規定-が求められます。
実績面については、主に次のような要件が決められました。
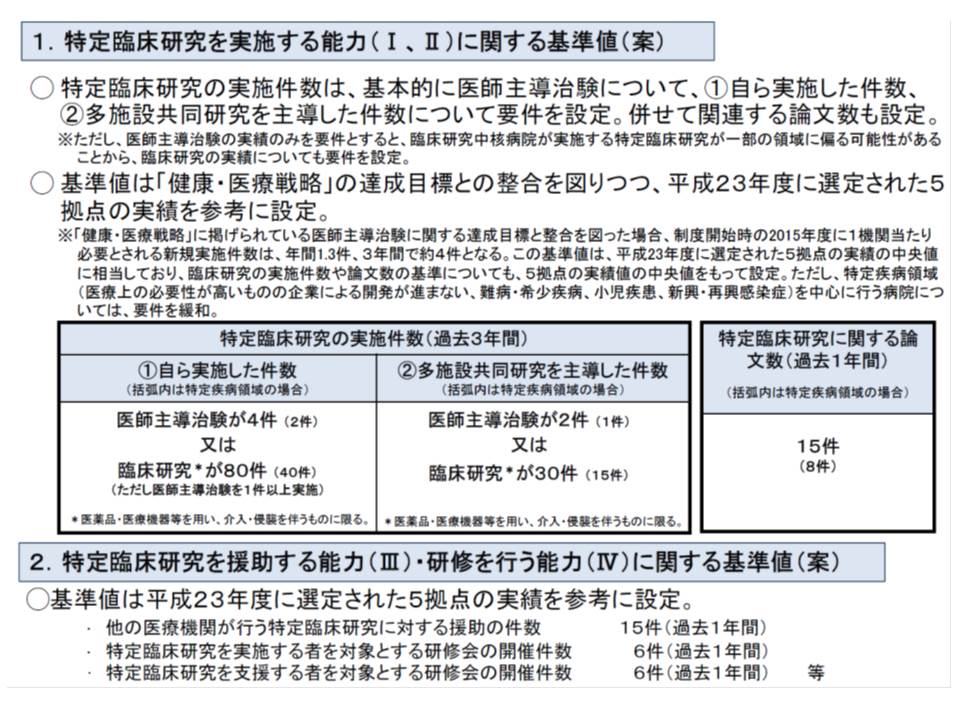
▽過去3年間に、自ら実施した特定臨床研究の実施件数
「医師主導治験が4件以上(難病・希少疾病領域、小児疾患領域、新興・再興感染症領域を中心に行う場合はそれぞれの領域で2件以上)」または「臨床研究が80件以上(同40件以上)で、うち医師主導治験が1件以上」
▽多施設共同研究を過去3年間に主導した数
「医師主導治験が2件以上(同1件以上)」または「臨床研究が30件以上(同15件以上)」
▽特定臨床研究に関する論文数が過去1年間に15件以上(同8件以上)
▽ほかの医療機関が行う特定臨床研究に対する援助の件数が過去1年間に15件以上
▽特定臨床研究を実施する者を対象とする研修会の開催が過去1年間に6件以上
▽特定臨床研究を支援する者を対象とする研修会の開催が過去1年間に6件以上
また施設に関しては、▽10以上の診療科▽病床数が400床以上▽国際規格などにより外部評価を受けた臨床検査室-を有することが必要となります。
診療科については、▽内科▽外科▽精神科▽小児科▽皮膚科▽泌尿器科▽産科▽婦人科▽眼科▽耳鼻咽喉科▽放射線科▽救急科▽脳神経外科▽整形外科▽歯科▽麻酔科-の中から10以上を有していなければなりません。
さらに人員については、「臨床研究支援・管理部門に所属する人員数」が職種ごとに次のように規定されます(いずれも常勤換算)。
▽医師・歯科医師5人以上
▽薬剤師10人以上
▽看護師17人以上
▽臨床研究コーディネーター(臨床研究支援業務に関する知見を有し、当該業務の実務経験が3年以上)12人以上
▽データマネジャー(データマネジメント業務に関する知見を有し、当該業務の実務経験が2年以上)3人以上
▽生物統計家(生物統計に精通し、臨床研究に係る生物統計についての実務経験が1年以上)2人以上
▽薬事承認審査機関経験者(薬事審査関連業務を1年以上経験し、医師主導治験などの薬事申請を想定した特定臨床研究に関する企画・立案相談などの業務を行っている者)1人以上