免疫抑制剤の「ミコフェノール酸 モフェチル」、ループス腎炎治療での保険適用認める―厚労省
2015.8.4.(火)
厚生労働省は7月31日、臓器移植を行った際の免疫抑制剤である「ミコフェノール酸 モフェチル」(販売名:セルセプトカプセル250)を、ループス腎炎の治療に用いた場合に、保険償還することを特例的に認めました。
また、「アミトリプチリン塩酸塩」を末梢性神経障害性疼痛の治療に用いる場合、「リドカイン塩酸塩」を上肢手術における静脈内区域麻酔に用いる場合にも、保険償還の特例を認めています。
わが国では、先進諸国に比べて「新薬(効能追加を含む)が患者の治療に使えるようになるまでの期間が長い」という、いわゆるドラッグラグがあると指摘されます。厚労省は、このラグを解消するために▽医薬品の審査体制の強化▽事前相談体制の整備―など、さまざまな対策を取っています。
また医療保険制度の面からドラッグラグを解消するために、「『公知申請を行ってよい』と薬事・食品衛生審議会が判断した時点で特例的に保険償還を認める」という仕組みが、2010年の中央社会保険医療協議会で創設されました。
「公知申請」とは、「A疾病への効能効果がある」と認められた医薬品を別のB疾病に使う際に、あらためて治験などをせずとも、外国の文献など(公知)をエビデンスとして薬事法上の承認申請を行えるという制度です。
医薬品の保険償還が認められるためには、薬食審で「この疾病の治療に効能効果がある」と承認されることが前提です。ここで「公知申請を行ってよい」と薬食審が判断した医薬品については、ほぼ確実に薬事承認されていることから、このような特例が設けられたものです。▽治験期間▽薬食審の審査期間▽中医協での保険収載に向けた審査期間―を大幅に短縮して保険診療が可能となるため、難しい疾病と闘う患者にとって重要な特例となっています。
今般、この特例によって保険償還が認められたのは次の3つの医薬品で、7月31日から適用されました。
(1)臓器移植を行った場合の免疫抑制剤である「ミコフェノール酸 モフェチル」(販売名:セルセプトカプセル250)のループス腎炎に対する使用
(2)抗うつ剤である「アミトリプチリン塩酸塩」(販売名:トリプタノール錠10、同25)の末梢性神経障害性疼痛に対する使用
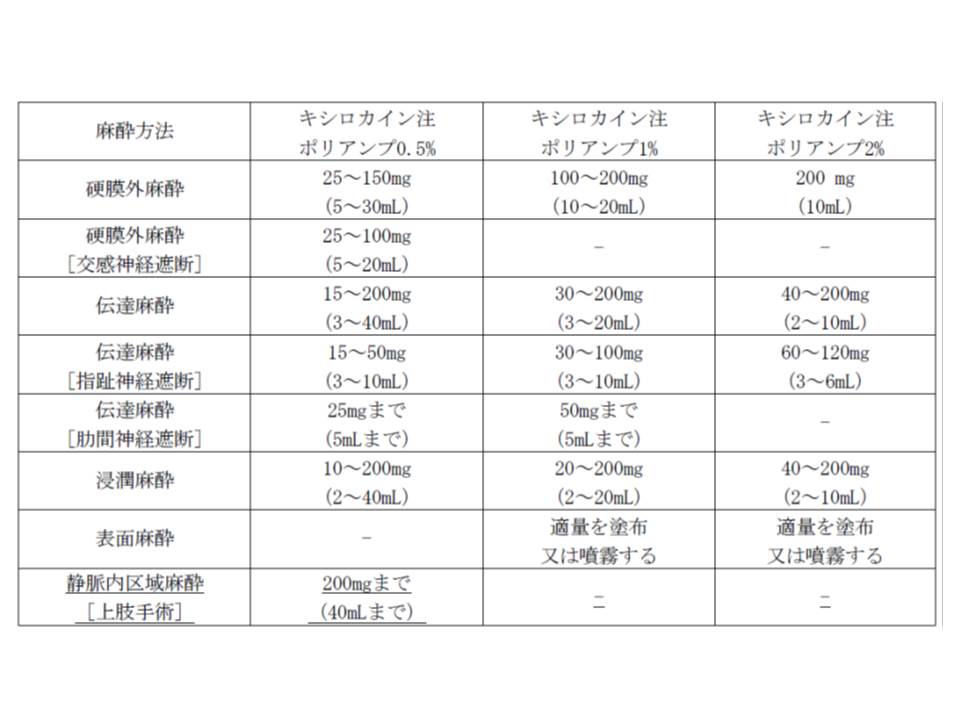
(3)局所麻酔在である「リドカイン塩酸塩」(販売名:キシロカイン注ポリアンプ0.5%)の上肢手術における静脈内区域麻酔
このうち(1)の「ミコフェノール酸 モフェチル」については、ループス腎炎治療として投与する場合、その開始時には「原則として副腎皮質ステロイドとの併用」をすることが必要です。
また、「ミコフェノール酸 モフェチル」には催奇形作用があり、国内外で患者から先天性奇形を有する児の出産が報告されているため、本剤の成分に過敏症の既往歴がある人のほか、「妊婦または妊娠している可能性のある女性」も禁忌の対象となっている点に留意が必要です。
一方、(3)の「リドカイン塩酸塩」を上肢手術における静脈内区域麻酔に用いる場合には、1回200ミリグラムが基準最高用量となりますが、年齢、麻酔領域、部位、組織、症状、体質により適宜増減することが必要です。
【関連記事】