薬などの費用対効果、まず既収載品の再算定に活用、価格への反映は18年度改定時か―中医協・専門部会
2015.6.24.(水)
2016年度の次期診療報酬改定において、医療技術の保険収載や価格設定などに費用対効果評価を試行導入する方向で議論が進んでいます。厚生労働省は24日、中央社会保険医療協議会の費用対効果評価専門部会に「試行的導入の在り方」に関するたたき台を示しました。
厚労省は、費用対効果評価の活用法には「新規技術の保険収載の可否の判断や価格への反映」や「既収載品の償還継続や再算定」などさまざまあることを紹介しましたが、専門部会ではまず「既収載品の再算定」に活用してはどうかとの意見が強くなっています。ただし実際に価格へ反映されるのは、次々回の2018年度改定時となりそうです。
費用対効果評価は、中医協の森田朗前会長(国立社会保障・人口問題研究所長)が「医療保険財政が厳しい中では、あらゆる新規技術を保険導入することは難しくなってくる。保険導入を判断する基準の1つとして費用対効果評価などを検討する必要があるのではないか」と提案したことを受けて、中医協で議論が続けられています。
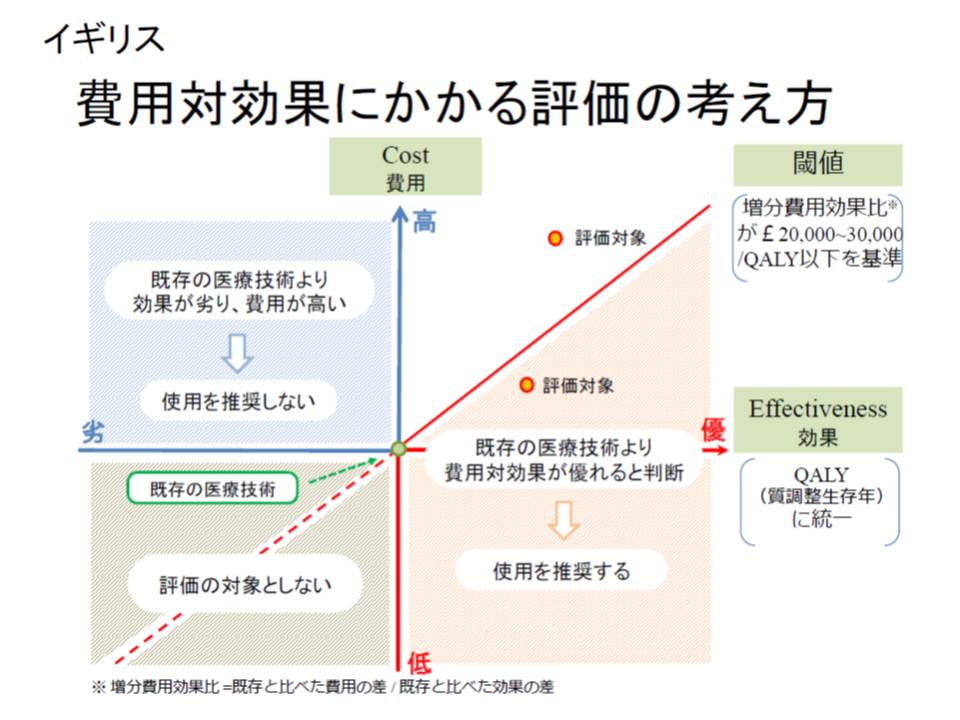
英国では、新薬などを公的保障の対象とするかを判断する際に、実際に費用対効果評価が用いられており、例えば「ある新薬は、既存薬に比べて効果が一定程度高いが、費用(価格)に見合った効果ではない。保障対象とする場合には、メーカーの希望価格を下げる必要がある」などの判断をNICE(National Institute for Health and Care Excellence)という公的機関が行っています。
わが国でも「16年度の次期診療報酬で試行導入する」方向で議論が進んでおり、24日の費用対効果評価専門部会で「試行導入の在り方」について議論しました。
なお、5月27日の前回会合では、診療側の鈴木邦彦委員から「試行導入は慎重に検討すべき」との消極的な意見も出されていましたが、今回は反対意見は出されず、試行導入に向けて着実に前進していることがうかがえます。
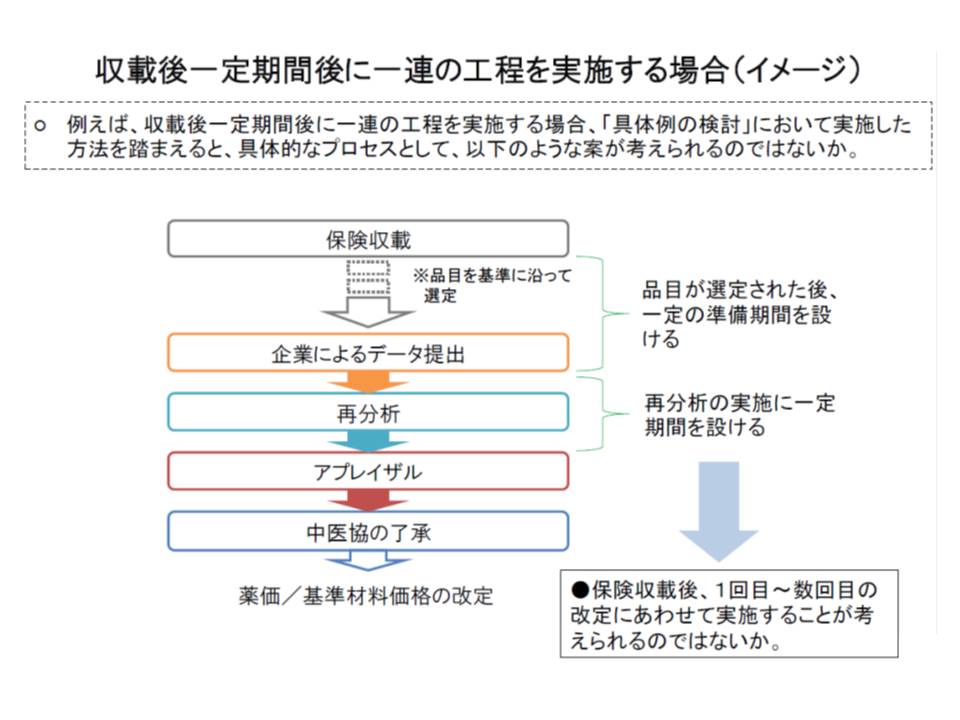
実際に、医療技術の費用対効果評価を行うに当たっては、次のような手順が取られます。
(1)医薬品や医療材料のメーカーから、費用や効果に関するデータを提出してもらう
(2)提出されたデータを専門家が再分析する
(3)データの分析結果に加えて、社会的状況などのさまざまな観点からの評価を行う(アプレイザル)
(4)評価結果を保険償還の可否や価格設定などに反映させる
(1)のデータがなければ、続く評価が行えないため、厚労省保険局医療課の佐々木健企画官は「あらかじめ選定基準を定めて、対象品目を選定した上で、メーカーにデータ提出を義務化してはどうか」との提案を行いました。また、メーカーが「高い価格設定を行ってほしい」と希望する場合などには、任意で「効果が高い」ことを示すデータの提出も認める方向です。
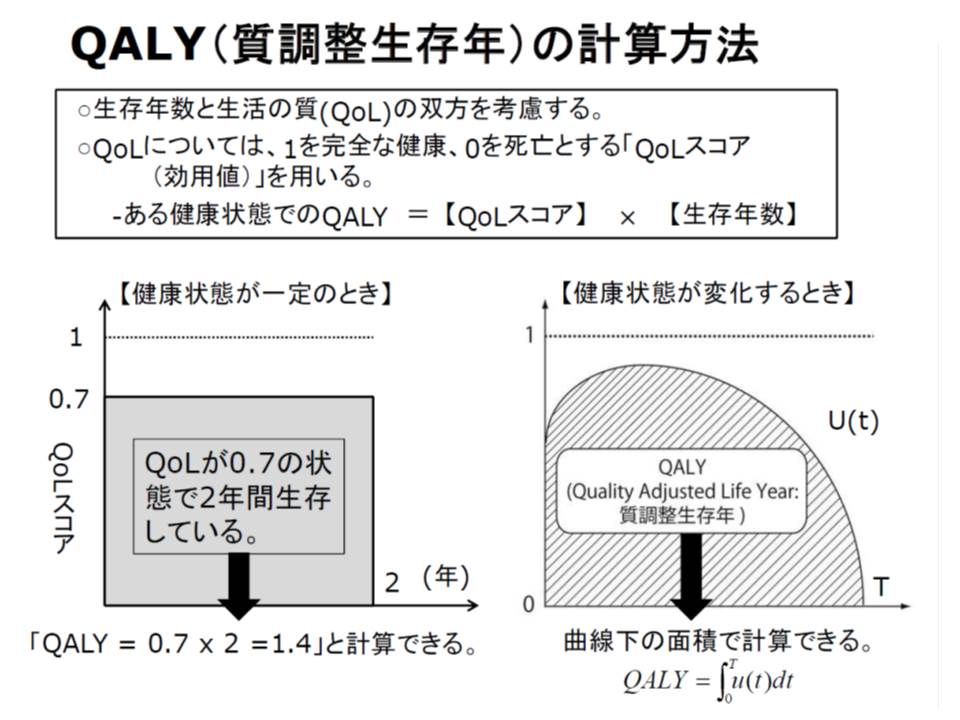
どのようなデータ提出を求めるのかは、次回以降、詳細を詰めることになりますが、例えば、英国で使用されているQALY(質調整生存年、健康状態を加味した生存年数)や臨床検査値、治癒率、死亡率などが候補と考えられます。
この点について土屋裕専門委員(エーザイ株式会社代表執行役)は、「データ提出には時間も費用も人手もかかることを考慮してほしい。また選定基準は透明なものにしてほしい」と要望しています。
厚労省は選定基準について、▽補正加算の要件を満たす▽原価計算方式で算定される▽単価や売上高が一定以上―などを例示しました。後に述べる体制などを考慮すると、対象品目を相当程度限定することになりそうです。
(2)の「データ再分析」は、医療経済学の専門家が公正・中立な視点で行うことになります。
再分析を行う体制について、諸外国には数十人程度の専門家で構成される組織を設置している所もあります。この点について厚労省は、▽厚労省内部で対応▽既存の公的組織に新部署を設置▽新組織を設置―といった提案を行っていますが、わが国には医療経済学の人材が不足していることもあり、当初から大規模な組織を設置することは難しいかもしれません。
(3)のアプレイザル(appraisal)は、英国で費用対効果評価のみを判断基準としていた時代に「抗がん剤の給付導入を拒否する」事例が多く発生し、患者に不利益を与えたという反省から導入されたものと言われます。
費用対効果に加えて、例えば「致死的な疾患での延命治療に不可欠である」「小児や障害者などの治療に効果がある」といったさまざまな要素を総合的に加味して、給付対象(わが国では保険収載)とすべきかどうかを評価する工程です。
諸外国では、このアプレイザルを公的な組織が行っていることが多いため、厚労省は▽費用対効果評価専門部会で行う(ただし非公開)▽費用対効果評価専門組織(仮称)を新設する―ことなどが考えられると提案しました。
この点について鈴木委員は、「医薬品や医療機器の分野ごとに専門家組織を設けてはどうか。その際には患者代表も加わってもらうべき」との考えを述べています。
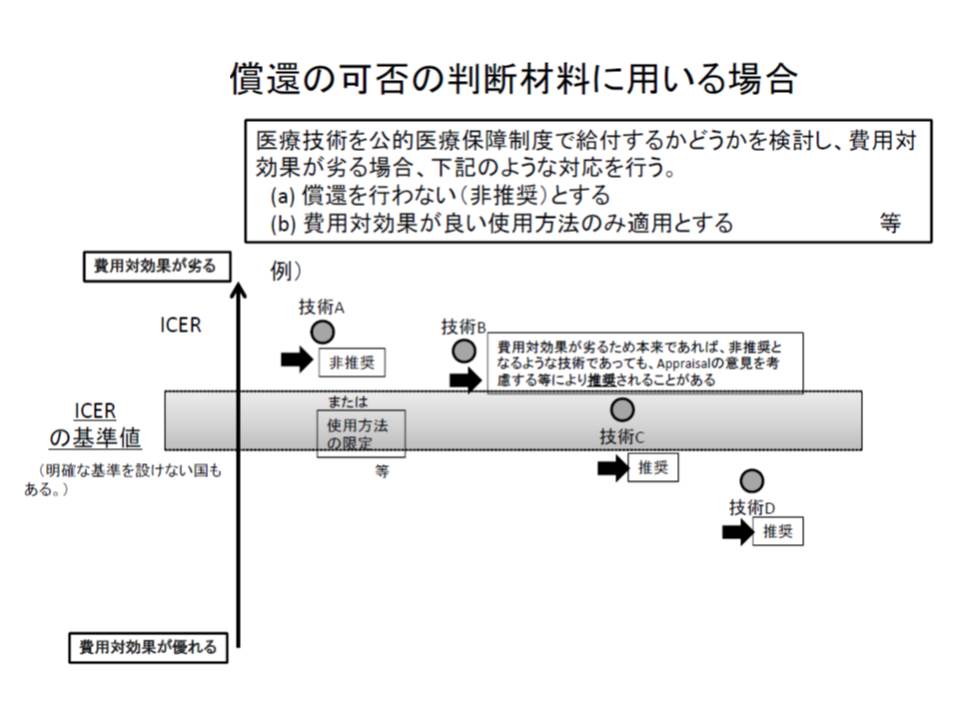
(1)から(3)の工程で得られた「費用対効果評価」の結果をどう生かすのが最大のポイントと言えるでしょう。厚労省は、次の4つの活用方法があることを紹介しました。もちろん、これらを組み合わせることも可能です。
(a)保険収載時に、償還(保険収載)の可否を判断する(対象は新薬)
(b)保険収載時に、償還価格(薬価や材料価格など)に反映させる(同)
(c)収載から一定期間後に、償還(保険収載)継続の可否を判断する(対象は既収載品)
(d)収載から一定期間後に、再算定を行う(同)
ここで問題となるのが、費用対効果の分析、特に(1)の「メーカーによるデータの準備」と(2)の「専門家による再分析」には相当の時間がかかることです。メーカー側は(1)の準備に「1年程度」かかると主張しており、(2)の再分析にも「通常、3-6か月」程度かかります。
すると(a)(b)の「保険収載時の活用」のためには、1年半以上前に企業にデータ提出を要請しなければいけないことになります。仮に16年4月の新薬収載に活用する場合には、既に要請期限を過ぎていることになります。
このため鈴木委員は、「(a)や(c)の保険収載の可否に活用すると、患者のアクセスに問題が生じる。当面は、(d)の既収載品の再算定に活用し、将来的に(b)の新薬の薬価に反映することが考えられる」との見解を示しました。
支払側の白川修二委員(健康保険組合連合会副会長)も「ドラッグラグが生じてはいけない。来年4月の試行導入では(d)の既収載品の再算定に用い、新薬についてはメーカーにデータをできる限り添付してもらう、ことが現実的だろう」と鈴木委員と同じ考えを述べています。
こう見ると、16年度の次期改定からデータ提出をメーカーに要望し、1-2年かけて分析やアプレイザルを行うこととなり、実際に薬価や材料価格などに費用対効果の結果が反映されるのは18年度改定時となりそうです。もちろん厚労省保険局医療課の担当者は「試行導入にはさまざまな考え方がある」と述べ、具体的な導入スケジュールには言及していません。
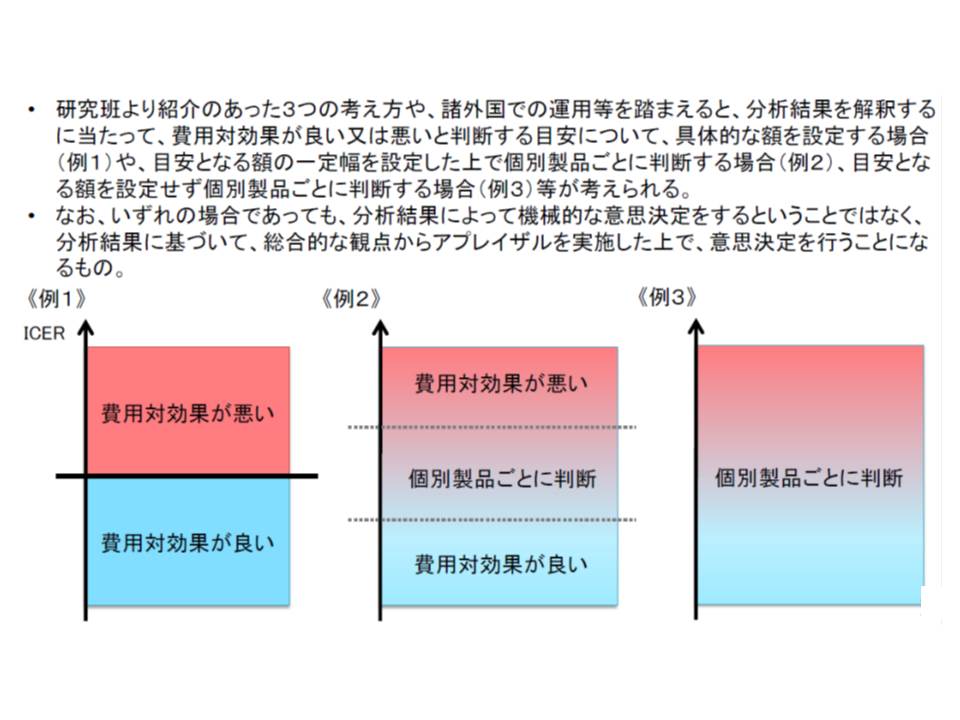
また、費用対効果評価の活用に当たって「一定の基準」を設けるべきかも重要な点です。英国には「1QALY(いわば、1年間健康で生存できること)を得るための費用が2-3万ポンドより低いと、費用対効果に優れている」という大まかな基準があるといいます。
こうした基準をわが国でも導入すべきかについて、鈴木委員は「数値基準は1人歩きしがちだ。個別製品ごとに判断すべき」と述べ、一律の基準は導入すべきでないとの考えを述べています。
【関連記事】
費用対効果評価、16年度改定での試行導入で攻防、6月にも試行案を提示―中医協・費用対効果評価専門部会
病院合併後のDPC継続参加、基準順守を原則としつつ事例ごとに判断へ―中医協総会