患者申出療養の詳細固まる、原則「臨床研究」として実施し、保険収載を目指す―中医協
2015.9.30.(水)
来年(2016年)4月からスタートする患者申出療養の詳細が、30日に開かれた中央社会保険医療協議会の総会で了承されました。
国が安全性・有効性などを確認し、あくまで「保険収載」を目指す仕組みとして構築され、「混合診療の解禁ではない」ことが明確に打ち出されています。
厚生労働省は今後、さらに具体的な部分を詰め、必要な法令改正などを行うとともに、臨床研究中核病院などに対して準備を進めるよう求める考えです。
患者申出療養は、安倍晋三首相が導入を決定した新たな保険外併用療養制度です。「困難な病気と闘う患者からの申し出」を受け、安全性・有効性などを確認したうえで、新規の技術については申請から6週間、前例のある技術については申請から2週間で「保険外の診療と保険診療との併用を認めるか否か」の結論を出します。
8月26日に開催された中医協総会で「患者申出療養は原則として臨床研究の一環として実施し、最終的には保険収載を目指す」ことが確認されました。保険収載を目指さない医療技術は対象となりません。また9月9日の中医協総会では患者団体から意見を聴取しており、そこでは「混合診療の解禁にならないようにしてほしい」との要望が出されました。
厚労省は患者団体の要望なども踏まえて検討を続け、30日の中医協総会に最終的な制度設計案を提示。中医協はこれを了承しています。
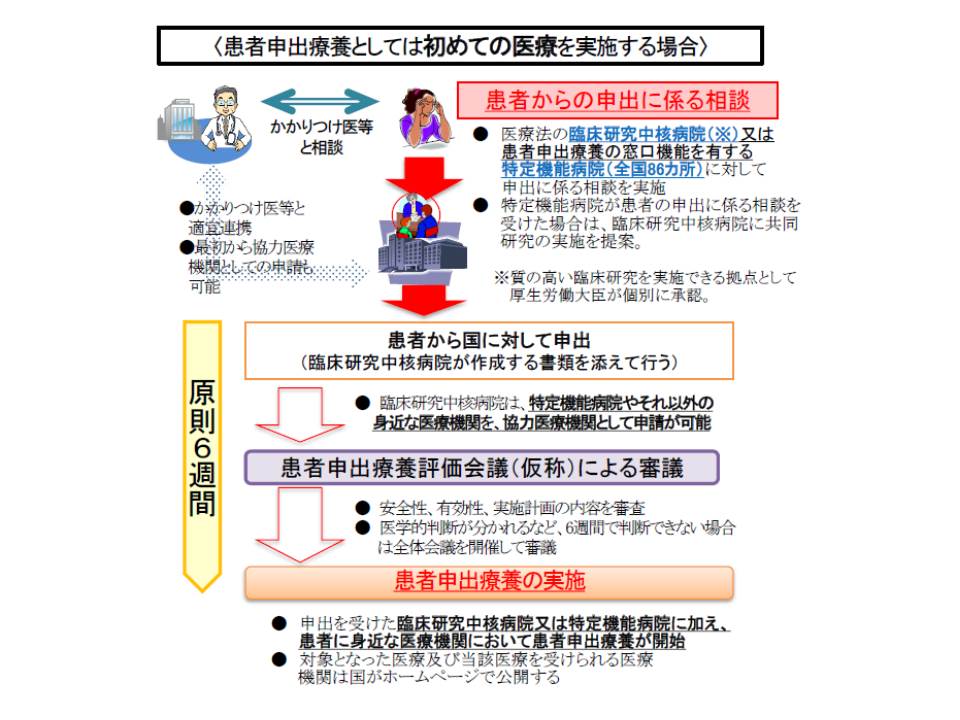
新規の医療技術を患者申出療養として実施する場合の流れを確認すると、次のように整理できます。
(1)患者がかかりつけ医などと相談し、「保険外の最先端医療技術」と「保険診療」との併用を希望した場合、臨床研究中核病院(医療法第4条の3)などに申し出る
↓
(2)臨床研究中核病院は、患者に有効性・安全性などを説明した上で、「実施計画」を立てる。実施計画は▽実施届出書▽臨床研究計画書▽患者説明同意文書▽医療技術の概要図▽薬事承認・保険収載までロードマップ―で構成され、これらを盛り込んだ「意見書」を患者に示す
↓
(3)患者は、臨床研究中核病院の「意見書」のほか、「患者の署名入りの申出書」「臨床研究中核病院との面談記録」などを添えて、国に患者申出療養の申請を行う
↓
(3)国に設置される「患者申出療養評価会議」(仮称)で有効性や安全性、患者がリスクを理解しているかなどを審議する(原則6週間)
↓
(4)申請が認められれば、その医療技術が当該臨床研究中核病院などで実施される。当該医療技術は厚生労働大臣によって「告示」される。
(2)に示した通り、患者申出療養は「臨床研究」として実施されることが原則です。しかし、例外的に臨床研究としての実施が難しい場合も考えられ、この場合には実施計画から「臨床研究計画書」が除かれます。
また(2)の意見書の中には、「当該医療技術にかかる費用」も明示することになっています。先進医療と同様に「保険診療部分の費用」と「保険外の費用」とを明らかにし、患者が経済的負担を予見できるようにするためです。
ところで厚労省は、患者申出療養の対象となる医療として、▽既に実施されている先進医療を身近な医療機関で実施する場合▽既に実施されている先進医療を計画対象外の患者に行う場合▽まったく新規の医療を行う場合▽現在行われている治験の対象とならない患者に治験薬などを使用する場合―を想定しています。
このうち「治験対象とならない患者へ治験薬などを使用する」場合には、臨床研究中核病院は、まず「治験」または「人道的見地からの治験」(日本版コンパッショネートユース)につなげられないかを検討します。つなげられない場合に初めて、患者申出療養としての実施を検討することになります。
また患者申出療養は、名称どおり「患者の申し出」が起点となりますが、医学に詳しくない患者が適切に申し出を行えるよう、▽臨床研究中核病院において相談マニュアルの整備や研修を行う▽患者申出療養の候補となる医薬品などのリストを学会や国立高度専門医療研究センターで作成する―などの支援を行うことにしています。
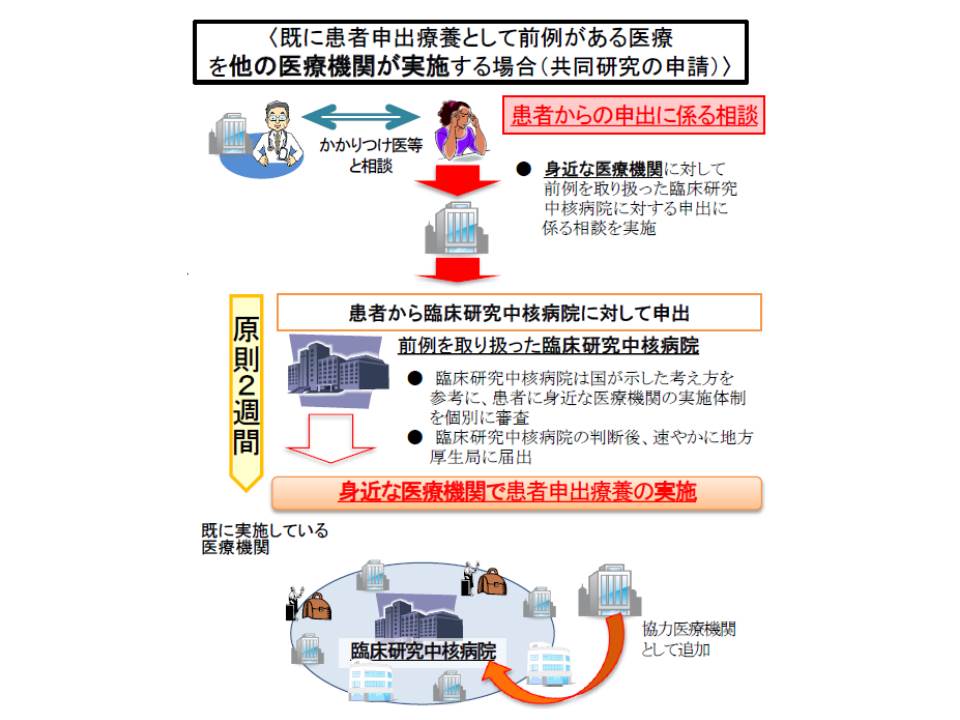
患者申出療養として前例がある場合には、先とは違う流れとなります。
(i)前例のある医療技術を身近な医療機関で受けることを希望する患者が、臨床研究中核病院にその旨を申し出る
↓
(ii)臨床研究中核病院は、患者申出療養評価会議が作成した基準を参考に、当該「身近な医療機関」で当該医療技術の実施が可能かを判断する(原則2週間)
↓
(iii)臨床研究中核病院は「実施が可能」と判断した医療機関を地方厚生局などに届け出る。患者は、その医療機関で当該医療技術を受ける。
この「前例のある医療技術を身近な医療機関で実施する」場合も、原則として前述(2)の実施計画に基づいて行われるため、費用は臨床研究中核病院で行われる場合と変わりません。
ところで患者申出療養は臨床研究の一環として「実施計画」に基づいて実施されることが原則であり、計画の中には▽対象患者の年齢▽疾患の重症度▽合併症の有無―といった患者適格基準が定められることになります。
では、適格基準に合致しない患者が「患者申出療養として前例のある医療技術」を受けることを希望した場合にはどうなるのでしょう。厚労省の示した制度設計では、この場合に患者は臨床研究中核病院ではなく、「国」に対して申し出を行うことになっています。
国はこの申し出を受けた場合、臨床研究中核病院に対して▽実施計画の変更▽新たな実施計画の作成―を求めることになります。もちろん、「あなたの場合、患者申出療養は受けられません」と判断されるケースも出てくるでしょう。
後者の「新たな実施計画の作成」となった場合には、1つの医療技術について複数の実施計画が運用されます。例えば未承認のAという抗がん剤について、まず患者αらに対応した実施計画αが動き、その後、実施計画αの対象外となった患者βらに対応した実施計画βが運用されることになるのです。
この点について厚労省保険局医療課の担当者は「告示をどのような形にすべきかを詰める必要がある」とコメントしています。現在の先進医療では、例えば「根治不能な胃がん患者に対する○○腹腔内投与療法」といった具合に、かなり細かく告示されていますが、患者申出療養でどのような記載となるのか注目されます。
前述のとおり患者申出療養は「保険収載を目指す」保険外併用療養の1つです。このため臨床研究中核病院は国に対して実績などを報告することが義務付けられ、進捗が思わしくない場合には「取り組みの促進」が求められ、合理的な対応を講じない場合には「患者申出療養からの除外」も行われます。
厚労省は、中医協で了承された制度設計をベースに、詳細はさらに詰めて、近く必要な省令・告示・通知などを示すことになります。同時に、制度の中心的役割を担う臨床研究中核病院などに対して必要な準備を求めていきます。
【関連記事】
患者申出療養の提案受けた臨床研究中核病院、「人道的見地からの治験」の有無をまず確認―中医協総会
「紹介状なしの大病院受診患者」への新たな定額負担、厚労省は「最低額を定め、個別病院設定」する案を提示―中医協