費用対効果評価、対象は「保険収載後、1-2回の改定を経たもの」に―費用対効果評価専門部会
2015.11.20.(金)
2016年度の次期診療報酬改定で試行導入される「費用対効果評価」の対象には、当面「保険収載後、1-2回の改定を経た医薬品・医療機器」としてはどうか―。20日開かれた中央社会保険医療協議会の費用対効果評価専門部会で、厚生労働省がこのような提案を行いました。
厚労省は、対象品目を選定する基準として「売上高の高い、『原価計算方式で算定された品目』と『補正加算のある類似薬効比較方式で算定された品目』」という考えも示しています。
医薬品や医療機器の保険収載に当たり、費用対効果評価の考え方を試行導入することが決まっています。中医協の専門部会では、これまでに▽試行導入においては既収載品の再算定に用いる▽評価を行う組織を設ける▽総合的な評価(アプレイザル)において、倫理的・社会的影響などに関する視点での評価は、特別のルールを定めず、個別技術ごとに考えていく―といった方針が固まっています。
20日の専門部会では、(1)選定基準の具体的な要件(2)試行的導入において用いるガイドライン(3)費用対効果評価に基づく再算定の具体的な方法(4)新規収載時に求めるデータ提出に係る取り組み―が議題となりました。
まず(1)の選定要件については、厚労省から次の3要素に基づいて検討しては同かとの提案が行われました。
(a)原価計算方式で算定されたもの(新規性を高いことを直接的に評価している)
(b)一定の補正加算が認められた、類似薬効(材料では機能区分)比較方式で算定されたもの
(c)ピーク時の売上高の高いもの
ここから、「aかるc」あるいは「bかつc」という要件が設定されるものと予想されます。
もっとも、メーカーにおける開発を促進しなければならない「指定難病や血友病、HIV感染症などの希少疾患に対する治療に用いるもの」や「未承認薬等検討会議などからの開発要請品目、公募品目」は除外されます。
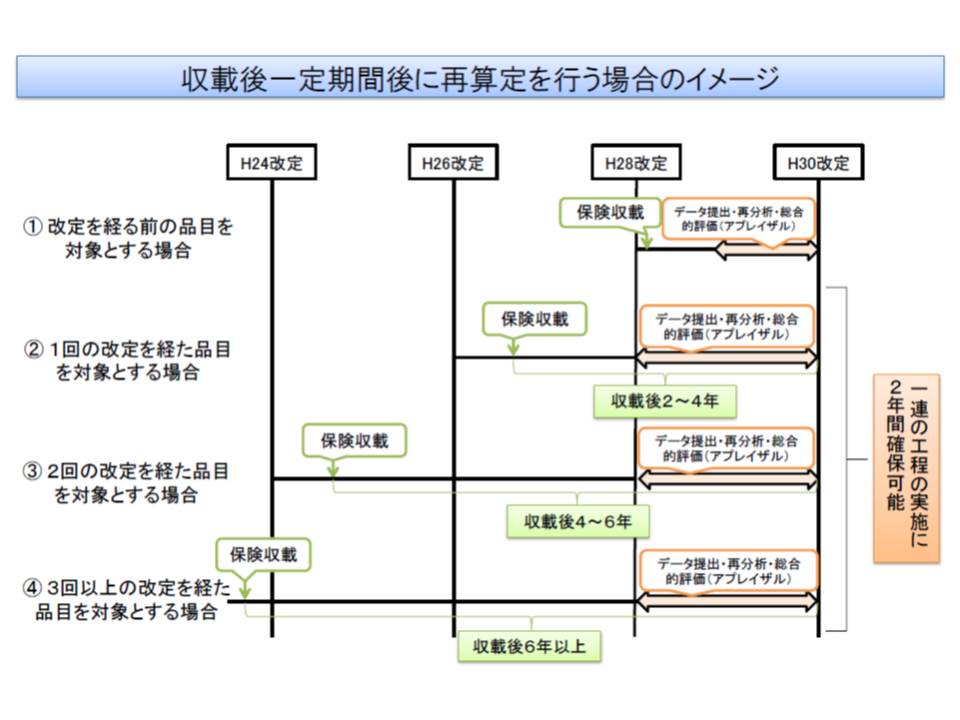
また、厚労省は時間軸でも対象範囲を限定する考えで、「保険収載後、1回または2回の改定を経た品目」とすることも提案しています。2016年度から試行導入し、続く18年度の改定時に再算定を行うというスケジュールが確定したとすれば、「保険収載後、2-6年」が経過し、前述の「aかつc」あるいは「bかつc」の要件を満たす医薬品・医療機器について再算定が行われることになります。
2016年4月頃に具体的な対象品目が選定され、メーカーにデータ提出が要請されます。厚労省は、費用と効果などに係るデータの準備に「1年程度はかかるのではないか」と見ており、2017年4月頃にデータが揃ったとして、そこから専門組織や中医協で分析・総合的な評価などを行い、2018年4月までに再算定(価格見直し)が行われる、というスケジュール感を描くことができます。
なお、一度費用対効果評価を行った品目について、後に更に評価を行うのかどうかは決まっていません。試行の中で検討されることになります。
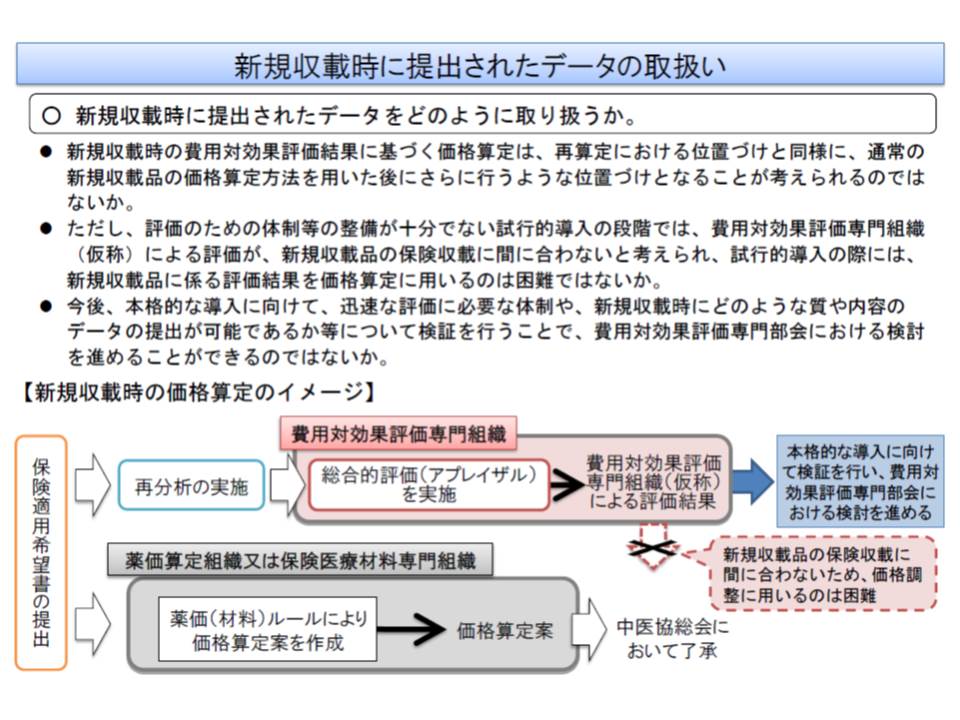
また試行時点では、新規収載品の価格設定に費用対効果評価の考え方は導入されませんが、厚労省は、メーカーへのデータ提出を求める考えです(対象は前述のa-cに基づいて選定)。新規収載品と既収載品ではデータの蓄積量が圧倒的に異なるため、新規収載品のデータ準備には困難も予想されます。その際、どのような点で困難なのかを探るのも「試行導入」の目的の1つになりそうです。
この点について土屋裕専門委員(エーザイ株式会社代表執行役副社長)は、「新薬などのデータ準備には時間がかかるので、配慮してほしい」と要望しましたが、花井十伍委員(日本労働組合総連合会「患者本位の医療を確立する連絡会」委員)は、「準備期間がかかると思うので、開発段階からデータを整備するようにしてほしい。早めに対象品目の選定基準を固めれば、メーカーの準備期間も長くなる」と述べています。
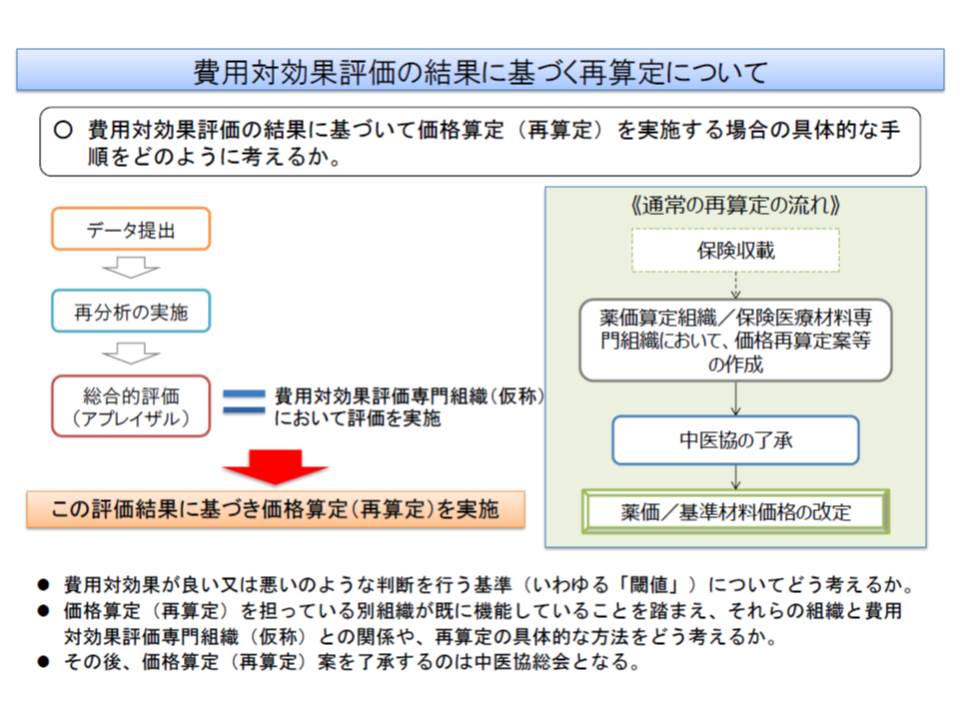
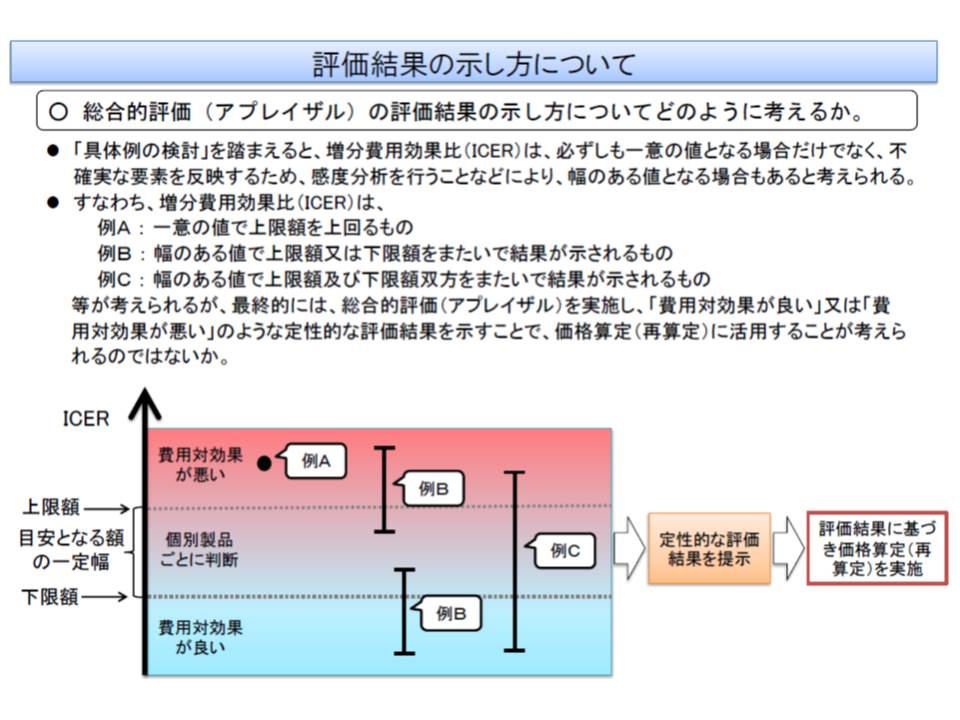
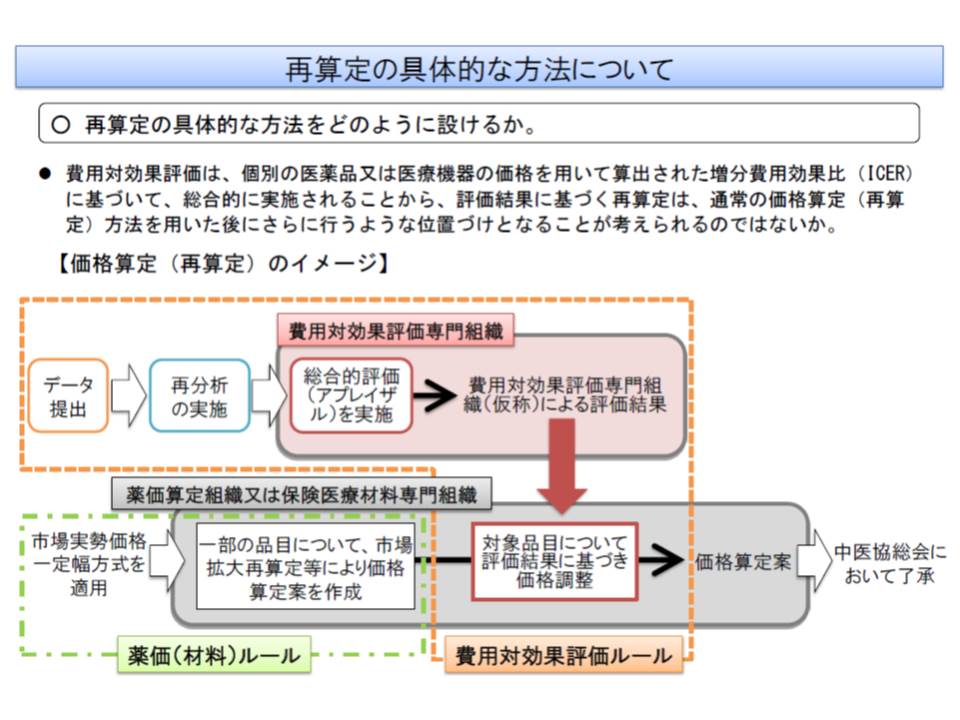
では、費用対効果評価に基づく再算定は、どのように行われるのでしょう。
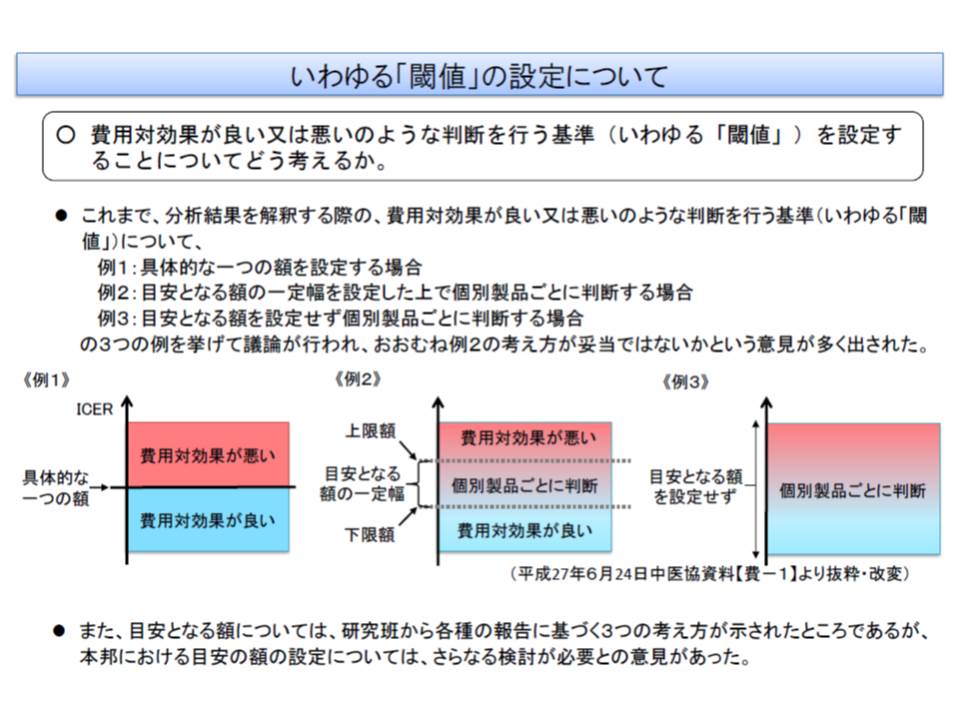
厚労省は、「費用対効果が良い、悪い」を判断するための基準(閾値)を設け、個別製品ごとに価格の妥当性を判断してはどうかと提案しています。英国では、閾値を「2万―3万ポンド」としており、これよりも低い値となれば「費用対効果に優れており、保障の対象に推奨する」といった1つの判断基準が設定されており(もちろん、他の要素も勘案して最終的に保障対象にするかを決定する)、わが国でも判断基準には一定の幅(上限と下限)を設けることになりそうです。
この判断基準(閾値)は、原則として一律に設定され、「●●薬の閾値は○円から△円、■■薬の閾値は□円から▲円」といったように個別に設けられるものではありません。厚労省は、▽一般的に広く受け入れられている既存の医療に掛かる費用▽国民がいくらまでなら支払っても良いと考えるか(支払意思額)▽1人当たりGDPなどの経済指標―を参考にする考えです。あわせて「事例の積み重ねによる精緻化」や「わが国の国民が考える支払意思額の調査」なども行われます。
薬価算定組織や保険医療材料専門組織が価格案を設定した後、費用対効果評価専門組織(仮称)でデータと閾値を比較して価格の見直し(再算定)を行い、それを中医協が了承するという流れになります。
20日の専門部会には、企業や公的な専門組織でデータの分析を行う際のガイドラインも示されました。
そこでは、「分析の差異の比較対象は無治療や経過観察でもよいが、比較対象に課題がある場合には事前に専門組織などと協議する」「費用や効果に及ぼす影響を評価するには十分長い期間を用いる」「効果を判定する指標はQALY(質調整生存年)を基本としつつ、その他の指標も用いることができが、QALYを使用しない場合には事前に専門組織などと協議する」「公的介護費用や疾患によって仕事や家事ができない結果生じる生産性損失は基本分析には含めない」ことなどが示されています。
費用対効果評価の試行導入に向けて、検討事項については一通りの議論を終えた格好です。今後、細部を詰めを行った上で、具体的な制度が近く固まる見込みです。
【関連記事】
費用対効果評価、試行段階では社会的影響を評価する特別ルールは定めず―費用対効果評価専門部会
費用対効果評価の結果は医薬品・医療機器の再算定に活用―費用対効果評価専門部会