特定機能病院に医療安全管理体制強化や外部監査委設置などの要件追加―厚労省
2016.2.1.(月)
特定機能病院の承認要件に、新たに「医療安全管理体制の強化」「外部監査体制の設置」などを加える―。こうした見直し案が、28日に開かれた「特定機能病院及び地域医療支援病院のあり方に関する検討会」で取りまとめられました。
4月から新承認要件がスタートしますが、全項目について10月まで、一部項目では来年(2017年)4月あるいは再来年(2018年)4月までの経過措置が設けられます。
東京女子医科大学病院と群馬大学附属病院の2つの特定機能病院で重大な医療事故が発生し、そこでは病院のガバナンスに問題点があることが分かりました。厚生労働省は事態を重く見て、べての特定機能病院に立入検査を行うとともに、塩崎恭久大臣を本部長に据えた「大学附属病院等の医療安全確保に関するタスクフォース」を設置し、特定機能病院の承認要件を見直してはどうかとの考えをまとめました。
「特定機能病院及び地域医療支援病院のあり方に関する検討会」では、タスクフォース案をベースに議論を重ね、今般、承認要件見直し案を取りまとめたものです。
見直し案の柱は次の4本です。
(1)ガバナンスの確保・医療安全管理体制の強化
(2)インフォームド・コンセントおよび診療録などの整備
(3)高難度新規医療技術の導入プロセスの整備
(4)職員研修の必須項目の追加や、効果測定の実施
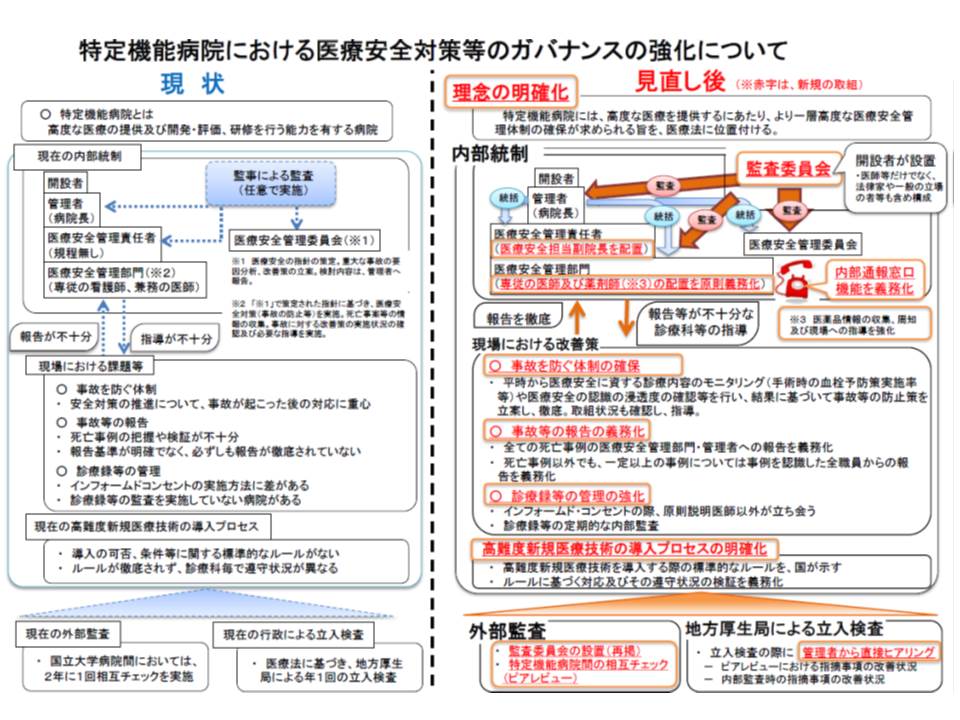
このうち(1)のガバナンス確保・医療安全管理体制の強化については、(A)内部統制の強化(B)外部監査の徹底(C)取り組みに応じた評価・公表の仕組み―の3つの大項目に分けた見直しが整理されています。ここが、今般の見直しの最大のポイントと言える部分であり、詳しく見ていきましょう。
(A)の内部統制については、医療安全に係わる組織体制を強化するとともに、その責任を明確化することになります。具体的には、次のような見直しが行われます。
まず、特定機能病院の管理者に対し新たに「医療安全管理責任者の配置義務」を課します。医療安全管理責任者は、「医療安全管理部門」「医療安全管理委員会」「医薬品安全管理責任者」「医療機器安全管理責任者」の業務を統括し、副院長職(常勤の医師・歯科医師)が就くことになります。
次に、医療安全管理部門の業務について、「医療安全管理委員会の事務」「自己発生時における診療録の確認や患者への説明など」「医療安全に係る連絡調整」のほか、新たに「医療安全に関する診療内容のモニタリング、職員の医療安全に関する認識状況の確認」を追加する。
また医療安全管理部門の体制を強化するために、専従の「医師、薬剤師および看護師」を配置する規定が設けられます。ここでいう専従とは「常勤職員で、就業時間の8割以上、該当業務に従事している」ことを意味します。ただし、「常勤職員で、就業時間の5割以上、該当業務に従事している」者を同職種で複数配置している場合も、専従とみなすことが可能です。
さらに、医療安全管理委員会の業務として、「重大な問題が発生した場合の速やかな原因分析」「分析結果を活用した改善策の立案」「事故防止に向けた改善の実施や職員への周知」「改善策の実施状況調査」などが追加されます。
一方、インシデント・アクシデント事例が発生した場合、職員は速やかに医療安全管理部門のその内容などを報告することが求められます。具合的には、死亡事故か否かで報告事項が区別されます。
▽入院患者が死亡した場合、「死亡の事実」と「死亡前の状況」を報告する
▽死亡以外の場合で、通常の経過では必要ない処置・治療が必要になり、特定機能病院の管理者が定める水準以上の事象が発生した場合、「事象発生の事実」と「事象発生前の状況」を報告する
なお、昨年10月からスタートした医療事故報告制度では「予期しなかった事故」が報告対象ですが、ここでは「当該事象を予期していたか否か」に関係なく報告することが必要です。
また医療安全管理委員会は、こうした報告が適切に行われているかを確認し、その結果を管理者に報告しなければいけません。仮に報告が不十分であれば、必要な研修・指導などを行うことになります。
ところで、インシデント・アクシデント報告そのものは職員が行いますが、管理者には「報告させる義務」が課せられます。また事故の隠ぺいなどが生じないよう、管理者と開設者には、いわゆる「内部通報窓口」を設置する義務も課せられます。
このほか、医薬品の適切・安全な使用に向け、次のような見直しも行われます。
▽医薬品安全管理責任者(医薬品使用に係る安全管理のための責任者)を配置する。責任者は「医薬品安全使用のための業務手順書の作成」や「医薬品安全使用のための研修」などを行う
▽医薬品安全管理責任者は、「医薬品情報の整理、周知、周知状況の確認」「適応外・禁忌に該当する処方に関して、処方の把握のための体系的な仕組みの構築」などを行う担当者を指名する
▽特定機能病院の管理者は、自ら定期的に医療安全管理研修を受講するとともに、医療安全管理責任者・医薬品安全管理責任者・医療機器安全管理責任者に、定期的に医療安全管理研修を受講させなければいけない
これまで見てきたように、院内の安全管理体制を強化することは極めて重要ですが、やはり限界もあります。そこで新たに外部監査体制の構築を義務化することになりました。
まず、管理者に対して「監査委員会」の設置が義務付けられます。監査委の委員は3人以上で、委員長と過半数の委員は「当該病院と利害関係のない者」であることが必要です。
監査委の業務は次の通りで、少なくとも年2回以上開く必要があります。
▽医療安全管理責任者、医療安全管理部門、医療安全管理委員会、医薬品安全管理責任者などの業務状況について、管理者などから報告を求め、必要に応じて確認する
▽必要に応じ、医療安全管理についての是正措置を講ずるよう、開設者・管理者に意見する
▽安全管理状況や改善状況についての結果を公表する
また、特定機能病院には、わが国で最高水準の医療を行うことが求められているので、特定機能病院同士の相互監視(ピアレビュー)を行う体制も次のように構築する必要があります。
▽年に1回以上、他の特定機能病院に職員を立ち入らせ、医療安全管理の改善に向けた技術的助言を行わせる
▽年に1回以上、他の特定機能病院の管理者が行う職員の立ち入りを受け入れ、医療安全管理を改善するための技術的助言を受け入れる
技術的助言を行うために、立ち入りを行う職員は「インシデント・アクシデントの報告状況」「医療安全管理委員会の議論の状況」「高難度新規医療技術の導入プロセスの運用状況」について確認することが必要です。
また(3)の高難度医療技術とは「当該医療機関で事前に行ったことのない手術・手技で、人体への影響が大きいもの」を意味し、特定機能病院では▽実施の適否を確認する部門の設置▽当該医療技術実施の際に職員が遵守すべき事項などの規定▽未承認医薬品などの使用の適否を確認する部門の設置―などを行う必要があります。
また、高難度医療技術の導入は、概ね「診療科で、術者の技術レベルや体制などを検討し、審査担当部門に申請する」→「審査担当部門に、事前審査委員会を設置し、倫理的・科学的妥当性、実現可能性を審査する」→「管理者の承認」→「当該医療技術の実施」→「事後の検証」というプロセスを辿ることになります。
これらの見直しは今年(2016年)4月から運用されます。ただし、新たな部門の設置や外部監査委員の任命などには、相当の時間が必要でしょう。このため厚労省は、外部監査やピアレビューなどは来年(2017年)4月まで、「医師、薬剤師、看護師の医療安全管理部門への専従」と「医療安全管理責任者などに対する医療安全管理経験の要件化」などについては再来年(2018年)4月までの間、「既に承認を得ている特定機能病院は、新承認要件を満たすものとみなす」という経過措置が設けられます。
【関連記事】
特定機能病院に、「監査委員会」設置や「医療安全担当の副院長」配置を義務付け―厚労省
特定機能病院への集中立入検査を6月から実施、目的は「実態把握」―厚生労働省
女子医大病院と群馬大病院の特定機能病院の承認取り消し決定、特定機能病院の承認要件見直しも検討―塩崎厚労相