患者申出療養評価会議が初会合、厚労省「まずは既存の先進医療や治験の活用を」
2016.4.14.(木)
4月1日から、新たな保険外併用療養として「患者申出療養」がスタートしていますが、患者に迅速に新規の医療技術を提供する観点から、まず既存の評価療養(保険外併用療養)である「先進医療」や「治験」の活用も考えてほしい―。
4月14日に開催された「患者申出療養評価会議」の初会合では、こういった考え方が厚生労働省から提示されました(患者申出療養の告示はこちら、通知はこちらとこちら)。
また厚労省からは「患者申出療養に係る相談事例」情報などを蓄積し、広く情報提供していく考えも示されています。患者申出療養について「患者からの相談」を受けるのは一般の病院・診療所であり、さらに臨床研究中核病院だけでなく「患者に身近な医療機関での実施」も想定されています。すべての医療機関で制度の大枠を押さえておく必要があります。
目次
初めての患者申出療養は6週間、既存の場合は2週間で実施の適否を判断
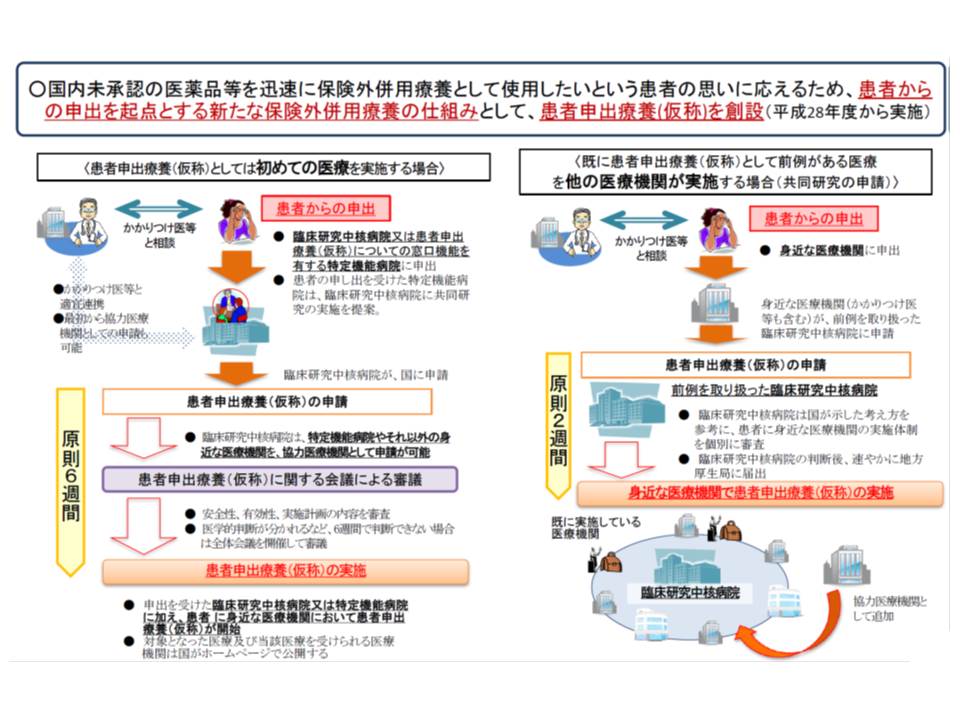
患者申出療養は、安倍晋三首相が導入を決定した新たな保険外併用療養制度で、この4月1日から制度としてスタートしています。「未承認医薬品(保険外診療)を使用したい」などといった患者からの申し出を起点として、安全性・有効性を確認した上で、保険診療との併用を認めるものです。
例えば、あるがん患者が「米国で画期的な抗がん剤が開発されたが、日本では承認されていない」という情報をキャッチしたとします。現在、未承認薬を治療に用いる場合、先進医療や治験などのケースを除いて、全額自己負担となってしまいます。しかし、患者申出療養では、その抗がん剤の安全性・有効性が一定程度確認できれば、入院や検査、手術などについては保険給付が受けられます。
中央社会保険医療協議会では、昨秋から具体的な検討を行い、次のような制度が固まっています(関連記事はこちらとこちらとこちら)。
【未承認薬などの最先端医療技術を「初めて」患者申出療養として実施する場合】
(1)患者がかかりつけ医などと相談し、保険外の最先端医療技術を保険診療と併用することを希望した場合、臨床研究中核病院(医療法第4条の3)や相談窓口などを設置した特定機能病院に相談する
↓
(2)臨床研究中核病院が臨床研究計画などを作成し、それらを添えて、患者が国に対して患者申出療養の申請を行う
↓
(3)国に設置された「患者申出療養評価会議」で有効性や安全性、患者がリスクを理解しているかなどを審議する(原則6週間)
↓
(4)安全性などが確認できた場合、その医療技術が当該臨床研究中核病院などで実施可能となる
【すでに「患者申出療養」として実施されている最先端医療を、身近な医療機関で受ける場合】
▽患者が、身近な医療機関に対して「患者申出療養を受けたい」旨の相談を行う
↓
▽患者が、臨床研究中核病院に対して「身近な医療機関で患者申出療養を受けたい」旨の申し出を行う
↓
▽臨床研究中核病院が、身近な医療機関での実施が可能かどうかを審査する(原則2週間)
↓
▽身近な医療機関の体制などが確認できた場合、その医療技術を身近な医療機関で受けることが可能となる
患者申出療養は「保険収載」を目指すもの、混合診療の解禁ではない
患者申出療養評価会議では、上記の(3)にあるとおり、安全性や有効性などを審議しますが、現時点では申し出がなされていないため、14日の初会合では制度の詳細に関する議論が行われました。
まず抑えておかなければいけないのは、患者申出療養は「混合診療を解禁する」ものではなく、「保険収載を目指す」仕組みであるという点です。優れた医療は広く国民全体が享受すべきものだからです。
このため厚労省は、同様に保険収載を目指す仕組みである「他の評価療養」(先進医療や治験)を利用できる場合には、その活用を十分に考慮すべきとしています。
ここで気になるのが、先進医療や治験と患者申出療養との関係です。例えばある未承認の抗がん剤について、すでに先進医療の研究や治験がスタートしている場合などには、相談を受けた臨床研究中核病院や評価会議では、▽先進医療や治験の対象患者に追加できないか▽先進医療の計画を変更できないか▽拡大治験(人道的見地からの治験)として実施できないか―などを検討することが必要です(関連記事はこちら)。
その上で「先進医療などの基準にはどうしても合致しない」といった場合などに、患者申出療養を選択することになります。
ただし、いずれの仕組みにも特性があるため、制度と患者の状況を勘案し、最適なものを選択することが必要でしょう。「○○のケースでは必ず先進医療の拡大をしなければならない」といった形での運用はなされない見込です。
患者申出療養は「臨床研究」として実施することが原則
また、患者申出療養は「保険収載を目指す」仕組みなので、臨床研究として実施する必要があります。具体的には、(2)で示したように、▽対象患者群▽エンドポイント―などを明確にした臨床研究計画書の作成などが必要です。
このため厚労省は、「人を対象とする医学研究に関する倫理指針」で定められた手続きに基づいたインフォームド・コンセントを実施することの必要性も強調しています。
ところで、申し出をする患者が、既存の患者申出療養の臨床研究計画で定められた対象患者群に合致しないケースも考えられます。この場合、▽既存の計画の変更▽新たな別計画の作成―を考慮することになります。
さらに、計画の変更や新規計画の作成もできない場合であっても、例外的に「元となる臨床研究計画と関連付けができるような場合」には、「臨床研究としては実施しない患者申出療養」とすることが考えられます。厚労省は、▽追加的な安全性・有効性に係る情報が得られる場合▽異なる対象範囲についての情報が得られる場合―といった具体例を示しています。
もっとも、この「臨床研究としては実施しない場合」であっても、前述の倫理指針に差定められた手続きを経る必要があります。
なお、「そもそも保険収載を目指さない」場合や、「エビデンスが不十分」な場合、さらに「臨床研究として実施できず、上記の例外にも該当しない」場合には、患者申出療養として実施することは認められません。この場合、既存の保険診療の範囲内で治療を受けるか、最新技術を全額自費で受けるかといった選択をすることになります。
評価会議で意見が割れるような場合には、6週間によらず慎重に審議
臨床研究中核病院で臨床計画が作成され、患者が国に申出を行うと、(3)の評価会議で実施の適否を判断することになります。申出の受理から判断までの期間は、「原則6週間」とされています。
しかし、▽構成員からの指摘が一定以上出され計画変更の必要がある▽構成員の評価が一致せず慎重な検討が必要である▽海外で未承認・海外で承認されていない適応でエビデンスの判断を慎重にする必要がある―ような場合には、6週間に限定せず、評価会議で慎重な検討を行うことになります。例えば、「倫理を専門分野とする構成員の意見が食い違っている」ようなケースが考えられます。
患者申出療養をどの医療機関で実施できるのか、事前に基準を設定
患者申出療養の実施が認められた場合、別の患者が「同様の医療を身近な医療機関で受けたい」と考えることもあります。この場合、当該医療機関での実施が可能か否かを臨床研究中核病院が、原則2週間以内に判断します。
その際、事前に「実施が可能か否かの判断基準」を定めておく必要があります。厚労省は、初めての患者申出療養を評価する際に、次の2点を定めておくことを求めています。
(a)臨床研究中核病院が「実施可能な医療機関の考え方」を定めておく(例えば、A臨床研究中核病院とB・C特定機能病院で実施可能と定めておくようなケース)
(b)臨床研究中核病院が「実施医療機関の追加に係る取り扱い」を定めておく(例えば、当該患者申出療養の実施に当たっては、●●の体制を整備していることが必要、などと定めておくようなケース)
なお、未承認の医薬品については、既承認医薬品の適応外使用に比べて、予期せぬ副作用が発生する蓋然性が高いことから、当初は「臨床研究中核病院、既に使用実績を持つなど一定の水準を満たす医療機関」に限定して患者申出療養を実施し、そこでの実績を評価した上で、実施医療機関の拡大を判断する、という運用を厚労省は考えています。
ちなみに、「実施可能」と判断された患者申出療養は、すべての臨床研究中核病院での実施が可能となる見込みです。
ゼロから患者申出療養をデザインする場合、半年から1年程度の準備期間
ところで、実際に最新の医療を受けられるまでにかかる期間はどの程度なのでしょう。(3)の「原則6週間」は、国が患者からの申し出を受理してから、評価会議で結論を出すまでの期間です。患者が申し出を行う前に、▽患者への説明▽エビデンスの収集▽院内の倫理審査▽臨床研究のデザイン―などを臨床研究中核病院で行うことになり、山崎力構成員(東京大学医学部附属病院臨床研究支援センター長)は「ゼロからデザインする場合には、どれほど頑張っても半年から1年程度かかる」と見通しています。
ただし、例えば既に治験が動いており、適格基準から外れた患者が患者申出療養を希望する場合などでは、臨床研究計画の作成期間も短くなるため、厚労省保険局医療課の担当者は「準備にかかる時間がどの程度とは一概に言えない」とコメントしています。
臨床研究中核病院などへの「患者からの相談」、整理して情報共有
がんなどの治療が困難な疾病と闘う患者から、患者申出療養は大きな期待を受けています。この点について天野慎介構成員(全国がん患者団体連合会理事長)は「患者への情報提供」の必要性を強調しました。
厚労省もこの点を重視しており、早期に「臨床研究中核病院などで患者から受けた相談内容を蓄積し、一覧化・整理した上で、臨床研究中核病院などに情報提供する。集計結果は公表する(評価会議に報告)」考えです。
また、患者からの相談は臨床研究中核病院だけでなく、「相談窓口を設置した特定機能病院」でも受け付けられます。厚労省は、現在、特定機能病院でどの程度相談窓口の設置準備が進んでいるかを調査しており、5月開催予定の次回会合に調査結果を報告する考えです。
【関連記事】
患者申出療養の詳細固まる、原則「臨床研究」として実施し、保険収載を目指す―中医協
患者申出療養の提案受けた臨床研究中核病院、「人道的見地からの治験」の有無をまず確認―中医協総会
大病院受診、紹介状なしの定額負担など16年度から-医療保険部会で改革案まとまる