医療ニーズが高く開発公募がなされた医療機器、開発した企業は高く評価する―中医協・材料専門部会
2015.11.9.(月)
2016年度の特定保険医療材料価格制度改革では、医療上必要な医療機器の開発を促進するために「公募に応じて開発された品目」や「開発要請を受けて開発された品目」について高く評価する―。このような方向が、6日に開催された中央社会保険医療協議会の保険医療材料専門部会で固まりました。
わが国の保険医療材料価格制度は、同一の機能については同一の価格を設定する仕組み(機能区分別保険収載)になっているため、「改良や新規機能が評価されにくい」という指摘があります。
新規の医療機器が開発されA1という機能区分が設定され、高い評価がなされてもの、後にA1と類似した価格の安いA2製品が出現した場合、A1の価格も低価格のA2に引っ張られて下落してしまうという問題点がありました。
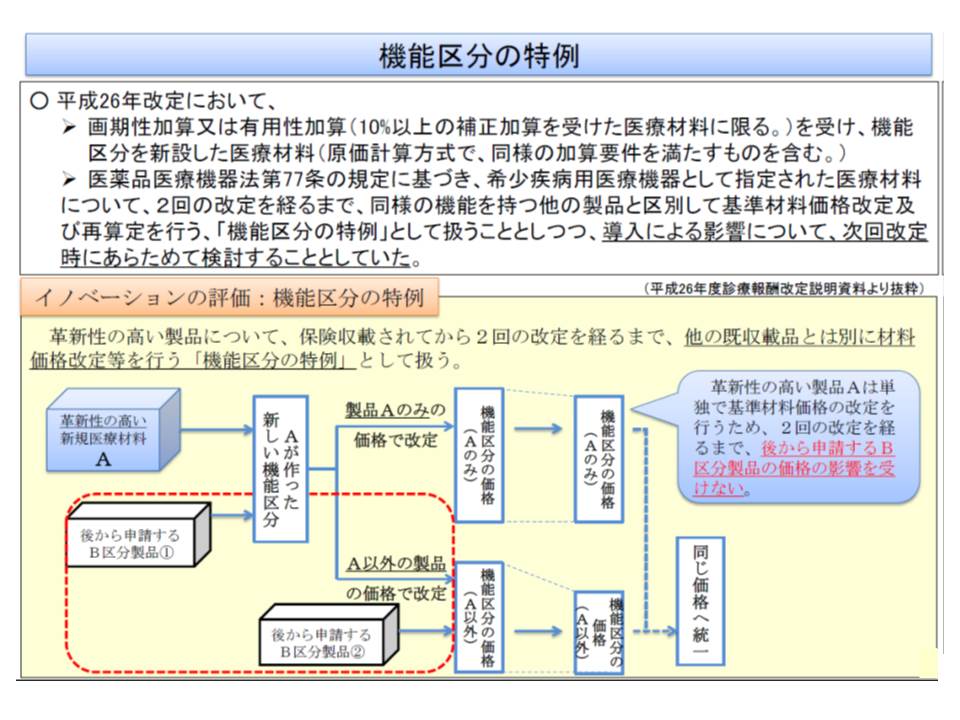
そこで2014年度の前回改定では、革新性の高い新規の医療機器については、同様の機能を持つ他の製品と区別して、2回の改定を経るまで価格改定・再算定を行うことになりました(機能区分の特例、事実上の単独機能区分設定)これにより、最低でも4年間は高価格を維持できることになり、メーカーの開発意欲に応えることができると期待されています。
この特例はこれまでに7製品・16区分の材料に適用されていますが、同様の製品(前述でいうA2)は出現しておらず、特例の効果がどれほどあるのか十分に分かっていません。そこで厚労省は「2016年度の次期改定でも特例を継続し、その後、特例の影響・効果を再度検証する」ことを提案し、了承されています。
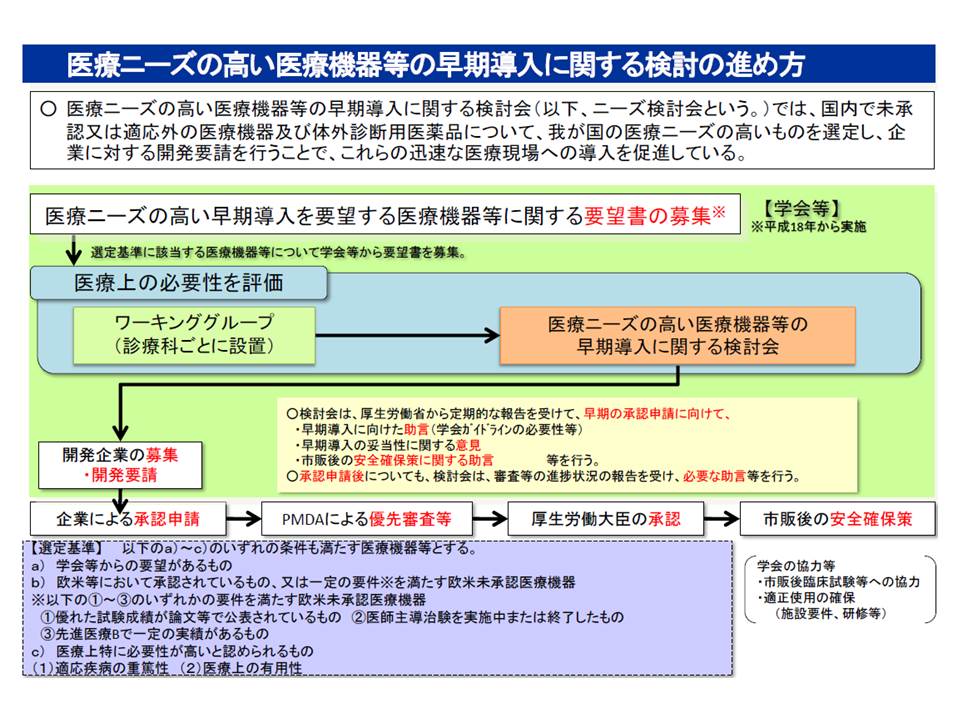
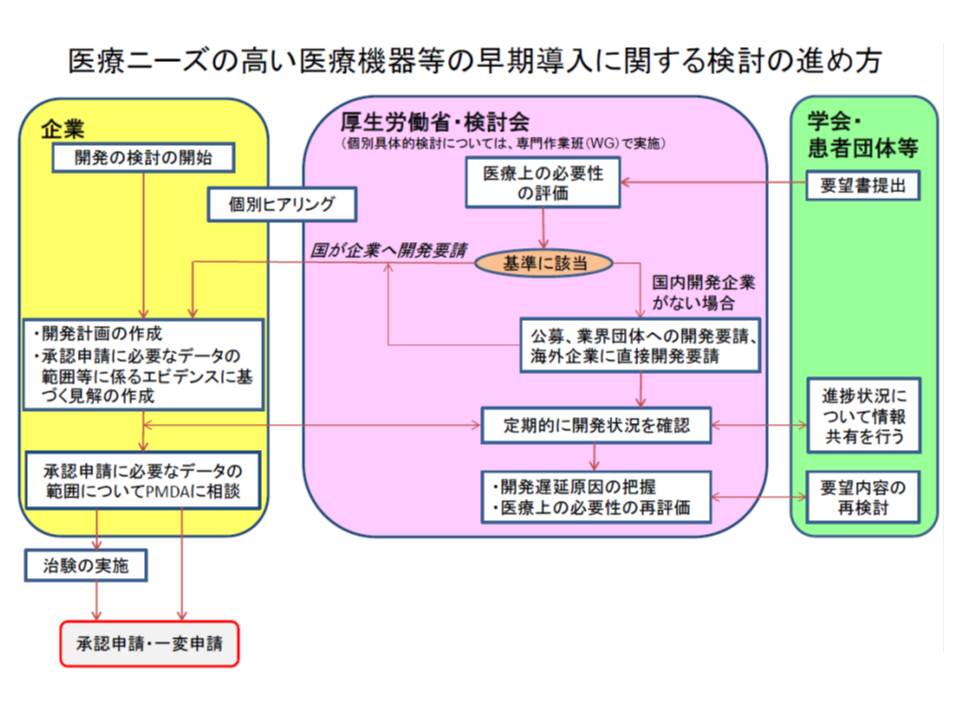
ところで、医療現場や患者の中には「諸外国では既に承認されているが、わが国では未承認・適応外の医療機器(いわゆるデバイスラグ)があり、開発を急いでほしい」という要望があります。このような医療ニーズの高い医療機器については、厚労省の検討会(医療ニーズの高い医療機器等の早期導入に関する検討会)で具体的な製品リストをまとめ、医療機器メーカーからの手挙げ待ったり(公募)、メーカーに開発要請をしたりしています。
この点について厚労省保険局医療課の眞鍋馨企画官は、材料価格サイドから医療機器開発を推進するために、次のような提案を行いました。
(1)「公募に応じて開発された品目」、および「公募に応じた企業から一定期間内に申請された次の新規品目(例えばC1、C2)」について、機能区分の特例とする
(2)「開発要請を受けて開発された品目」について、価格算定における評価を行う
(3)開発要請を受けながら一定期間以上開発を進めない企業が申請する新規材料については、特にやむを得ない正当な理由がない限り、補正加算を認めないなどの対応を図る
(1)は「公募に応じる」というメーカーの「積極的な開発姿勢」に応えるために、前述の「機能区分の特例」という高い評価を行うものです。一方(2)は、「このメーカーであれば既に技術を保有しており開発が可能であろう」という検討会の考えに応じるという、「比較的待ちの姿勢」であるため、評価は(1)よりも低くなり、かつ評価されるケースは「採算が合わないことが予想される」「外国価格が極めて安価で外国価格調整の対象になると予想される」などに限定すべきではないか―。厚労省保険局医療課の担当者はこのような考え方を説明しています。
また(3)は、いわば開発を行わないメーカーへのペナルティを設定するものですが、支払側の幸野庄司委員(健康保険組合連合会理事)は、「一律にペナルティをかけるのはいかがなものか。メーカーの規模や、開発に着手しない理由などをケースバイケースで判断すべきであろう」と述べ、慎重な検討を求めました。厚労省保険局医療課の担当者も、この指摘を受け「きめ細かい、丁寧な制度設計を行う必要がある」との考え方を示しています。
このほか、医療機器・材料のイノベーション評価に向けて、厚労省は次のような提案も行っています。
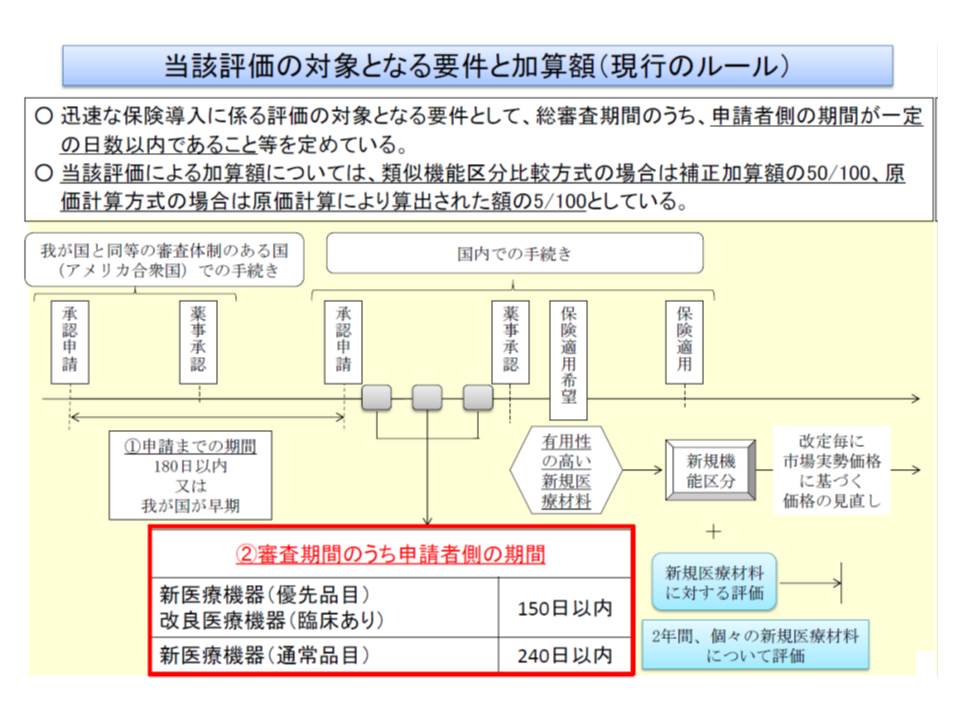
▽迅速な保険導入に係る評価(審査期間のうち「申請者側の期間」が短く、有用性が高い機器について加算を行う)について、審査期間を短縮し、試行を継続する
▽企業側が「既存技術と異なる(新規である)」と考える場合には、区分C2(新機能・新技術)で申請できることを明確にし、保険医療材料専門組織から中医協に対して「この部分が既存技術と比べて明らかに改良されている」などの意見具申を行うルールを設ける
▽新規材料が既存品と部分的に類似している場合には、類似部分を基準とした価格設定を行うルールを設ける
【関連記事】
先駆導入加算、「先駆け審査指定制度」の要件に見直しへ―中医協
医薬品納入の「未妥結減算」、妥結率向上も「単品単価取引を阻害」―中医協の薬価・材料専門部会
「他の後発品への変更不可」の場合、理由記載を求めるべきか―中医協総会
長期処方を制限すべきかなど、中医協の議論は混とんとしてまとまらず―中医協総会