医療材料への市場拡大再算定導入を見据え、16年度改定で下準備進める―中医協・材料専門部会
2015.11.26.(木)
保険医療材料にも将来的に市場拡大再算定を導入するために、2016年度から区分Bの保険適用希望書に、予測販売数の詳細データ記載を求めてはどうか―。厚生労働省は、25日に開かれた中央社会保険医療協議会の保険医療材料専門部会で、このような提案を行いました。
医薬品については、当初予測を大幅に超え、年間販売額が一定額以上の製品の価格を引き下げる「市場拡大再算定」という仕組みがあります(現在、見直しが議論されている。関連記事はこちら)。
厚労省は、このような「実際の販売実績における市場規模を踏まえた償還価格の見直し」を行う仕組みを保険医療材料制度にも導入してはどうかと考えています。
しかし、医薬品と異なり、保険医療材料(区分B)については保険適用希望書に予測販売数を記載することにはなっていません。このため、予測と実際との乖離を適切に把握することが難しいのです。
また、仮に医薬品と同様な仕組みを導入するとして、「どの程度の乖離」「どの程度の売り上げ」があった場合に価格引き下げを行うべきかなどのデータもありません。
このため厚労省保険局医療課の眞鍋馨企画官は、2016年度改定では次のような対応を行うことを提案しました。
▽B区分の保険適用希望書について、予測販売数の設定根拠を含めた「予測販売数に関するより詳細なデータ」の記載を求める
▽実際の販売実績を踏まえ、予測販売数の妥当性の検証に向けた、引き続き検討を行う
つまり、市場拡大再算定の導入に向けて「下準備」を進めることになります。
この提案に中医協委員から反論は出ていませんが、田村誠専門委員(アボットジャパンン株式会社ガバメントアフェアーズバイスプレジデント)は「メーカーの負担が過大にならないようしてほしい」と要望しています。
この日は、生命に関わる重篤な疾患の治療に欠かせない医療機器などについて「緊急的な保険収載」を行うルールをどう設定するべきかも議題となりました。
新たな機能を持つ医療機器(C1、C2)は、1年間に4回、保険収載されます。このため現行ルールでは、中医協で保険収載が了承されてから、実際に保険収載されるまで最長で4か月かかるケースもあります(後述)。
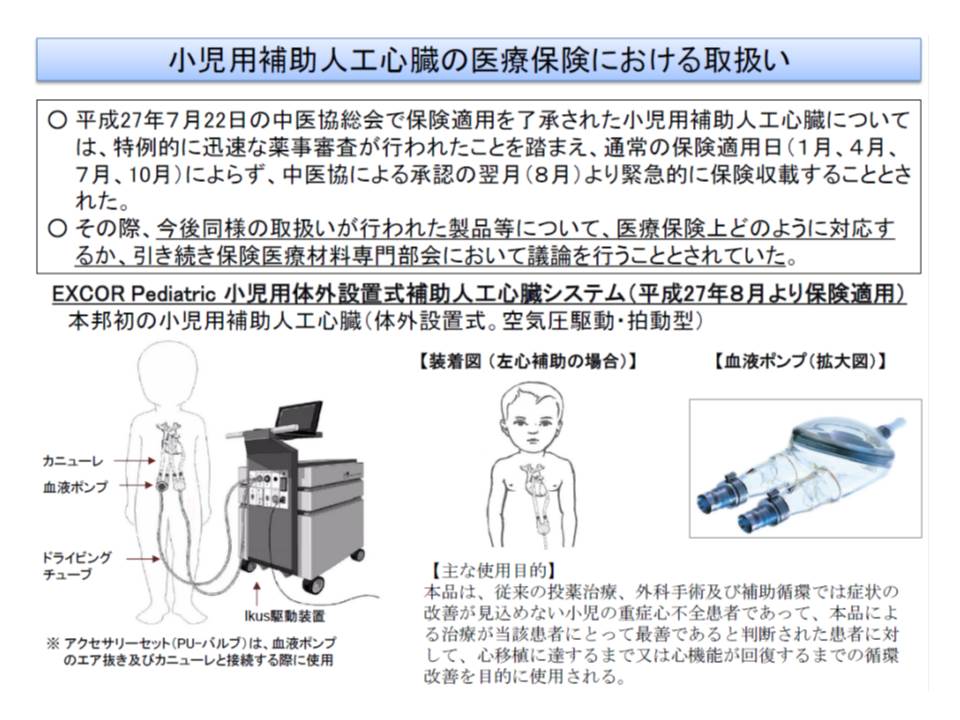
ところで、生命に関わる重篤な疾患の治療に欠かせない新規の医療機器が開発された場合、1人でも多くの患者の命を救うために緊急の保険収載が必要でしょう。実際、今年(2015年)7月には小児用の補助人工心臓が、緊急保険収載されました(関連記事はこちら)。
かつて、わが国には小児用の体外設置式補助人工心臓システムがなく、重症心不全を患う小児には、心臓移植までの間、成人用の補助人工心臓が使われてきました。しかし、患児への負担が大きく、かつ血栓形成やこれに伴う脳梗塞などの合併症にリスクが高まるため、小児用の補助人工心臓の開発が急がれていたのです。厚労省も事態を重大視し、緊急の薬事承認、保険収載が行われたのです。
ここで気になるのが、どのようなケースでは緊急保険収載を行い、どのようなケースで通常の保険収載ルールを適用するのかという点です。この点が曖昧であれば「不公平である」との指摘も免れないからです。
しかし、現時点で緊急保険収載されたケースは、上記の「小児用体外設置式補助人工心臓」1件のみで、緊急保険収載を行う基準を定めることは難しそうです。
そこで厚労省は、当面、▽製品の特性▽薬事承認の状況―などに応じて中医協で緊急保険収載の必要があるかどうかを個別に判断し、その実績を踏まえて制度化(緊急保険収載を行うかどうかの基準作成など)を検討する考えを示しました。この考えに委員から反論は出ていません。
ちなみに、小児用体外設置式補助人工心臓が緊急保険収載された背景には、(1)対象疾患が生命に関わる重篤な疾患である(2)代替する適切な医薬品・治療方法などがない(3)医師主導国内治験では、承認申請後も、患者が必要な治療を受けられるよう治療を継続している(4)医療ニーズの高さが検討会で認められ、複数の学会や患者団体が早期承認を求めている―という状況があり、これらが基準値作成でも考慮されることになりそうです。
このほか、2016年度の次期材料制度改革では、次のような見直しを行う方向が固まりました。
▽新機能をもつ医療機器(区分C1、C2)について、中医協で保険収載が了承された翌月から実際に保険適用する(保険収載回数は現行の年4回を維持するが、1か月前倒しする)
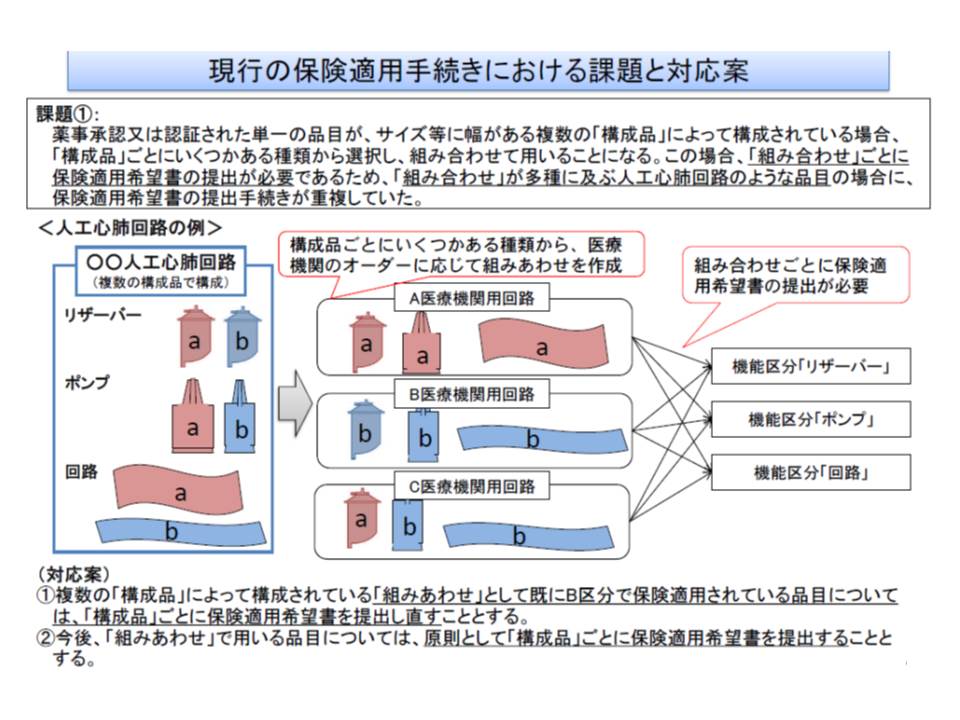
▽パーツを組み合わせて用いる品目については、原則として「パーツ(構成品)」ごとに保険適用希望書を提出することで良しとする(現在は、パーツとすべての組み合わせごとに保険適用希望書を提出しなければならない)
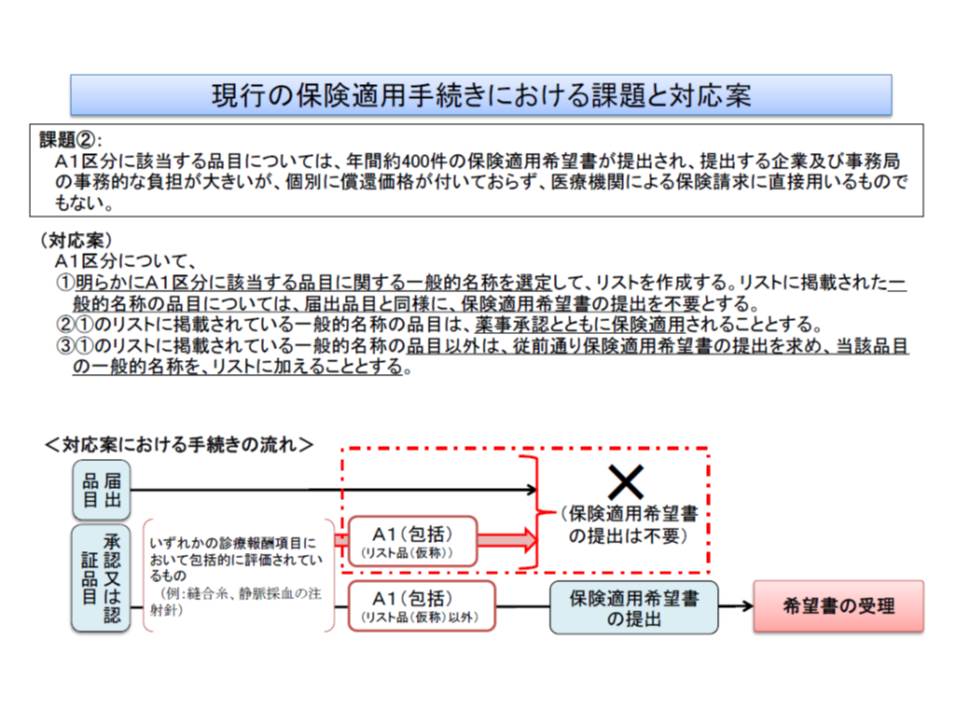
▽明らかに区分A1(縫合糸など包括評価されている医療材料)について、一般的名称を選定してリストを作成し、リスト掲載品目については保険適用希望書の提出を不要とする
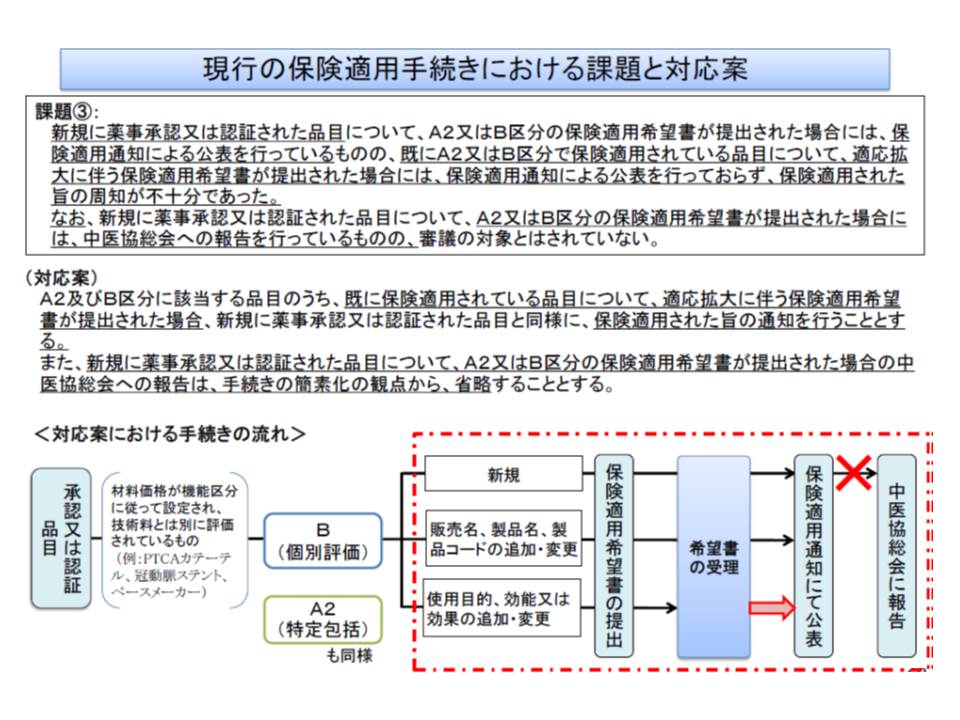
▽区分A2(眼内レンズなど特定の診療報酬に包括評価されている医療材料)と区分B(特定保険医療材料)に該当する既収載品について、適応拡大が行われた場合にはその旨の通知を行う
▽放射線治療に対する医療材料の評価として、「特定保険医療材料」の節を設定する(既に検査や処置、手術などの点数には、手技のほかに「特定保険医療材料」の節が設けられている)
▽ヒト自家移植組織について、機能区分の細分化や償還価格の見直しなどを検討する(培養キットと移植キットに分け、移植前に患者が死亡しても培養キットの費用は償還できるようにする)
材料価格制度については、これまでに「内外価格差の是正(関連記事はこちら)」や「イノベーションの評価(関連記事はこちら)」といったテーマについて議論されており、25日の専門部会で一通りの議論を終えた格好です。厚労省は、議論の内容を踏まえ、近く材料価格制度の改革に向けた骨子案を示す考えです。
【関連記事】
先駆導入加算、「先駆け審査指定制度」の要件に見直しへ―中医協
医療ニーズが高く開発公募がなされた医療機器、開発した企業は高く評価する―中医協・材料専門部会