患者申出療養、座長が審議の場を判断するが、事例が一定程度集積されるまでは本会議で審議―患者申出療養評価会議
2016.6.13.(月)
患者申出療養の新規申請があった場合、座長が本会議・第1分科会・第2分科会のいずれで審議を行うかなどを判断し、すみやかに審議に入ることとするが、事例をいくつか積み重ね、検討手法などがある程度固まってくるまでは「本会議」で審議を行うこととする―。
13日に開かれた患者申出療養評価会議では、このように具体的な審議の流れが整理されました(関連記事はこちら)。
一般の医療機関でも、患者から「新たな仕組みができたと聞いたが」と問われることもあり(実際に相談が寄せられています)、制度と運用状況についてきちんと押さえておく必要があります。
目次
患者申出療養の申請に備え、審議手続きなどの詳細を整理
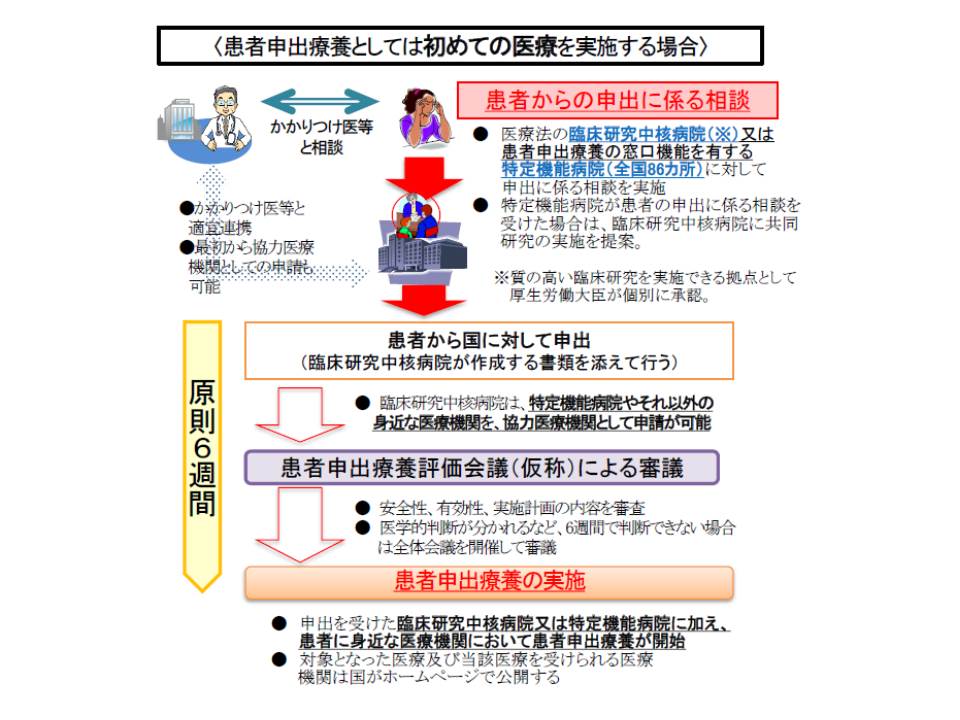
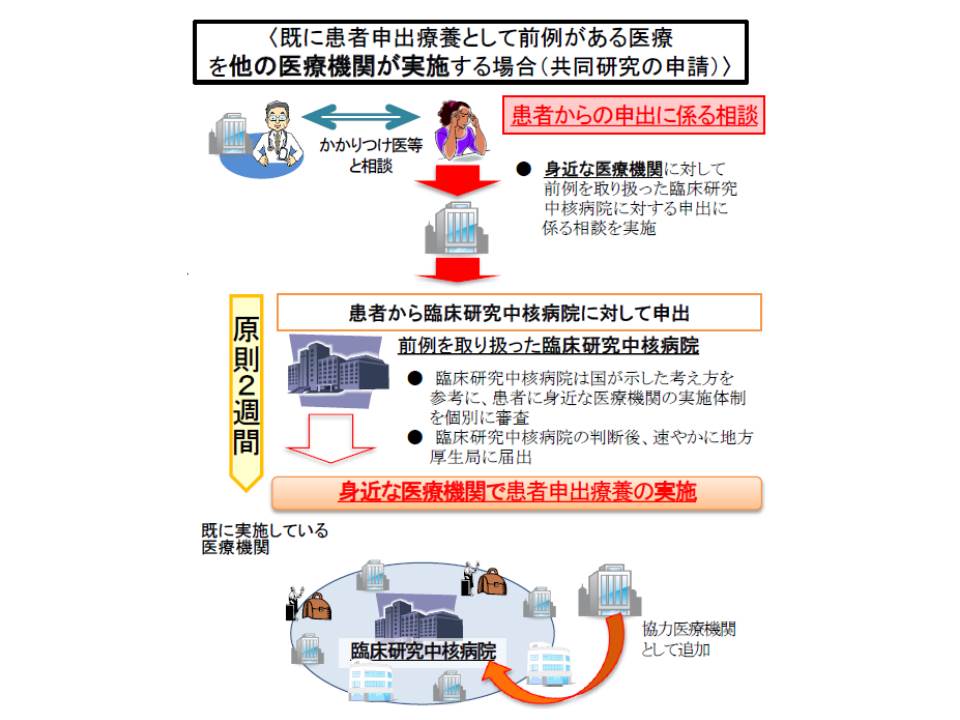
患者申出療養は、4月1日からスタートした新たな保険外併用寮費制度(保険診療と、未承認の抗がん剤などの保険外診療都の併用を認める)です。「海外で開発された未承認の医薬品(保険外診療)を使用したい」などといった患者からの申し出を起点として、安全性・有効性を患者申出療養評価会議で確認した上で、保険診療との併用を認めるものです(関連記事はこちらとこちら)。
評価会議には、全構成員からなる「本会議」のほかに、主にがん治療について審議する「第1分科会」(患者申出療養技術審査分科会)、主に難病などの治療について審議する「第2分科会」(同)が設置されています。
13日の会合では、新規の患者申出療養が申請された際に、どのような流れで審議を行うかについて次のような整理を行いました。
(1)新規の申出を受理(患者自らが、臨床研究中核病院で作成した実施計画書などとともに厚生労働省に申請する)
↓
(2)座長が、個々の案件について本会議・第1分科会、第2分科会のいずれで審議を行うかを判断し、すみやかに日程調整を行う
↓
(3)日程調整が可能であれば構成員を招集して会議を開き、調整が難しく速やかに開催できない場合には「持ち回り開催」とする(座長、分科会長の判断)
↓
(4)会議の中で「期間内(申出の受理から6週間以内)に意見を取りまとめることが可能か否か」を座長あるいは分科会長が判断する
↓
(5a)期間内の意見取りまとめが可能な場合には取りまとめを行い、厚生労働大臣がこれを基に告示を行う。【分科会で審議を行った場合には、分科会の取りまとめが評価会議の取りまとめとなるが、本会議に報告する】
↓
(5b)委員の意見が分かれていたり、海外でも未承認で慎重な判断が必要である場合など、「期間内の取りまとめ」が行えそうにない場合には、その技術名と理由を本会議に報告し公開する
↓
(6)(5b)の場合、座長が本会議・第1分科会・第2分科会のいずれで審議を継続するかを判断し、審議を継続する
ただし松井健志構成員(国立循環器病研究センター医学倫理研究部倫理研究室室長)は「検討のあり方などを評価会議である程度固め、そこから分科会で議論したほうがよいのではないか」と指摘。患者申出療養は、まったく新しい仕組みゆえ、どのような申請があがり、どう議論を進めていくのかについて手探りの部分もあります。そこで本会議・第1分科会・第2分科会で審議スタイルのバラつきが大きくなることを避けるべきとの考えに基づくものです。
松井構成員の指摘に反論はでなかったことから、「上記(1)から(6)の流れを基本とする」、ただし「事例が積み重ねられ、審議手法などがある程度固まるまでは、座長は(1)の判断は行わず、本会議で審議を行う」ことが決まりました。
ただし厚労省保険局医療課の担当者は、「日程調整が困難で、本会議の開催は難しい。しかし分科会であれば多くの構成員が出席でき、実際の会議を開ける」という場面も想定されるとし、会議の開催そのものには一定の柔軟性を持たせる考えを示しています。
申請までにかかる期間、ケースによって異なり、単純に「何か月」とは言えない
ところで13日の会合では、申請までにかかる「期間」や「費用」に関する意見も出されました。
前者の「期間」については、臨床研究中核病院において▽当該治療法について、ほかに治験などが動いていないかの確認▽科学的妥当性の確認▽臨床研究計画(プロトコル)の作成▽倫理審査―などに一定の時間がかかることが想定されます。
この点、厚労省保険局医療課の眞鍋馨企画官は、「現時点でどの程度ということは難しい。事例が積み重ねられる中で、こういった類型ではこの程度の期間がかかる整理できるかもしれない」と述べるにとどめています。ゼロベースで臨床研究計画をデザインするケース(申請までの期間は長くなる)と、既に治験が動いており、適格基準から外れた患者が患者申出療養を希望するケース(申請までの期間は短くなる)とでは、申請までの期間は大きくことなると考えられ、単純に「何か月程度かかる」とコメントするのは困難でしょう。
なお、松井構成員は「倫理的な側面は患者申出療養評価会議で審議するので、臨床研究中核病院における倫理審査は省略してもよいのではないか」と提案しましたが、厚労省の眞鍋企画官は「規定上、各臨床研究中核病院で倫理審査を実施して頂く必要がある」と答弁。本来「自費」である診療を、国民全員が費用を出しあっている「保険診療」と組み合わせる仕組みですから、安全性・有効性はもとより、倫理面についても重層的なチェックが必要と考えるべきでしょう。
なお眞鍋企画官も「迅速性」の重要性は軽んじておらず、「事例を積み重ねる中で、申請までの期間短縮に向けて検討していく」ことを明確にしています。
臨床研究計画の作成費用など、やはりケースで異なり、一概に●円とは言えない
後者の「費用」については、未承認などの薬剤費など診療そのものの費用のほかに、臨床研究計画の作成費用や、相談にかかる費用を誰が負担するのか、それはどの程度かかるのかといった点も議論になりました。
この点について厚労省は、3月31日に発出した事務連絡「疑義解釈資料の送付について(その1)」の中で、▽に当該患者に対する患者申出療養の実施に現に必要とされる▽社会的にみて妥当適切な範囲である▽事前に患者に十分な説明を行い、患者の自由な選択に基づき、文書によりその同意を得る―ことを条件として、患者からの費用徴収が可能であることを明確にしています。
では具体的にどの程度の金額になるのでしょう。一部委員からは「すべて外注すると2000万円程度」とのコメントも出ましたが、個々の患者1人(1件)あたりどの程度の金額となるかは明確になっていません。別の臨床研究計画書を応用できる場合もあれば、臨床研究中学病院に研究費で賄われる場合や、製薬企業などが費用を負担する場合など、まさにケースバイケースで、やはり単純に「●円程度」とすることは困難でしょう。
安全性や有効性だけでなく、費用についても「患者に十分に説明を行い、同意を得る」ことが極めて重要と言えます。
なお、この点に関連して山崎力構成員(東京大学医学部附属病院臨床研究支援センター長)は、「先進医療の対象技術だが、患者の適格性にわずかに欠ける場合などには、臨床研究計画書の作成を不要とするなど手続きを大幅に緩和してはどうか」と提案しています。今後の検討課題になる可能性もあります。
【関連記事】
患者申出療養評価会議が初会合、厚労省「まずは既存の先進医療や治験の活用を」
患者申出療養の詳細固まる、原則「臨床研究」として実施し、保険収載を目指す―中医協
患者申出療養の提案受けた臨床研究中核病院、「人道的見地からの治験」の有無をまず確認―中医協総会
大病院受診、紹介状なしの定額負担など16年度から-医療保険部会で改革案まとまる