小児のデュシェンヌ型筋ジストロフィー治療に用いる「エレビジス点滴静注」、安全性を再確認するまで保険適用論議をストップ—中医協(2)
2025.6.19.(木)
条件・期限付きで薬事承認された小児の「デュシェンヌ型筋ジストロフィー」(DND)治療に用いる「エレビジス点滴静注」(一般名:デランジストロゲン モキセパルボベク)について、安全性に懸念が生じている(急性肝不全で患者が死亡する事例が2件発生している)。
同製品についての医療保険適用議論を一時ストップし、「情報を収集し、安全性に本当に問題がないのか」をまず確認する必要がある—。
6月18日に開催された中央社会保険医療協議会総会では、こうした議論も行われています(同日の2026年度診療報酬改定論議に関する記事はこちら)。
海外での「歩行不能」患者へのエレビジス投与、急性肝不全による死亡が2例報告
3歳以上8歳未満の「デュシェンヌ型筋ジストロフィー」(DND)患者に対する画期的な再生医療等製品である「エレビジス点滴静注」(一般名:デランジストロゲン モキセパルボベク)が薬事承認を受けました(本年(2025年)5月13日)。ただし、国際共同治験では▼主要評価項目である「DNDの機能的な運動能力を評価する際に用いるNSAAのスコア」について、プラセボ群と比べて有意な差が見られない▼副次評価項目である「床上起き上がり時間」「10m歩行/走行時間」「4段階段昇り時間」について、プラセボ群と比べて改善が認められた—ことから、「有用性の確認」がなされず「有用性の推定」にとどまっており、「条件及び期限付き」の薬事承認とされています。
「条件及び期限付き」の薬事承認を受けた製品についても保険適用が行われます。
例えば難病治療薬などについては、患者数が極めて限られるために「有効性に関するデータを治験段階で得ることができない」ケースがままあります。これを「データが十分でないので薬事承認・保険適用しません」と厳格に対応したのでは、患者の医療アクセスへの期待を大きく削いでしまいます。そこで、「安全性が確保」されたうえで、一定の有効性が推定される医薬品等については、「まず条件・期限付きで承認、保険適用する」→「保険適用により投与症例数を一定程度確保し、有効性に関するデータを収集しやすくする」→「市販(保険適用)後のデータも含めて有効性をチェックし、本承認、保険適用する」といった仕組みが設けられています。例えば、新型コロナウイルス感染症治療薬のゾコーバ錠についても、この仕組みによって「条件・期限付き承認時の保険適用(薬価基準収載)」→「本承認時の保険適用(薬価基準収載)」が行われています。このプロセスによって「最新の優れた医療技術に対する患者のアクセス」を確保できることになります。
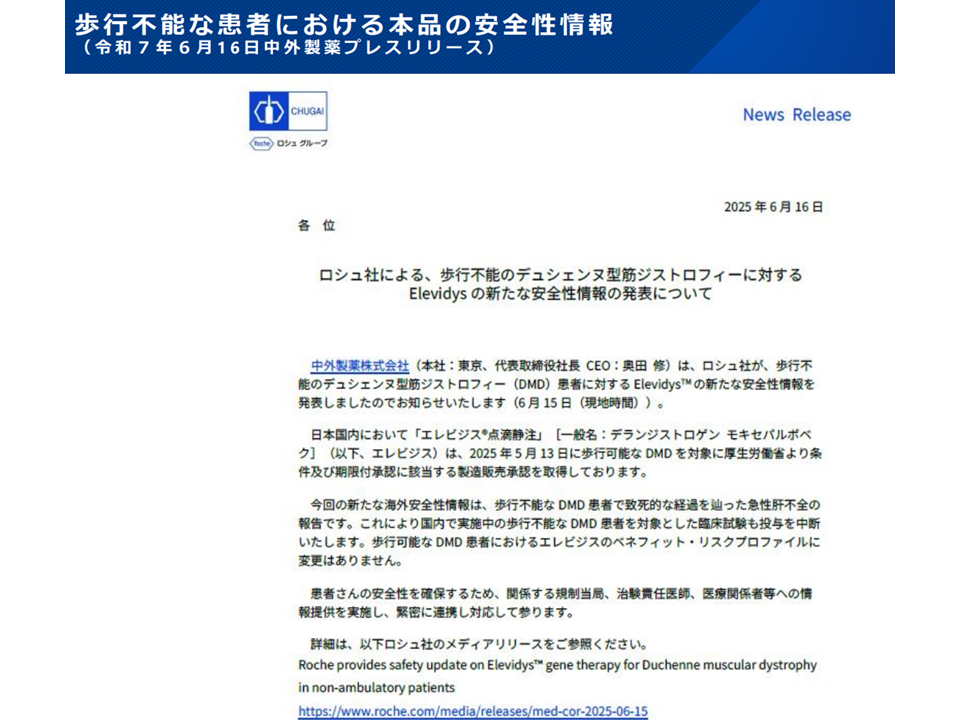
ところで、この「エレビジス点滴静注」について、製薬メーカー(中外製薬社)から安全性に関する次のような新たな情報が提供されました(本年(2025年)6月16日、中医協資料はこちら
▽海外で、歩行不能なDND患者における「急性肝不全による死亡」が2例報告された
▽この報告を受けて「歩行不能なDND患者におけるエレビジス使用のベネフィット・リスク」が再評価された
▽臨床試験では、年齢にかかわらず「歩行不能患者への投与」を直ちに中断し、市販後での「歩行不能患者への投与」を中止する
▽「歩行可能なDND患者におけるエレビジス投与のベネフィット・リスク」は依然として「良好」であり、治療ガイダンスに変更はない
エレビジスに関する最新の安全性情報1(中医協総会(2)1 250618)

エレビジスに関する最新の安全性情報2(中医協総会(2)2 250618)
本邦での「条件及び期限付き」薬事承認では、適応症は「▼抗AAVrh74抗体が陰性▼歩行『可能』▼3歳以上8歳未満—のデュシェンヌ型筋ジストロフィー(DND)」であり、上記の新たな安全性情報でも「歩行可能なDND患者におけるエレビジス投与のベネフィット・リスクは依然として良好であり、治療ガイダンスに変更はない」されている点に鑑みれば、問題はないように思われますが、中医協委員は「安全性情報を更に収集し、安全性に問題はないのか改めて確認する必要がある」との意見が相次ぎました。
具体的には、▼「条件及び期限付き」薬事承認の大前提である「安全性」が揺らいでおり、医療保険適用論議はできなくなった。まず、安全性についてさらに情報を収集し、丁寧に薬事面での議論を行うべき。「安全性が揺るがない」と合理的に説明できることが、保険適用論議において重要である(診療側の長島公之委員:日本医師会常任理事)▼「条件及び期限付き」薬事承認の大前提は「安全性の確保」であり、これが、今回の新たな情報で一度崩れてしまったのか、そうではないのか、諸外国のデータもみて慎重に薬事面で確認してほしい。そのうえで、改めて医療保険での取り扱いを考えるべき(診療側の森昌平委員:日本薬剤師会副会長)▼死亡事例が2件報告されたことで、医療保険適用に向けた議論の前提そのものが変わったと考える。もちろん「死亡事例は歩行不可能にまで進行した患者であり、今回、議論の対象となった『歩行可能症例』とは異なること、歩行可能症例では『エレビジス投与のベネフィット・リスクは依然として良好であり、治療ガイダンスに変更はない』とされていること、患者・家族が一刻も早い本剤の保険適用を待ち望んでいること」などは十分に理解しているが、やはり保険適用する以上「最低限、安全性が担保されている」ことが不可欠と考える。速やかに「改めての安全性の確認」を行ってほしい(支払側の松本真人委員:健康保険組合連合会理事)—などの声が出ています。
こうした声を踏まえ、「まずエレビジスの安全性を改めて確認」(中医協に報告)し、その後に「医療保険適用」を検討していくこととなりました。厚労省医薬局医療機器審査管理課の高江慎一課長は「メーカー情報を踏まえれば安全性確保は揺るがないと思うが、さらなる安全性情報を早急に収集し、必要な対策を企業とも連携してとらなければならない。改めて中医協に報告する」旨をコメントしており、▼一度、保険適用に向けた専門組織等の検討(医薬品として扱うか、医療材料として扱うのか、などの検討も含めて)をストップ→▼安全性の情報を再収集し、薬事面で安全性を再確認→▼中医協にも報告し、安全性を再確認→▼保険適用論議等を再スタート—という流れが予想されます。
なお、支払側の高町晃司委員(日本労働組合総連合会「患者本位の医療を確立する連絡会」委員)は、▼待機しているDND患者の期待も大きいが、条件・期限付き承認された、言わば「仮免許」の医療技術であることを患者に丁寧に説明する必要がある(この点、本剤の添付文書でも高町委員の指摘する点を「文書で説明し、同意を得る」ことが明記されている)▼本剤の適用対象となる「抗AAVrh74抗体陰性である」か否かをコンパニオン診断薬などで確認することになるが、その費用なども中医協などでしっかり議論すべき—と進言しています。
さらに高町委員は「条件・期限付き承認の間は、投与対象患者をさらに限定してはどうか」とも進言していますが、厚生労働省保険局医療課の清原宏眞薬剤管理官は「現時点でも、適応症を『▼抗AAVrh74抗体が陰性▼歩行『可能』▼3歳以上8歳未満—のDND』と相当程度限定しており、さらなる限定は難しい」とコメントしています。
このほか6月18日の中医協総会では、次のような点の承認なども行っています。
【新たな医療機器の保険適用】(本年(2025年)9月保険適用予定、中医協資料はこちら)
▽非静脈瘤性消化管出血に対する止血を目的として使用する「ネクスパウダー」(償還価格:1g当たり1万7600円)
【新たな先進医療】(報告、中医協資料はこちら)
▽不育症に対する「β2GPIネオセルフ抗体検査」
▽胚移植を受ける不妊症患者(これまで反復して着床・妊娠に至らないもの、過去の妊娠で臨床的流産を2回以上反復しているもの、または流産率のリスクを高める可能性のある染色体構造異常を有するものに限る)に対する「着床前胚異数性検査」
▽ロルラチニブ耐性・不忍容ALK融合遺伝子陽性の進行または再発の非小細胞肺がんに対する「ギルテリチニブ療法」
【薬価基準から削除される医薬品】(報告、来年(2026年)4月削除予定、中医協資料はこちら)
▽ベバシズマブBS点滴静注100mg「第一三共」ほか
▽セフカペンピボキシル塩酸塩小児用細粒10%「SW」ほか
▽プロチレリン酒石酸塩注射液0.5mg「サワイ」ほか
▽イマチニブ錠100mg「ヤクルト」
▽ボルテゾミブ注射用3mg「ヤクルト」
▽乾燥ガスえそ抗毒素「KMB」
▽乾燥はぶ抗毒素「KMB」
医薬品の薬価基準からの削除については、昨年(2024年)8月7日の中医協で、(1)医療上の需要がなくなる等の理由で、メーカーが供給停止・薬価基準削除を希望する場合(2)承継、代替新規、G1撤退(先発品→後発品)に伴い薬価削除が必要な場合—に分けて、それぞれのルール・手続きが明確化されました(関連記事はこちら、中医協資料はこちら)。
今般の報告は、このルールに沿った初めてのもので、すべて(2)に該当します。削除されるいずれの医薬品についても「他の企業が製造販売を引き継ぐ」「名称の変更が行われるのみである」ため、これら医薬品の供給に支障は出ないと厚労省医政局医薬産業振興・医療情報企画課の水谷忠由課長(医薬産業振興・医療情報企画課セルフケア・セルフメディケーション推進室長併任)は説明しています。
また(1)は「後発品の少量多品目生産構造」改善にもつながるルールで、水谷医薬産業振興・医療情報企画課長は、この(1)ルールに基づく薬価基準からの削除品目について「本年(2025年)10月頃に中医協に報告→来年(2026年)3月に薬価削除」する予定も報告しています。
なお、診療側の森委員は「医薬品の供給不安が長引いている。貴重な医薬品を有効活用するために、薬価基準から削除される品目の最終ロットの使用期限まで薬価基準からの削除を待つべきではないか」と進言しています。今後、どういった検討が行われるか注目する必要がありそうです。
【関連記事】
小児の筋ジストロフィー治療に用いる「エレビジス点滴静注」、米国で5億円近い価格設定がなされ、どう保険適用を考えるか—中医協総会(2)





