2022年度薬価改革、効能評価の整合性確保・原価開示の促進・市場拡大再算定の不合理解消など進める―中医協・薬価専門部会
2021.10.26.(火)
2022年度の薬価制度改革に向けて、例えば「新規収載時の効能と、薬価基準収載後に追加された効能とで評価の在り方を一定程度揃える」「原価開示を促していく」「市場拡大再算定ルールの不合理を解消していく」「新薬創出等加算の企業要件を改善していく」ことなどを目指してはどうか―。
10月20日に開催された中央社会保険医療協議会の薬価専門部会に、厚生労働省保険局医療課の紀平哲也薬剤管理官はこういった論点を提示しました。
新薬創出等加算の「企業要件」をどう改善していくべきかも重要論点に
2022年度には、診療報酬改定に合わせて▼薬価制度▼材料価格制度▼費用対効果評価制度―の改革も行われ、それぞれ専門部会で改革論議が進められています。薬価については5月12日に業界からの意見聴取、8月4日に薬価算定組織(薬価算定ルールに沿って、個別新薬の薬価を検討する中医協の下部組織)からの意見聴取が行われ、これらを踏まえて紀平薬剤管理官が2022年度改革に向けた論点を提示したものです(他にも論点提示される可能性がある)。
(1)薬価収載後に効能追加がなされた場合、「新規作用機序により既存治療で効果不十分な疾患に有効である」などと認められた場合にのみ【新薬創出・適応外薬解消等促進加算】(以下、新薬創出等加算)として評価されるが、それ以外にも「新規収載時であれば有用性加算等に相当する」効能・効果等が追加された場合には、 対象領域、市場規模等の一定の要件を付した上で新薬創出等加算の対象とすることを検討してはどうか
(2)薬機法改正で位置付けられた「特定用途医薬品」(まず小児・多剤耐性菌に対する医薬品を指定)や「先駆的医薬品」に対する有用性加算等の在り方をどう考えるか(既存の有用性加算等との重複を避ける)
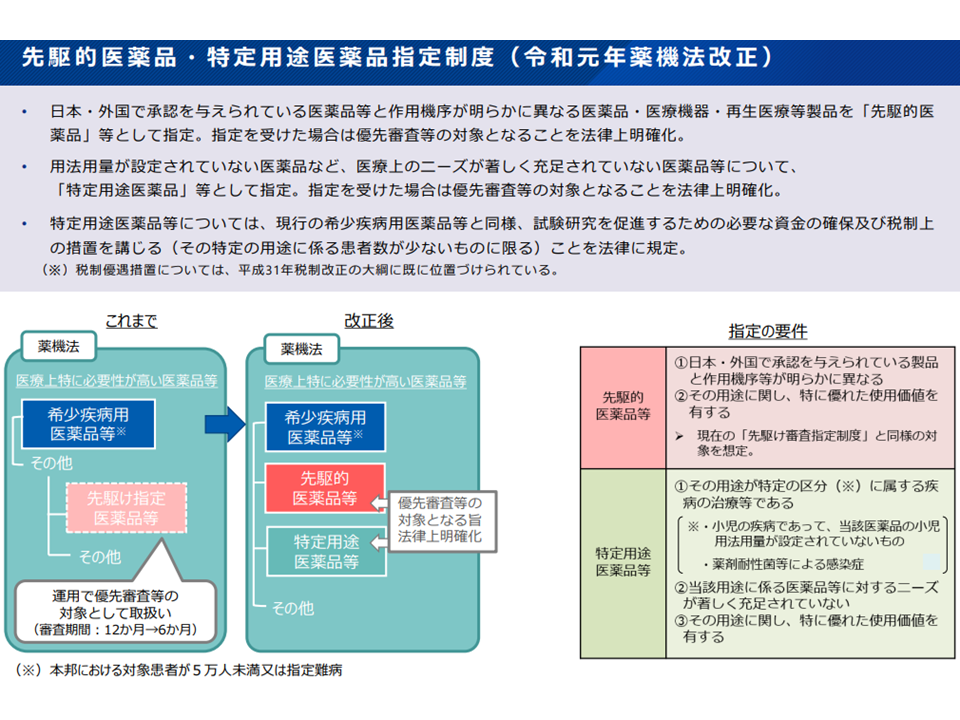
改正薬機法における特定用途医薬品・先駆的医薬品の概要(薬価専門部会3 211020)
(3)原価計算方式について「海外からの移転価格」(企業グループ内の取引価格、A製薬メーカーの海外法人や日本法人に輸出・販売する際の価格)開示をどう進めていくか、算定方法での工夫をどう考えるか
(4)新薬創出等加算における「企業要件」をどう考えるか
(5)「基礎的医薬品」(長期間薬価収載され(つまり低薬価となっている)、臨床上の有用性が高い医薬品について価格を下支えする仕組み)と「安定確保医薬品」(医学会が提案した、国民の生命を守るために安定確保への配慮が特に必要とされる医薬品、最優先のカテゴリAに21成分などが指定)との関係をどう考えるか
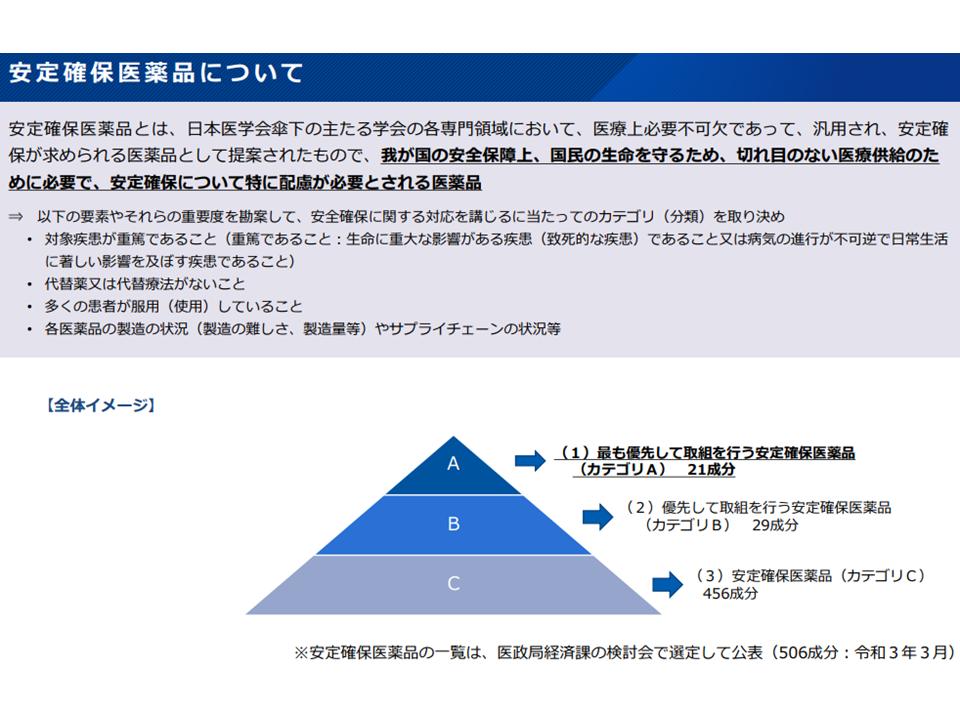
医学会の提唱する安定確保医薬品の概要(薬価専門部会10 211020)
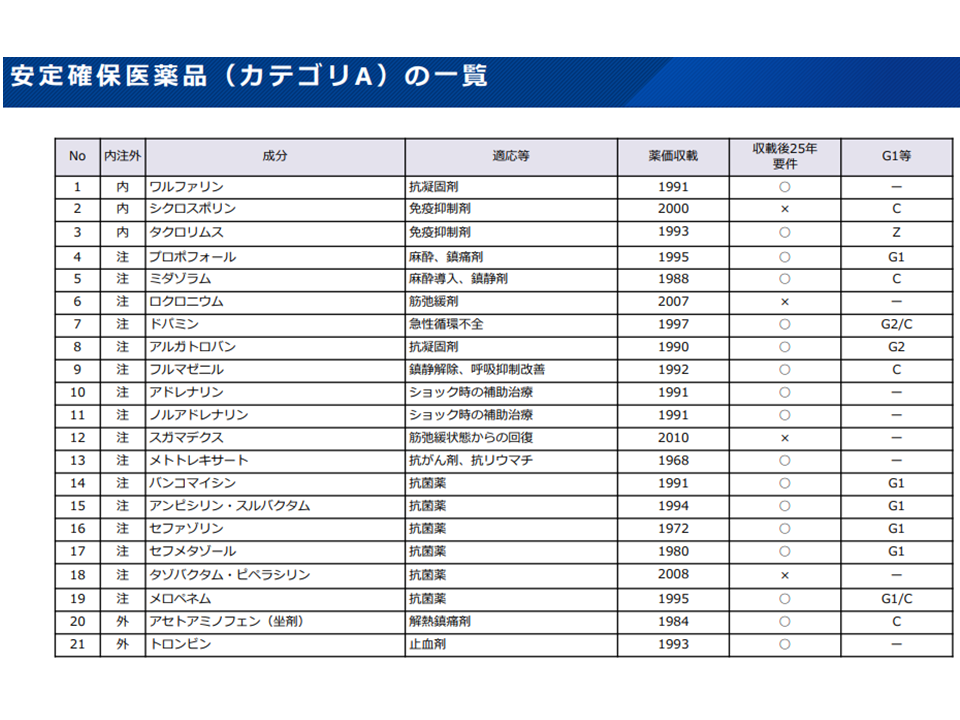
安定確保医薬品カテゴリA対象21成分(薬価専門部会11 211020)
(6)類似薬の市場拡大再算定について、「特例を受け価格帯が類似薬と大きく変わったもの」の取り扱いをどう考えるか
(7)医薬品のリポジショニング(既に承認されて医薬品等について、別の領域の効能・効果を開発し取得すること)促進の観点から、リポジショニングの際の薬価算定の特例をどう考えるか
(8)基礎的医薬品の薬価改定ルールをどう改善するか
まず(1)は、いわば「新規収載時に認められる効能」と「薬価収載後に認められる効能」とで評価の在り方を揃えてはどうかという論点です。評価の在り方を揃える方向そのものには診療側・支払側ともに賛意を示しており、今後「具体的な評価手法(例えば対象領域や市場規模などの要件)を詰めていく」ことになりそうです。優れた医薬品開発に対する企業側の努力が、より適正な形で評価されることに期待が集まります。
新規収載時に認められる効能と、薬価収載後に認められる効能とで、薬価上の評価の在り方に差異がある(薬価専門部会1 211020)
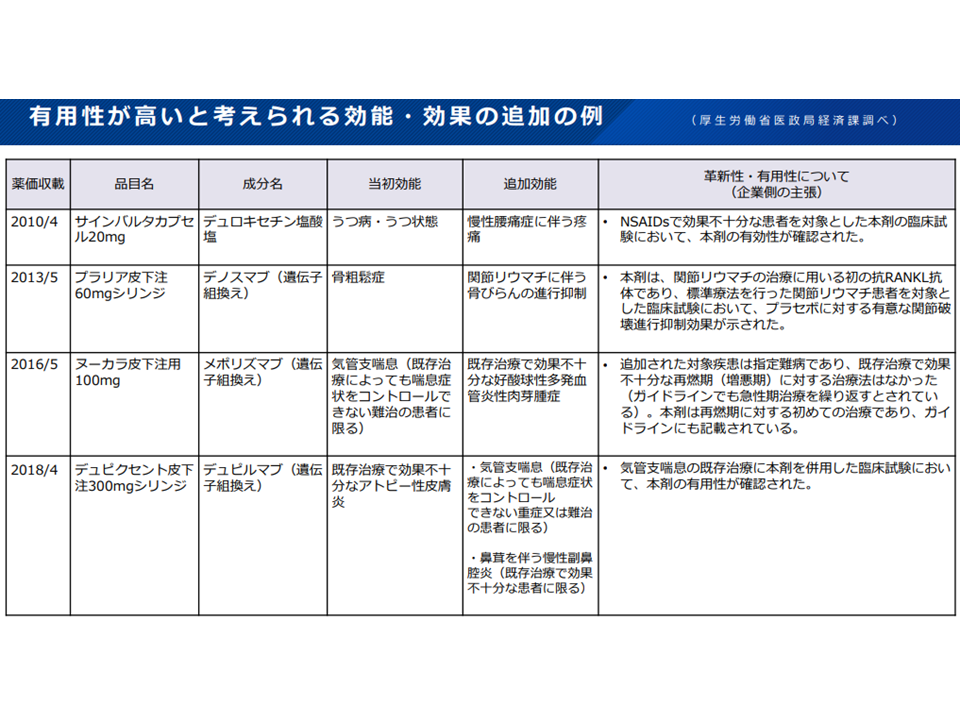
有用性が高いのではないかと思われる効能追加の例(薬価専門部会2 211020)
関連して支払側の幸野庄司委員(健康保険組合連合会理事)は「有用性の高い医薬品は新薬創出等加算で価格の下支えを行うとともに、特許が切れた後などは速やかに累積加算額の控除を行うべきである」と改めて強調しています。薬価は2年に一度、市場実勢価格(取引価格、一般的には薬価>市場実勢価格である)に合わせて引き下げが行われますが、有用性の高い医薬品については新薬創出等加算で下支えが行われます(これにより企業の新薬等開発原資確保を狙う)。ただし、後発品が出現した後、あるいは薬価基準収載から15年経過後に「それまでの加算額を控除する」ことになります。ただし、2019年度(消費税率引き上げに伴う臨時薬価改定)、2021年度(2年に一度の薬価改定の中間年改定の初回)には「新薬創出等加算による下支え」はなされたものの、「累積加算の控除」が行われず、幸野委員は「バランスを欠く」とかねてから唱えているものです。中間年改定は今後も継続される(2023年度、2025年度・・)ことから、継続した論点となりそうです。
(4)は、この新薬創出等加算の要件見直しに関する論点です。
新薬創出等加算の対象となる(つまり価格の下支えを受ける)ためには、▼当該医薬品が革新性・有用性を持つこと(例えば加算対象品目であることや希少疾病用医薬品であることなど)【品目要件】▼当該製薬メーカーが革新的医薬品の開発等に力を入れていること【企業要件】―の2つを満たすことが必要です。)
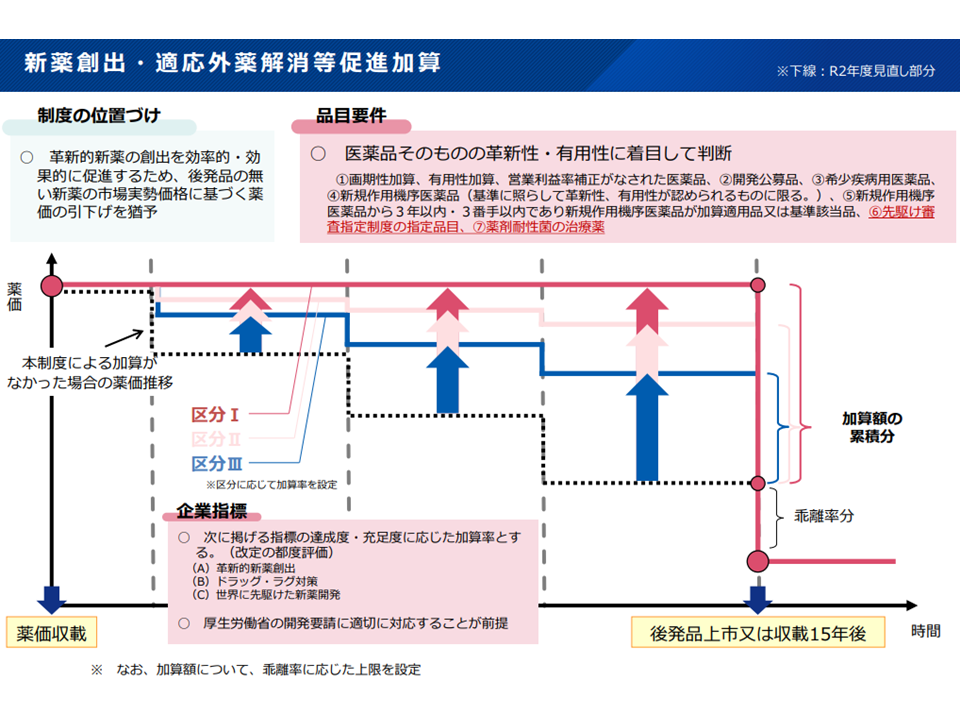
新薬創出等加算の概要(薬価専門部会6 211020)
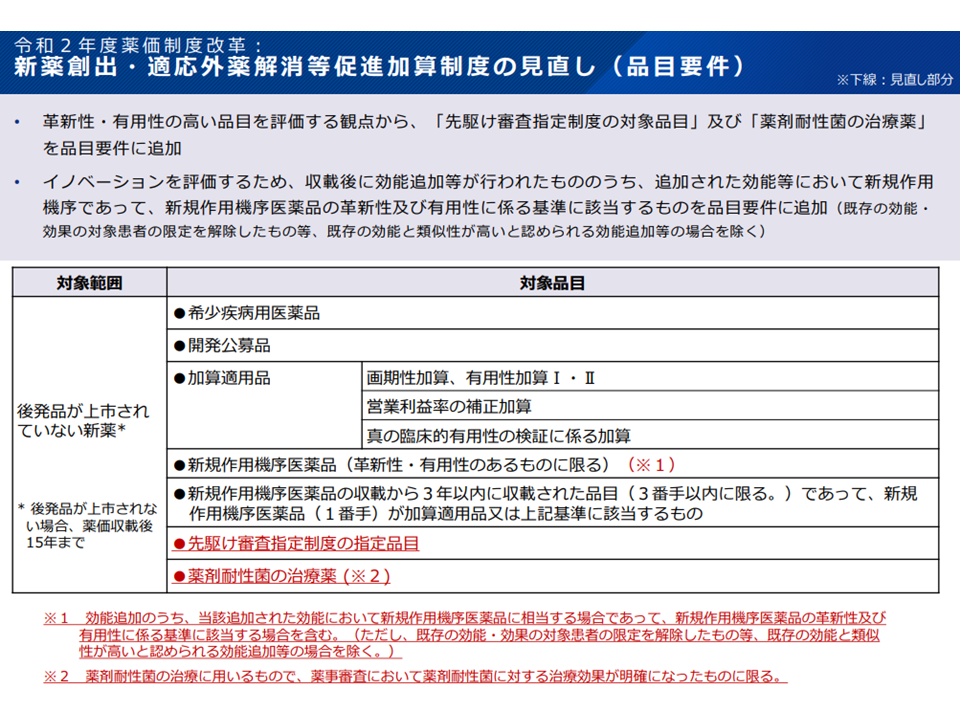
新薬創出等加算の品目要件(薬価専門部会7 211020)
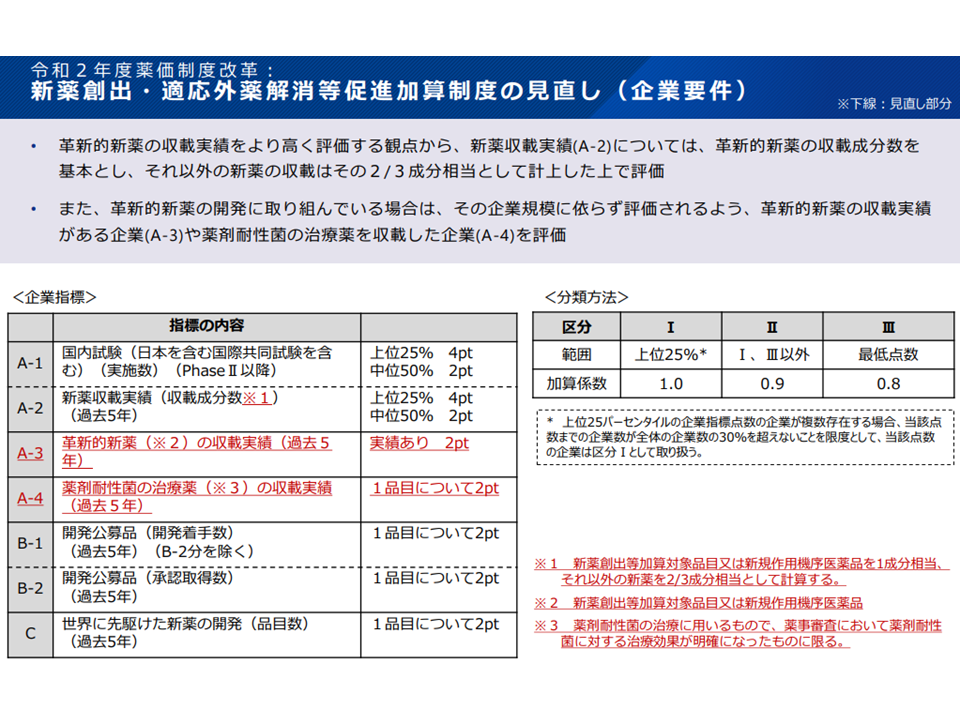
新薬創出等加算の企業要件(薬価専門部会8 211020)
このうち企業要件を少し詳しくみると、各製薬メーカーの▼国内試験▼新薬収載▼革新的医薬品▼開発酵母品―などに関する実績を数値化して評価し、それを積み上げた合計ポイントが上位25%であれば「加算を100%付与する」、上位25%未満最低超であれば「加算を90%付与する」、最低であれば「加算を80%付与する」という具合に分類されています。2021年度の中間改定後、最低ポイントとなっているメーカーは8社、上位25%は21社、中間は60社となっています。
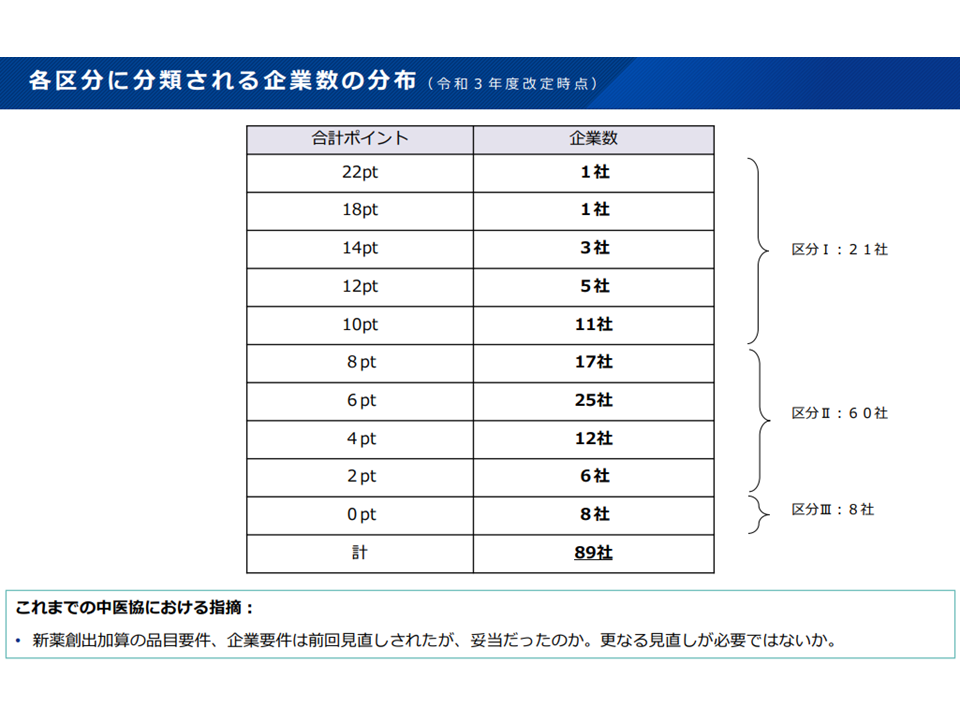
製薬メーカーの実績ポイント獲得状況(薬価専門部会9 211020)
この点、中医協委員からは「メリハリをさらにつけるべきではないか」との指摘が出ています。例えば「企業の分類方法を見直す」、「加算付与率の傾斜を厳しくする」などの手法が考えられそうです。なお、新興の製薬メーカー(たとばベンチャー企業)では実績が低くなりがちですが、「最低ポイントとなっても中間区分に該当させる」などの配慮が行われ、また実績を見ても「最低ポイントとなるベンチャー企業は現時点では存在しない」ことが確認されています。
また支払側の幸野委員は「企業要件について相対評価が採用されているが、絶対評価とすべき」との見解を改めて示しました。例えば「新薬の薬価収載が年間●件以上、革新的医薬品の開発実績が年間●件以上でなければ、100%の加算付与は認めない」といったイメージです。
また(3)は、かねてから支払側が強く求めている「原価開示をどう促進させていくか」という論点です。原価計算方式では、原価の開示度合いを高め「薬価算定の透明性」を確保するために、補正加算について原価開示度が80%以上の場合には「加算を100%付与する」が、開示度が50-80%の場合には「加算を60%に減算する」、さらに開示度が50%に満たない場合には「加算を20%に減算する」という厳しいルールが設けられています。

原価計算方式の概要(薬価専門部会4 211020)
しかし2018年度以降に原価計算方式で薬価設定された医薬品の開示度を見ると、80%以上は31.9%(47成分中15成分)、50-80%は17.0%(同8成分)、50%未満は51.1%(同24成分)となっています。
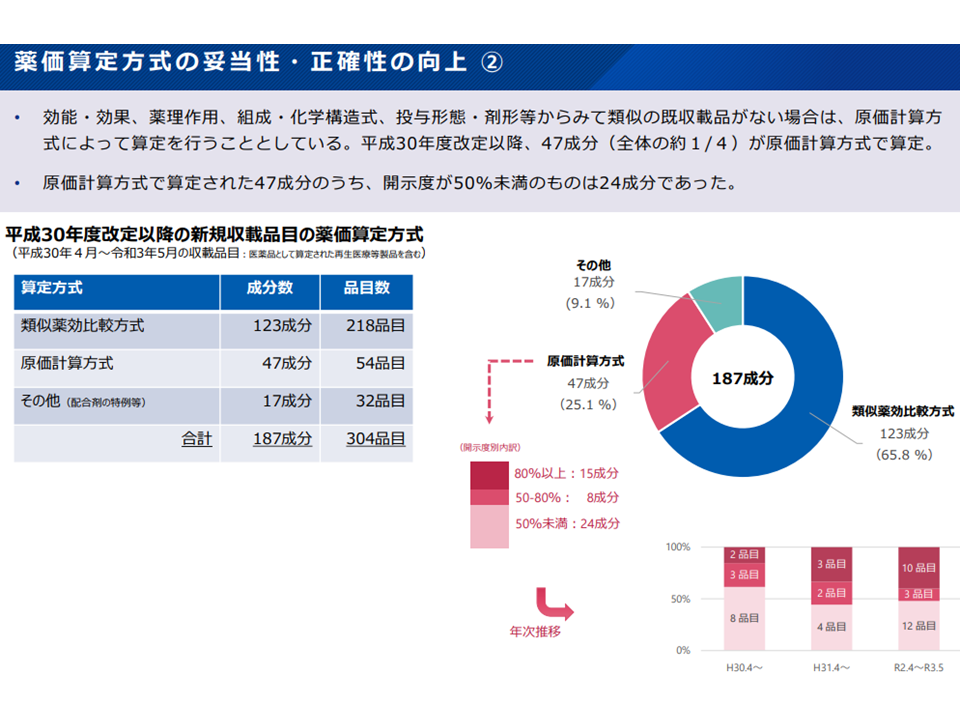
2018年度以降に原価計算方式で薬価設定された47成分のうち過半数の24成分は開示度が50%未満であった(薬価専門部会5 211020)
支払側委員はこうした状況を踏まえて、改めて「原価開示を進め、薬価算定過程の透明性を高めることが重要である」と強調。例えば幸野委員は「開示度が低い場合の加算率をさらに引き下げるべき(事実上の無加算とする)、加算は薬価全体に乗せるのでなく営業利益率にのみ乗せることなどを考えるべき」と提案。診療側の城守国斗委員(日本医師会常任理事)も幸野委員と同じ方向を向いています。
他方、(6)は市場拡大再算定の見直しを検討する論点です。市場拡大再算定は、予想販売額を大きく超えて販売された医薬品について価格を引き下げるもので、現在(i)薬価改定時の再算定(ii)薬価改定時以外の再算定(いわゆる四半期再算定)(iii)特例再算定―の3種類があります。
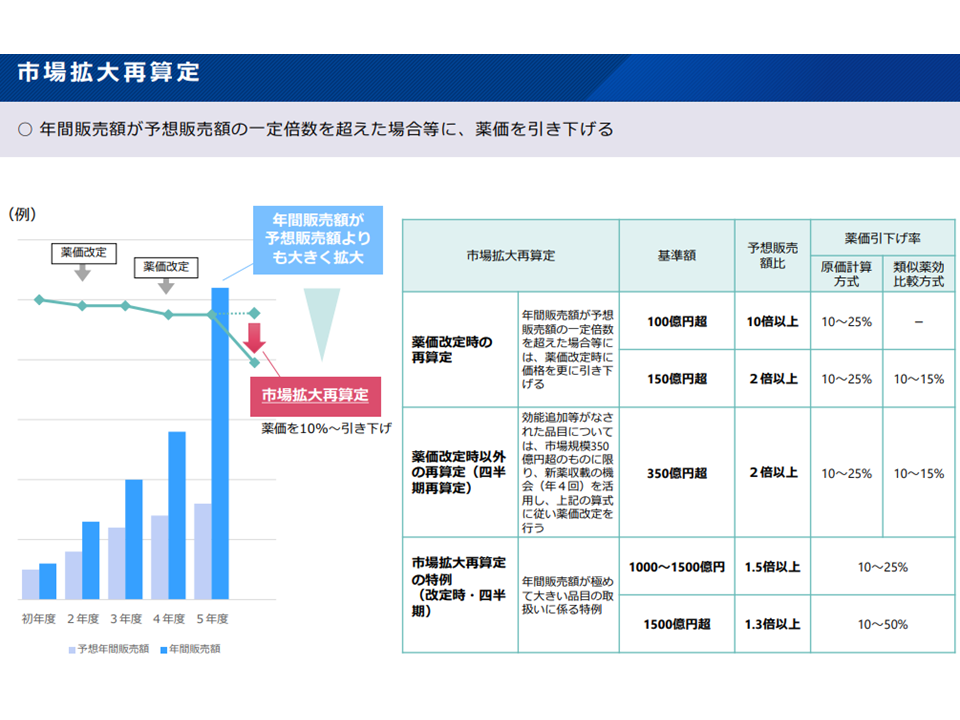
市場拡大再算定ルールの概要(薬価専門部会12 211020)
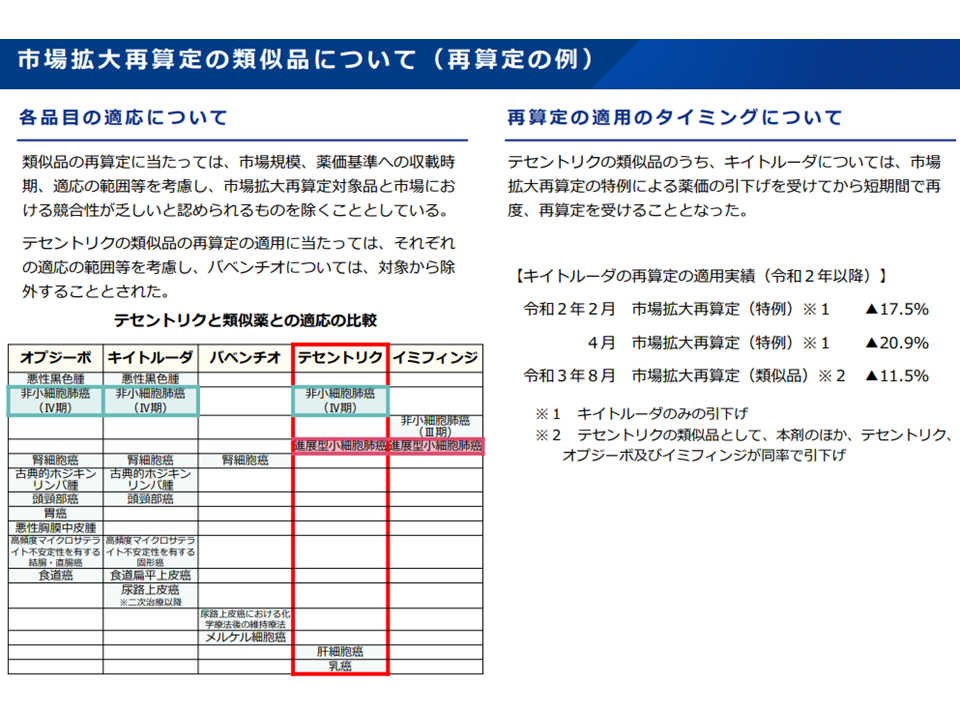
ところで、A薬(例えば画期的抗がん剤のテセントリク)が再算定の対象となった場合には、市場が競合する類似薬(例えばオプジーボ、キイトルーダ、イミフィンジ)も価格引き下げが行われます(市場で公平な競争を促すため)。

市場競合性を確保するため、市場拡大再算定対象の類似薬が再算定対象となることもある(薬価専門部会13 211020)
ただし、こうしたルールのために、短期間で繰り返し再算定(つまり価格の引き下げ)を受ける医薬品が出てきてしまいます。例えばキイトルーダでは昨年(2020年)2月から今年(2021年)8月の間に3度の再算定が行われています。
市場拡大再算定ルールにより短期間に繰り返し再算定を受けるケースもある(薬価専門部会14 211020)
こうした事態を放置すれば、企業側は「予測を建てられない。そうした中では開発投資を躊躇せざるを得ない(投資しても、予測できない価格引き下げがたびたび起こり、投資資源を回収できないことも生じうる)」と考えることでしょう。これは国民に「優れた医薬品が供給されない」ことにつながり、不幸な事態を招いてしまいます。紀平薬剤管理加算もルールの見直しが必要であるとして中医協に議論を要請しています。
この点、診療側の城守委員は「連座的な再算定(上記ではAの再算定に引きずられてBも価格引き下げが行われる)について、企業側にも納得感のある仕組みとすべき」との考えを示しましたが、支払側の幸野委員は「市場で競合する医薬品であれば同じ取り扱いとすべきであり、個別に検討するよりないのではないか」との考えを示しました。幸野委員は、例えば「連座再算定に制限を設ける」仕組みには慎重姿勢であることが伺えます。
このほか、▼改正薬機法への対応については、特定用途医薬品等の種類や数を見て評価の在り方を考えるべき▼安定確保医薬品については、まず最優先対応が提言されているカテゴリA(21成分)について、基礎的医薬品との関係を整理することから始めるべき▼基礎的医薬品の価格を下支えするルールについては不合理(例えば同じ銘形の中で基礎的医薬品に該当するものとしないものとが生じるなど)が出ないような仕組みに改善すべき―などの意見が出ています。「厚労省が今後示す具体案を見て、詳細な検討を行いたい」との見解と受け取ることができます。
【関連記事】
2022年度薬価改革に向け、新薬創出等加算の拡大、原価開示促進方策など検討―中医協・薬価専門部会
特許期間中は薬価を維持する仕組みを構築することで、日本国内での新薬開発が活性化―中医協・薬価専門部会
2022薬価改定、新規後発品の価格設定ルール・原価計算方式の在り方・イノベーション評価などが重要論点―中医協・薬価専門部会





