プログラム医療機器の経済的評価、「コストの明確化」「追加データに基づく再評価」などが重要論点—プログラム医療機器ワーキング
2023.5.18.(木)
プログラム医療機器(SaMD)の経済的評価(材料価格の設定、技術料の設定)を考えるにあたっては、「研究開発コストをどう明確化するか」「2段階評価を行う場合に、1段階目の評価をどう考えるか」「保険適用後の有用性エビデンスが構築された場合の追加評価をどう考えるか」などが重要論点になる—。
5月16日に開催された「プログラム医療機器等専門ワーキンググループ」(以下、ワーキング)でこういった議論が行われたことが、厚生労働省保険局医療課医療技術評価推進室の中田勝己室長から明らかにされました。
目次
プログラム医療機器のコストをどう明確化し、評価していくか
プログラム医療機器(SaMD:Software as a Medical Device)の診療報酬上の評価に関する議論が進められています(関連記事はこちらとこちら)。
プログラム医療機器とは、アプリケーションや人工知能(AI)を活用した「疾病の診断・治療」を目的とする機器で、例えば、2020年11月には「禁煙治療を補助するアプリケーション」の保険適用が認められています(関連記事はこちらとこちら)。今後、技術の進展によりプログラム医療機器が数多く開発され、保険診療の中でも活用されていくと考えられますが、既存のモノである医療機器と異なるため「どのように評価していくか」の検討が続けられています。
この点、2022年度の医療材料価格制度改革の中でも「保険適用等の予見可能性を高める」「医師の負担が軽減されるのであれば、技術料の施設基準を緩和する」などの方向が固められていますが、2024年度の次期診療報酬改定に向け、中央社会保険医療協議会・保険医療材料等専門組織(保険医療材料の機能区分や償還価格などの原案を作成する専門家の集まる)の下に「プログラム医療機器等専門ワーキンググループ」を設置し、さらに▼プログラム医療機器等の評価に関する技術的な事項▼プログラム医療機器等のチャレンジ申請(使用実績を踏まえ、より償還価格の高い機能区分への再評価を求められる仕組み)の評価の妥当性に関する事項▼プログラム医療機器等に関する技術的な助言—などを検討しています(関連記事はこちら)。
5月16日のワーキングでは、前回4月18日に続き、業界団体からの意見を聴取し、委員との意見交換が行われました。今回は▼日本医療機器産業連合会▼欧州ビジネス協会(EBC)▼米国医療機器・IVD工業会—の3団体が参加しました。
3団体からの意見は、主に(1)プログラム医療機器の「コスト」を材料価格や技術料で十分に評価すべき(2)プログラム医療機器の経済評価について予見可能性が確保されるよう、評価軸を明確化すべき(3)医療政策上の課題解決に向けたイノベーションを経済的評価で後押しすべき—というものです。
まず(1)のコストに関しては、プログラム医療機器では▼研究開発(販売管理費)がコストの大きな部分を占め、人件費・クラウドサービス経費などが高騰している▼上市後も、OS更新や情報セキュリティ対応など機能改善などに迫られ、設計やテストなどの「研究開発」が継続する—という特性があることが3団体から説明され、これを経済的に評価すべきとの提案がなされました。クラウドサービスの利用料は下図のように、インフレ率を上回る水準で高騰しています。
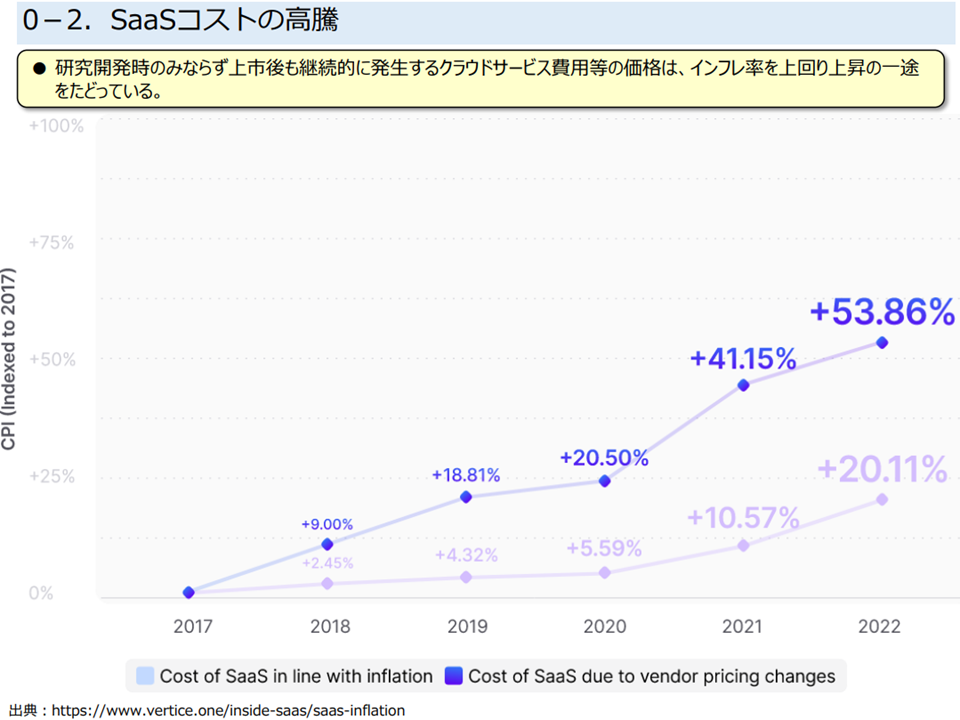
SaaSコストの高騰1(プログラム医療機器ワーキング1 230516)
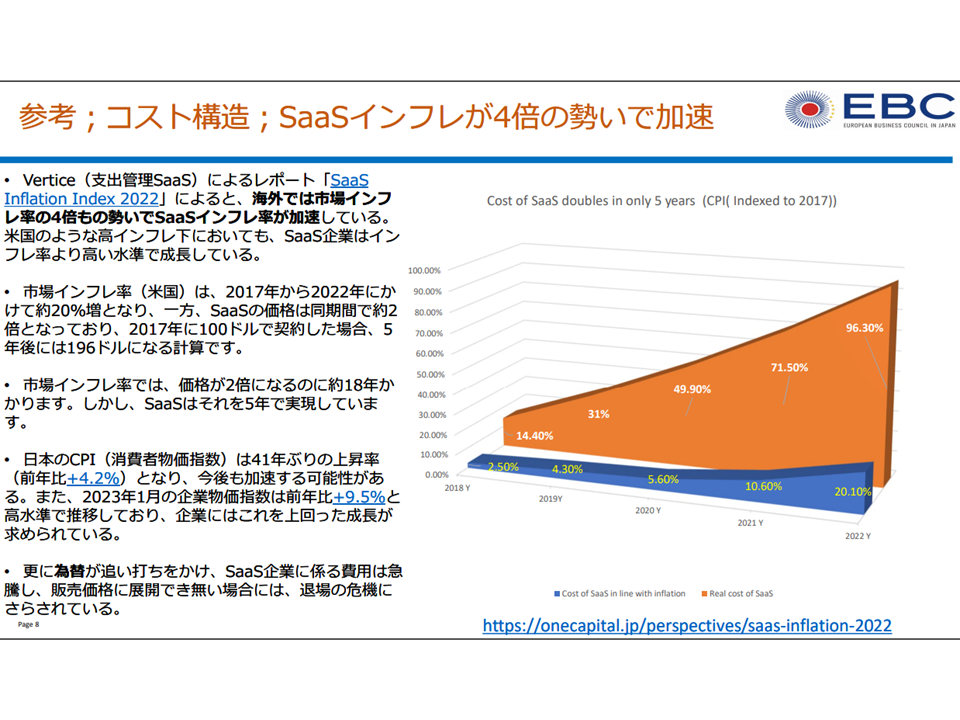
SaaSコストの高騰2(プログラム医療機器ワーキング2 230516)
こうしたコストが経済的に評価されなければ、メーカーサイドは研究・開発から手を引いてしまうことは述べるまでもなく、ワーキング委員も「コストと評価は連動する」と理解を示しています。ただし「評価の充実(高点数などの設定)について患者等の理解を得るためには、コストの透明化が必要である」との注文が委員からついています。コストの開示は重要な企業秘密でもあり、「透明性をどう確保していく」のかが今後の議論における重要ポイントの1つになるでしょう。
また(2)については、例えば「イノベーション評価の該当性・価値評価や準用技術料、施設基準緩和の該当性などについて、できる限り網羅的に明示(通知発出など)してほしい」などの要請が出ています。
メーカー視点に立てば「一定の評価を得られると思い、時間とコストをかけて研究開発をしたが、保険上の評価が極めて低かった、保険適用が認められなかった」事態が続けば、研究開発のモチベーションが下がり、結果として「優れた医療に日本国民がアクセスできない」状況に陥ってしまいます。
このため「保険適用、保険上の評価について、考え方を可能な限り事前に明確化しておく」ことが重要ですが、プログラム医療機器には「従来、想定していなかった」内容のものも少なくないため、「どこまで明確化できるか」という課題もあります。この点も今後の重要論点の1つとなります。
2段階評価を行うとして、第1段階評価では「評価療養」に位置づけることを提案
他方(3)の経済的評価に関しては、例えば(a)「医師働き方改革」や「医療費削減」に貢献するプログラム医療機器について加算評価を行い、研究開発を後押しすべき(b)2段階評価のうち1段階目で「低い評価」を行うべきではなく、「評価療養」で対応すべき(c)償還範囲が限定された場合には、超過部分を「選定療養」で対応すべき(d)事後にも「追加の技術評価」などを行うべき—などの意見が出されました。
このうち(a)は、例えばマンモグラフィの読影を補助するプログラムについて、「診断時間を短縮し、医師働き方改革への貢献が認められる点を加算評価する」「従来の『微小乳がん見落とし→進行→医療費増』を防止する点について、医療費削減効果の一部を加算評価する」ことなどが提案されました。後者については費用対効果評価にも通じるものがあり、魅力的な提案と言えるでしょう。
一方、前者については「多くの患者を診療できる(=診療収益増にもつながる)ことになり、どの部分を評価すべきかを丁寧かつ慎重に検討する必要がある」旨の意見が委員から出されています。
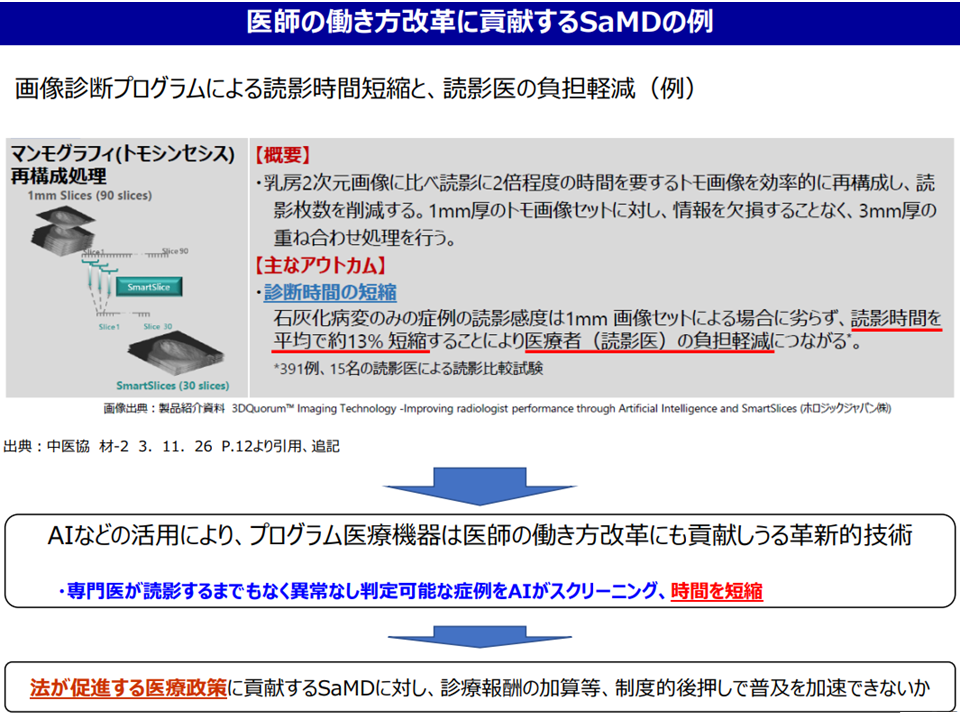
医師働き方改革とプログラム医療機器(プログラム医療機器ワーキング3 230516)
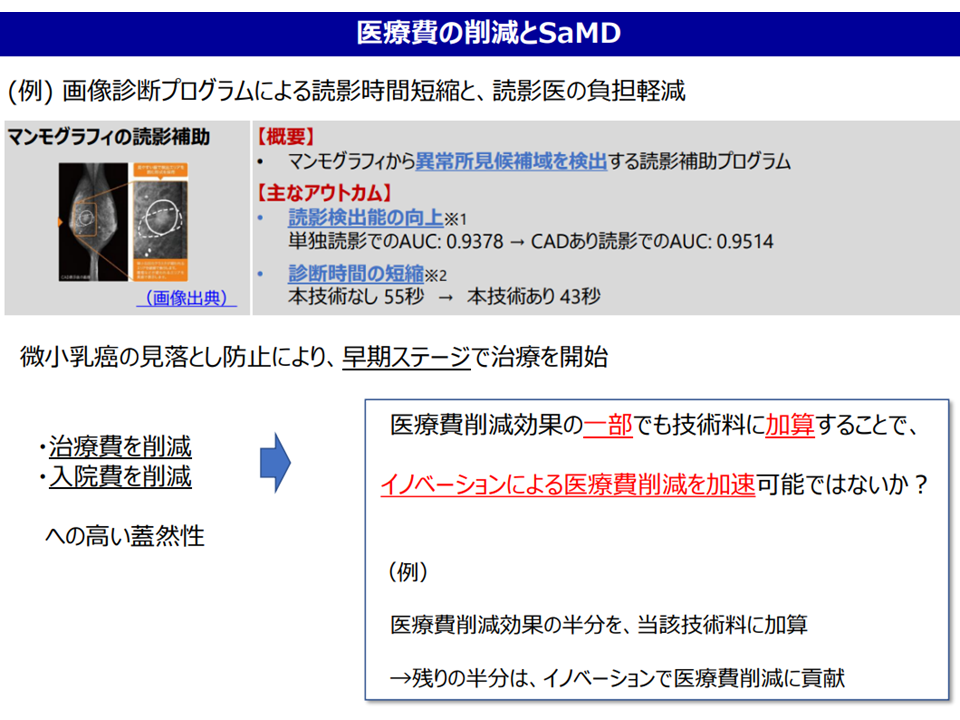
医療費削減とプログラム医療機器(プログラム医療機器ワーキング4 230516)
また(b)の「2段階評価」は、規制改革推進会議が昨年(2022年)12月に行った中間答申で示された考え方で、プログラム医療機器の開発に長期間がかかることを踏まえ、▼「有効性の推定」をもって第1段階承認を行う、これによりプログラム医療機器が広く臨床現場で使用され、データ収集をしやすくする▼「実臨床での有効性評価」をもって第2段階承認(本承認)を行う—というものです。
現在、具体的な制度設計に向けた検討が進められており、業界サイドはこれまでに▼第1段階で、適応用途・機能/機序に応じた暫定的な【技術区分】を設定し、区分毎に期限付きで評価する【一定額】を定める▼第2段階承認後、検証的試験等のデータに基づいて、新たに検証された価値を【イノベーション評価加算】として上乗せする—といった提案を行ってきました。
しかし、前回会合で第1段階評価について「『有効性の推定』という限られたエビデンスに基づくため、低い評価とせざるを得なくなる」との指摘が委員から出されました。
この点、5月16日の今回ヒアリングでは、第1段階評価について「低い償還価格を設定するのではなく、『評価療養』とすべき」との主張が行われています。
評価療養とは、例えば先進医療や患者申出療養など、「保険診療と保険外診療を組み合わせる」ことを認めるものです。保険外の医療技術については、通常、保険診療との組み合わせは認められず、全額自己負担となります。しかし、「自己負担が大きすぎて、その技術を利用することは控えよう」と考える患者が少なくないため、当該技術の安全性・有効性データがなかなか集積されません。
そこで、安全性・有効性が一定程度推定される技術については、先進医療や患者申出療養として「保険診療と保険外診療を組み合わせ」を認め、患者負担を一定程度軽減します(患者が全額負担するのは保険外の技術部分のみとなる)。これにより上記よりも広範に技術が使用され、安全性・有効性データが集積され、保険適用につなげられる可能性が出てくるのです。
今後、2段階評価における「経済的評価の在り方」も議論していくことになるでしょう。
他方、(c)は、例えば、すでに保険適用されている「高血圧アプリ」は、保険診療の中で「6か月間」という使用制限がありますが、患者が「6か月以降も使用したい」と希望する場合には、「選定療養」(当該アプリ使用部分は自己負担、他の通常診療部分は保険診療)として使用継続を認めるべきとの提案です(この仕組みがない場合、6か月以降は一連の高血圧症治療について、すべての自己負担となる)。
保険適用後に得られたエビデンスをもとに「改善チャレンジ申請」を認めよと提案
また(d)は、保険適用後に「優れた効果」などのエビデンスが構築された場合に「追加の評価」を行うべきとの提案です。
この点、医療機器には「チャレンジ申請」という仕組みが既に準備されており、「保険適用後の有用性データ」をもとに再評価がなされます(評価引き上げのチャンスあり)。しかし、メーカーサイドは、現在のチャレンジ申請には▼保険適用の希望を出す際にチャレンジ申請を行わなければならず、研究計画作成に必要な基礎データ―収集に一定の時間が必要となり、チャレンジ申請を断念せざるを得ないケースが少なくない▼チャレンジ申請は「1回」のみであり、データ・エビデンスが徐々に構築される中でお「複数回の追加評価」はなされない—という問題点があることを指摘。
このため、プログラム医療機器の特性を踏まえて「保険適用後にも、一定期間の間にチャレンジ申請可能な仕組みとする」「複数回の追加評価を行える仕組みとする」などの改善を求めています。
例えば、昨年(2022年)11月末に保険適用された「内視鏡用テレスコープ用いたインフルエンザ感染診断」技術は「305点」の点数が設定されました。メーカーサイドはは、この感染診断技術について仮に「既存の検査キットに比べて10%の有用性があるとのエビデンスが示された場合には、305点×0.1(10%)の『30点』を追加で上乗せ評価する」といったイメージを述べています。
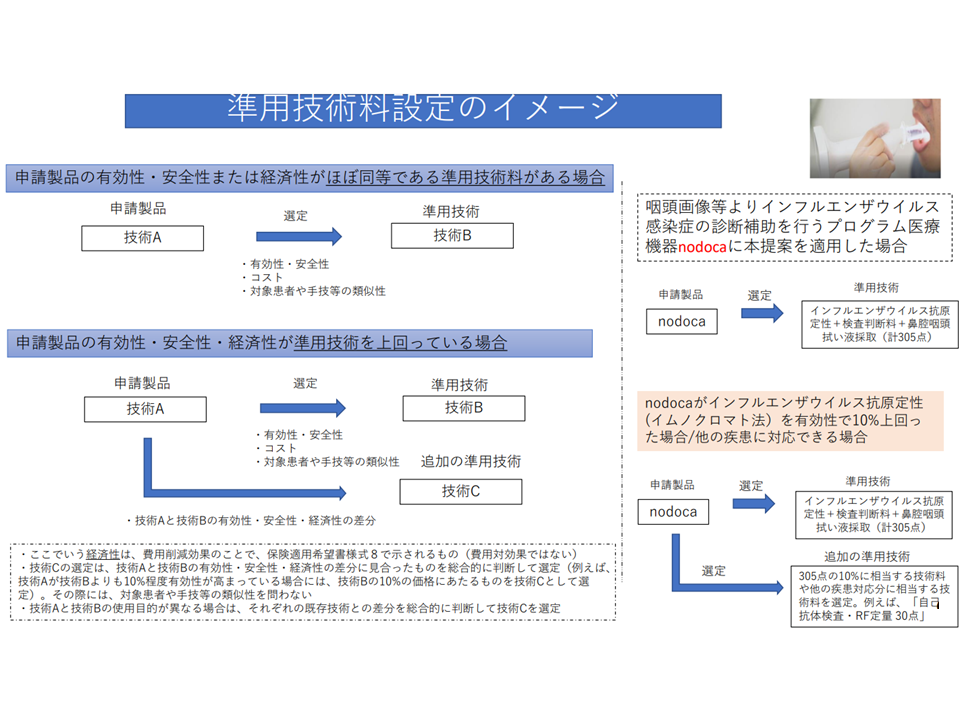
追加評価のイメージ(プログラム医療機器ワーキング5 230516)
前回会合では、委員から「事前に『有用性のデータを集めて計画的にデータを収集していく』ケース(通常のチャレンジ申請)と、『計画は立てず、事後にたまたま有用性のデータが見いだされた』ケース(今回提案されているような場面)とでは、異なる考え方をすべきではないか。後者のケースでは『新たな機能』として医療技術評価分科会などで再評価を検討していくものではないか」との指摘が出ました。しかし、医療技術評価分科会での評価には「2年に一度に限定されてしまう」という部分があり、メーカーサイドは「より柔軟な評価が期待できる改善したチャレンジ申請」を希望しているようです。今後、考え方の整理等が進められることでしょう。
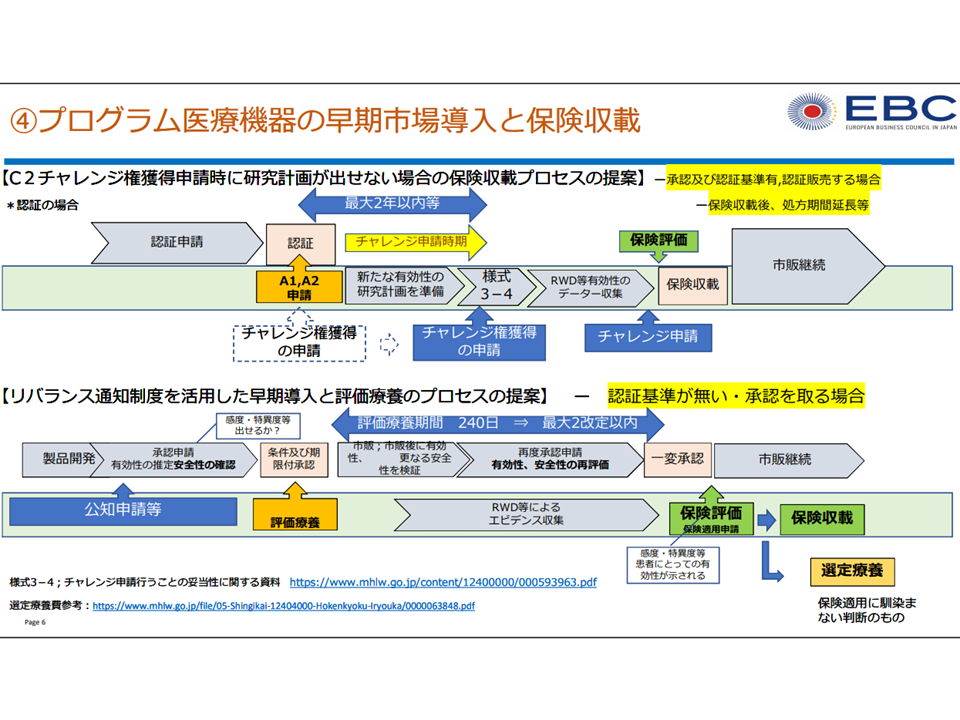
改善チャレンジ申請、2段階評価をメーカーサイドが提案(プログラム医療機器ワーキング6 230516)
ワーキングでは、前回と今回のヒアリング結果も踏まえて「プログラム医療機器の評価の在り方」について論点整理などを行い、夏頃(7月目途)に意見をまとめる予定です(その後、中医協で具体的な制度設計議論に入る)。
【関連記事】
プログラム医療機器活用による「医療従事者の負担軽減」などの要素を診療報酬等で評価すべきか—プログラム医療機器ワーキング
コロナ禍で「2020年度にDPC病棟等の在院日数が延伸してしまった」が、21年度には再び「短縮」—中医協総会(2)
プログラム医療機器、有用性や医師負担軽減効果踏まえた施設基準緩和等の考え方明確化―中医協・材料専門部会





