医療用医薬品のバーコード表示、表示義務付け項目では「ほぼ100%」表示を達成、任意表示項目は1-17%にとどまる―厚労省
2024.7.4.(木)
医薬品のトレーサビリティ(追跡可能性)を高めるために導入されている「バーコード表示」について、必須が義務付けられている項目では概ね100%バーコード表示されている。ただし、任意表示となっている項目については、バーコード表示割合は低い水準にとどまっている―。
こういった状況が、厚生労働省が7月2日に公表した2022年9月末時点の「医療用医薬品における情報化進捗状況調査」結果から明らかになりました(厚労省のサイトはこちら)。製薬メーカーのさらなる取り組みに期待が集まります。
トレーサビリティの確保や、取り違え防止に向け、バーコード表示を推進
医薬品に不純物が混入していた場合や新たな副反応が明らかになった場合などには製薬メーカーが対象商品を自主回収します(関連記事はこちら)。その際、医療機関などは当該医薬品の使用を差し控える必要がありますが、どれが対象医薬品なのかが明らかになっていなければいけません。さらに偽造医薬品などが流通した場合には、医療機関などは備蓄医薬品が正規品か否かを判断しなければいけません。
こうした医薬品市販後のトレーサビリティ(追跡可能性)の確保や、医薬品の取り違え事故の発生防止、流通の効率化を促進するために、厚労省は「医療用医薬品へのバーコードの表示」を進めています。医療用医薬品の種類に応じて、バーコード表示の義務付けや、任意表示(できるだけ表示する)の依頼をしています。さらに厚労省はバーコード表示が実際に行われているか否かを毎年調査し、その結果を公表しています。今般発表されたのは、2022年9月末時点の状況です。
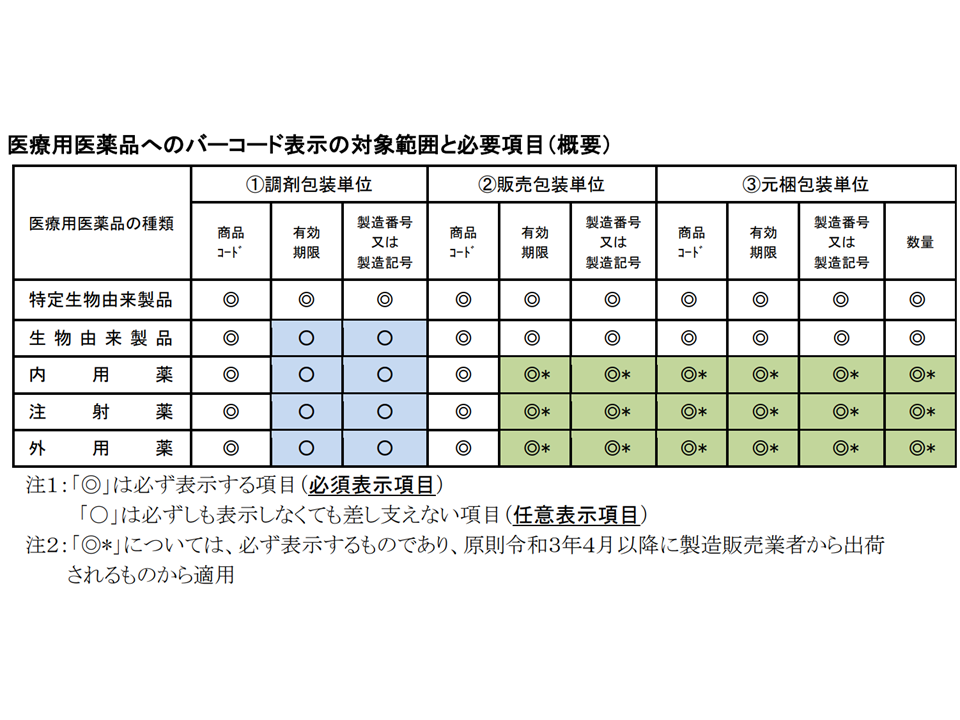
医薬品へのバーコード表示の対象範囲・必要項目
製薬メーカーに対する調査結果を見てみましょう。
医薬品の種類や包装単位によって、必ずバーコード表示しなければいけない項目(必須表示項目)と表示しなくともよい項目(任意表示項目)とがあります。例えば、特定生物由来製品(ワクチン、遺伝子組換え製品など)では、すべての包装単位で▼商品コード▼有効期限▼製造番号または製造記号—のいずれもが必須表示項目となっており(バーコード表示が義務付け)、一般の内用薬・外用薬・注射薬では、調剤包装単位における「有効期限」「製造番号または製造記号」は任意表示項目となっています。
今般の調査では、すべての包装単位(▽調剤包装単位▽販売包装単位▽元梱包装単位)において「必須表示項目」についてバーコード表示割合が概ね100%であることが分かりました。
また、必須表示項目のうち「必ず表示するものであり、原則として2021年4月以降に製造販売業者から出荷されるものから適用する」とされた内用薬、注射薬、外用薬の「販売包装単位への有効期限、製造番号または製造記号」および「元梱包装単位への商品コード、有効期限、製造番号または製造記号、数量」についてのバーコード表示割合は、▼販売包装単位:約96-100%(前年度調査では約92-98%)▼元梱包装単位:約95-100%(同約96-100%)—となりました。
さらに、任意表示項目(調剤包装単位の有効期限、製造番号または製造記号)のバーコード表示割合は約1-17%(前年度調査では約1-22%)でした。
また、「バーコード表示の対応完了見込時期」については、▼販売包装単位:210社中204社(97.1%)▼元梱包装単位:207社中204社(98.6%)—が「2022年度下期(2023年3月)までに対応完了済み、あるいは対応完了見込み」と回答しています。
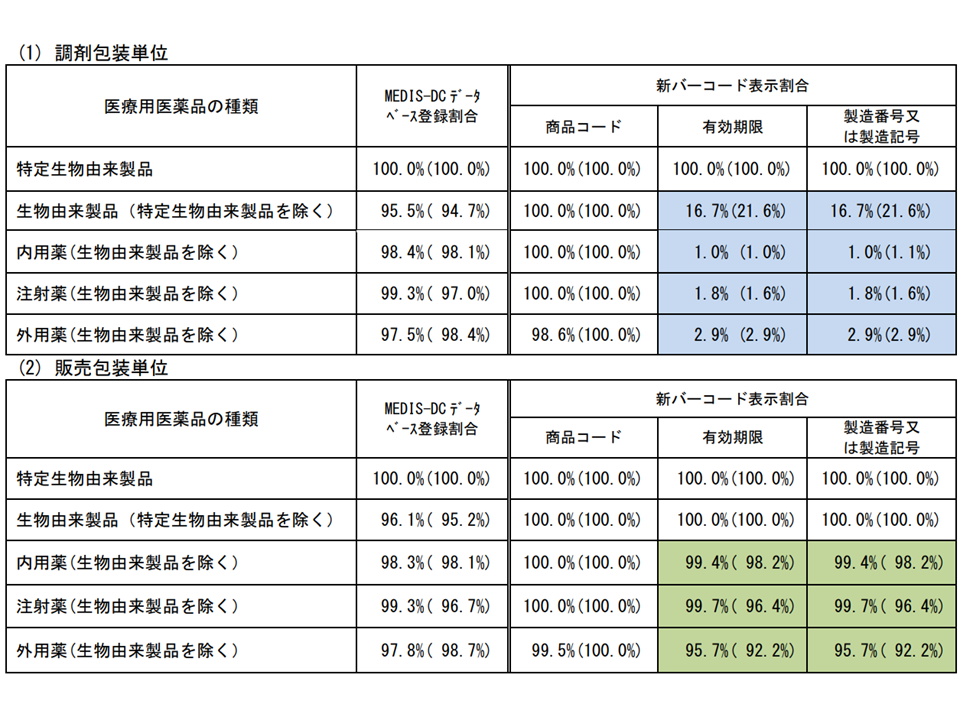
2022年9月末時点のバーコード表示状況1

2022年9月末時点のバーコード表示状況2
必須表示項目については製薬メーカーの取り組みが相当程度進んでいるものの、任意表示項目についてはまだまだ取り組みが十分に進んでいないようです。任意表示とは言え、医薬品のトレーサビリティが重視される中で、製薬メーカーの積極的な取り組みに期待したいところです。





