原価計算方式における「原価開示度50%未満」のペナルティ、加算係数「ゼロ」で決着―中医協総会(2)
2021.12.23.(木)
12月22日に開催された中央社会保険医療協議会・総会およびそれに先立って開催された薬価専門部会で、「2022年度薬価制度改革の骨子」が固められました。
注目された「原価計算方式における原価開示度50%未満の場合のペナルティ」については、業界の反対を押し切り「加算係数はゼロとする」ことで決着しました。ただし、このペナルティが「優れた医薬品の開発」にブレーキをかけてしまわないか心配する声も中医協委員から出ています。今後の状況をしっかり把握し、見直しが適切であったか検証することも重要でしょう。
今後、厚生労働省でさらに詳細を詰め年明け(1月下旬)に薬価制度見直し案が中医協に示されます。
調整幅・中間年改定ルールは「継続検討課題」に
骨子は、薬価専門部会等での議論・業界団体の意見などを踏まえ「2022年度薬価改革」の柱を整理したものです。次のような薬価制度改革を行う方針を固めました。
(1)新薬創出適用外薬解消等促進加算(以下、新薬創出等加算)の対象外である既収載品について、新規作用機序医薬品に相当するものに限らず「新規収載時であれば有用性加算等に相当する効能・効果」等が追加された場合には対象領域等の一定の要件を付して新薬創出等加算の対象とする
【対象領域の除外要件】
▼「既存の効能・効果の対象患者の限定を解除した」ものなど、既存の効能と類似性が高いと認められる効能追加等の場合▼有用性加算(II)の要件ニ(製剤における工夫により類似薬・既存治療に比して高い医療上の有用性を有することが客観的に示されている)のみに該当するもの―を除く
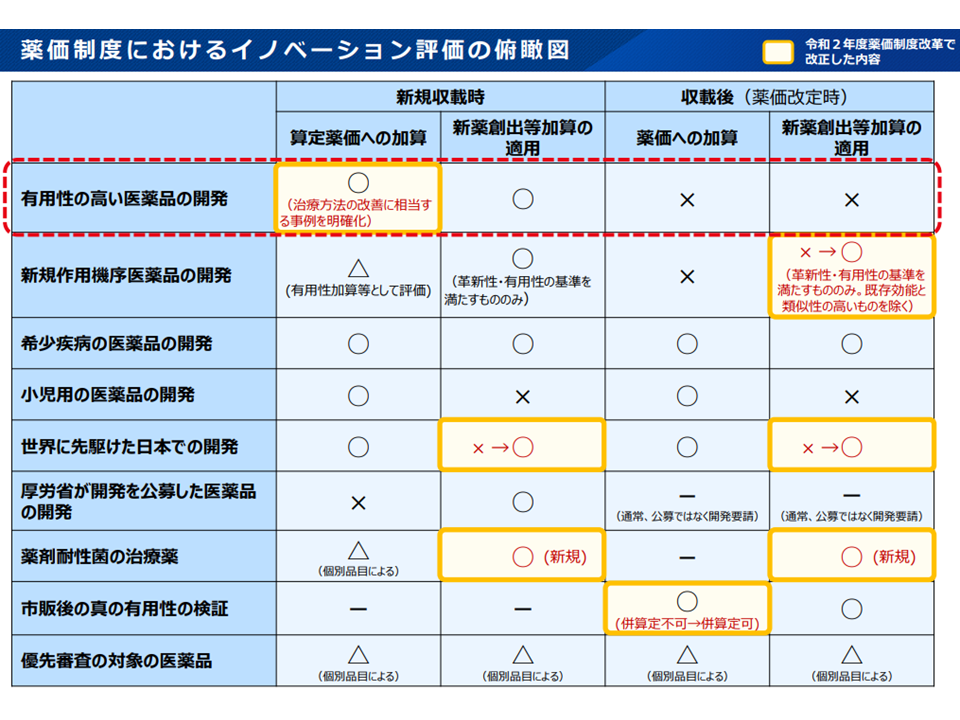
有用性の評価について、新規収載時と効能効果追加時とでズレがある(薬価専門部会1 210804)
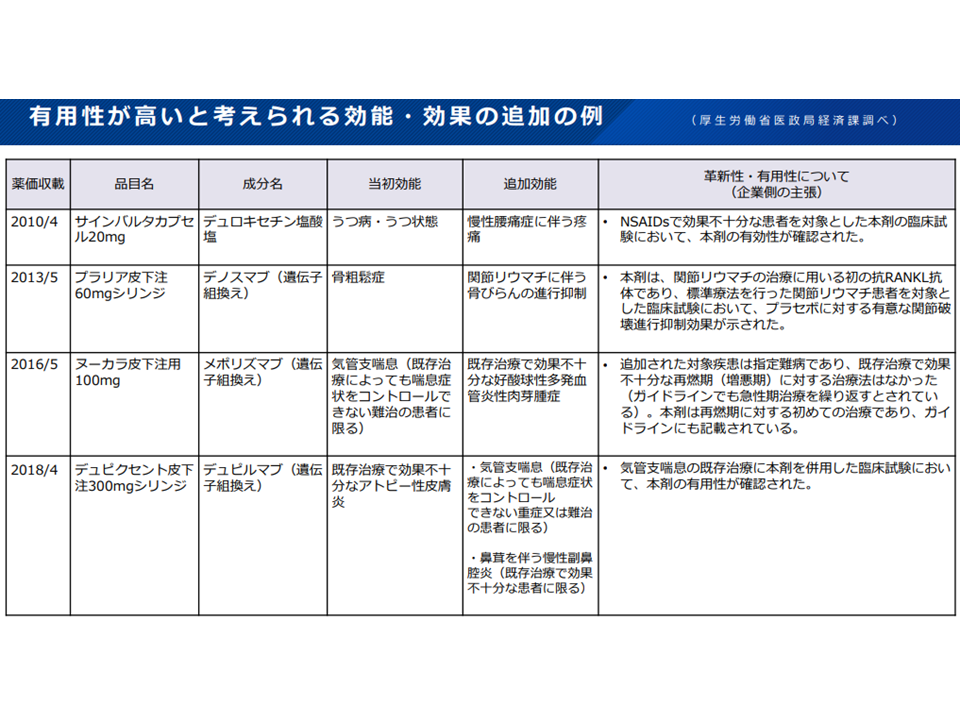
有用性が高いのではないかと思われる効能追加の例(薬価専門部会2 211020)
(2)「先駆的医薬品」の取り扱い
▽先駆け審査指定制度の対象品目に関する取り扱いと同様、新規収載時には算定薬価への加算・新薬創出等加算の対象とし、薬価改定時には改定時加算・新薬創出等加算の対象とする
▽先駆け審査指定制度の対象品目に関する取扱いと同様、先駆的医薬品の指定数(過去5 年)を新薬創出等加算の企業指標に加える(1品目につき2ポイント)
(3)「特定用途医薬品」の取り扱い
▽新規収載時には算定薬価への加算・新薬創出等加算の対象とし、薬価改定時には改定時加算(有用性加算(II)の計算方法を準用する場合と同様、加算率を補正する)・新薬創出等加算の対象とする
▽特定用途医薬品の指定数(過去5年)を新薬創出等加算の企業指標に加える(1品目につき2ポイント)
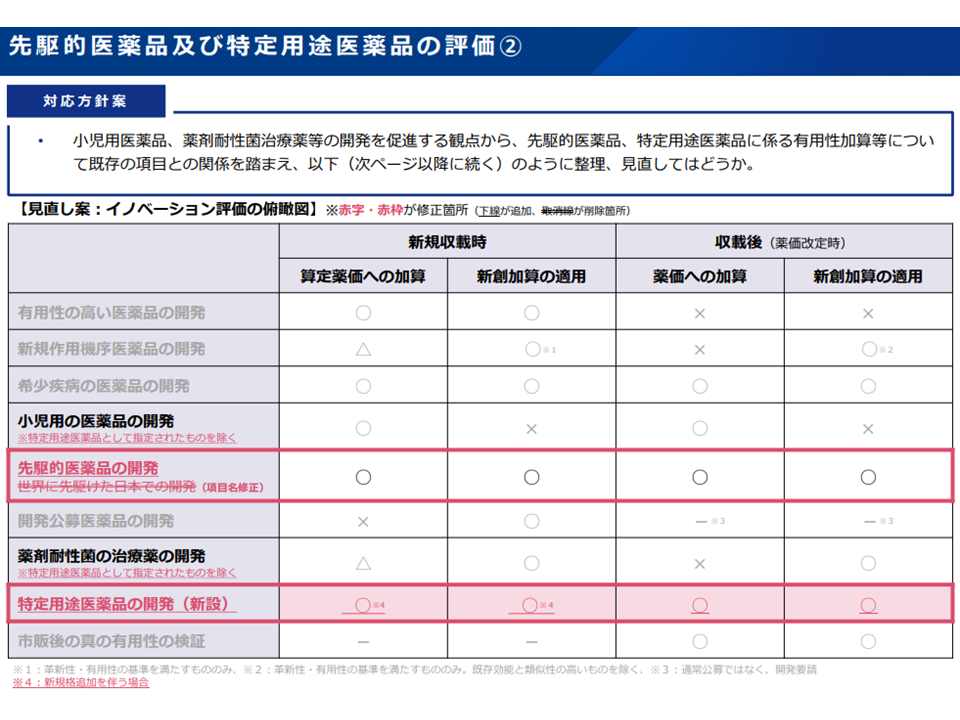
特定用途医薬品について新たに加算で評価する(中医協・薬価専門部会1 211201)
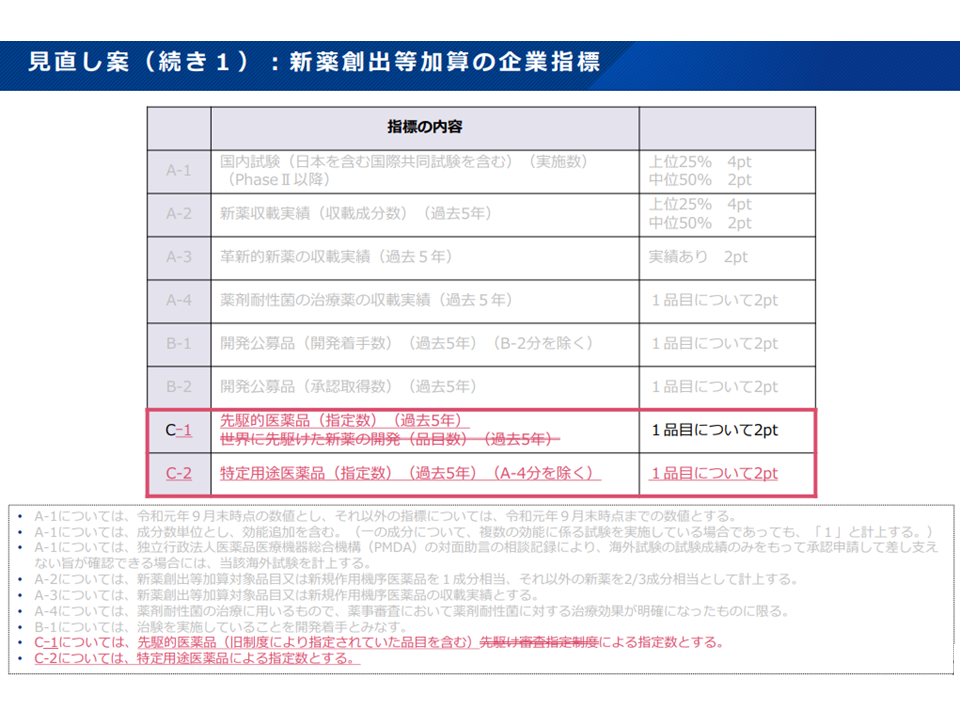
特定用途医薬品の開発状況を、新薬創出等加算の企業指標の評価対象に加える(中医協・薬価専門部会2 211201)
(4)新型コロナウイルス感染症に対し新たに承認を取得したワクチン・治療薬(過去5年間)を新薬創出等加算の企業指標に加える(1品目につき4ポイント)
(5)長期収載品について、特例引下げ(Z2)・補完的引下げ(C)にかかる「後発品への置換え率別の薬価引下げ率」を次のように見直す
▼2.0%引き下げ:(現行)50%未満 → (見直し後)60%未満
▼1.75%引き下げ:(現行)50%以上70%未満 → (見直し後)60%以上80%未満
▼1.5%引き下げ:(現行)70%以上80%未満 → (見直し後)廃止
(6)新薬創出等加算の企業区分について、企業区分III(加算係数が0.8と低く設定される企業)の対象範囲を現在の「最低点数」(現在はゼロポイント)から「2ポイント以下」に見直す
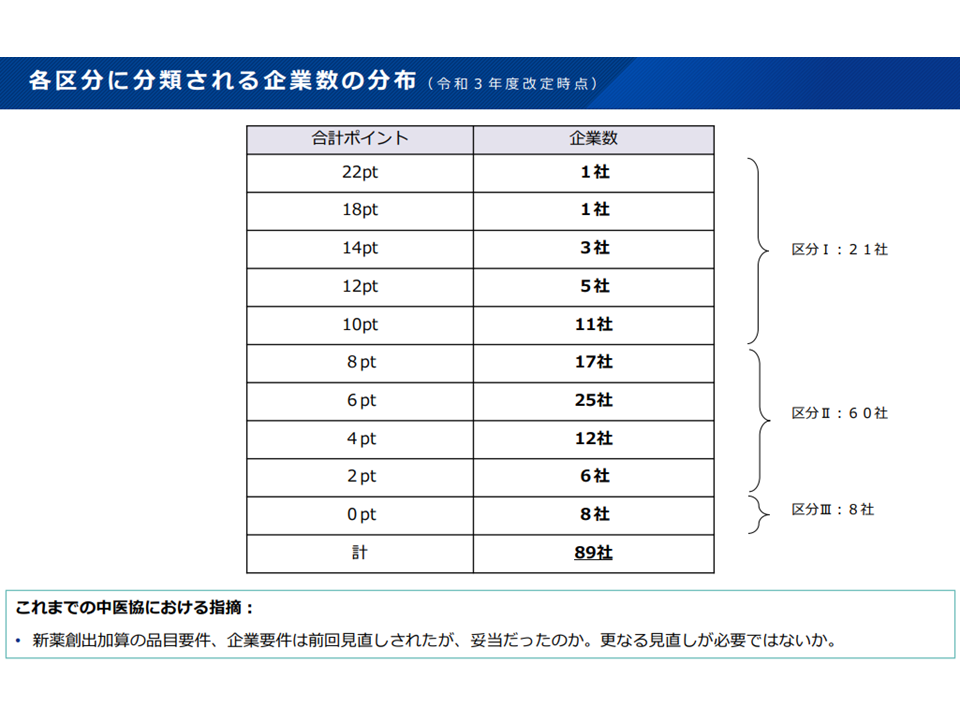
製薬メーカーの実績ポイント獲得状況(薬価専門部会9 211020)
(7)長期間薬価収載されている臨床上の必要性が高い医薬品について、次の取り扱いとする
▽基礎的医薬品の区分として「現時点で安定確保医薬品のうち優先度が高い品目(カテゴリ A、ただしZ期間終了前のものを除く)」を追加し、基礎的医薬品の要件に該当するものを基礎的医薬品と扱う
▽安定確保医薬品の「基礎的医薬品としての改定」に当たっては他のルールとの整合性を図る(G1(長期収載品から後発医薬品への置き換え促進ルールの1つ、後発品への置き換えが進んでいるもの(置き換え率80%以上)の段階的引き下げ)該当から6年以内、またはG2(長期収載品から後発医薬品への置き換え促進ルールの1つ、後発品への置き換えが困難なもの(置き換え率80%未満)の段階的引き下げ)該当から10年以内の先発品を対象外とするなど)
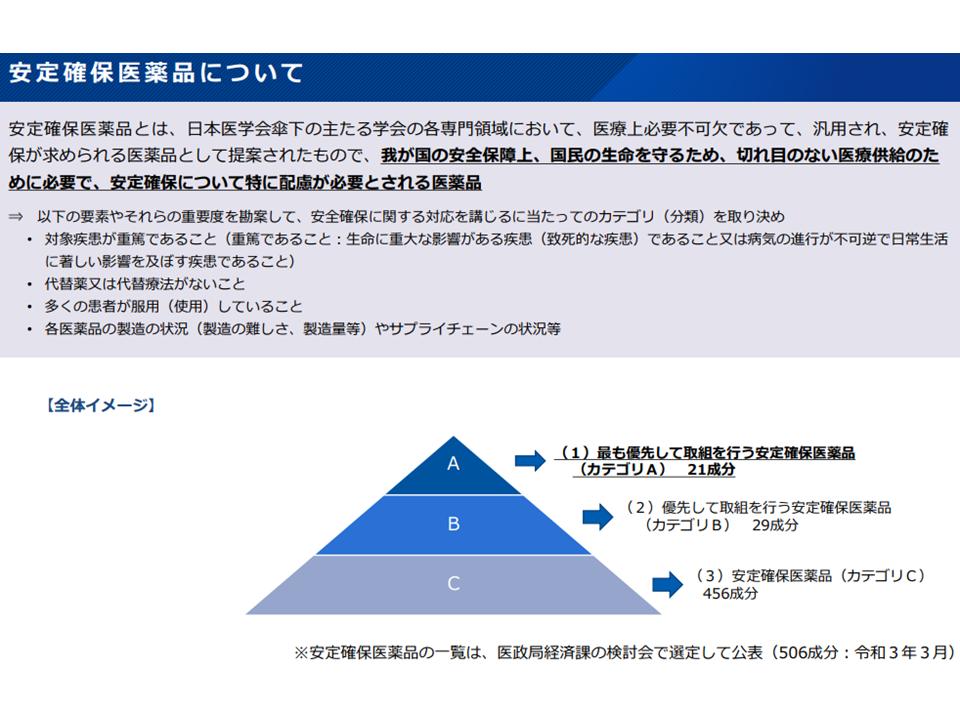
医学会の提唱する安定確保医薬品の概要(薬価専門部会10 211020)
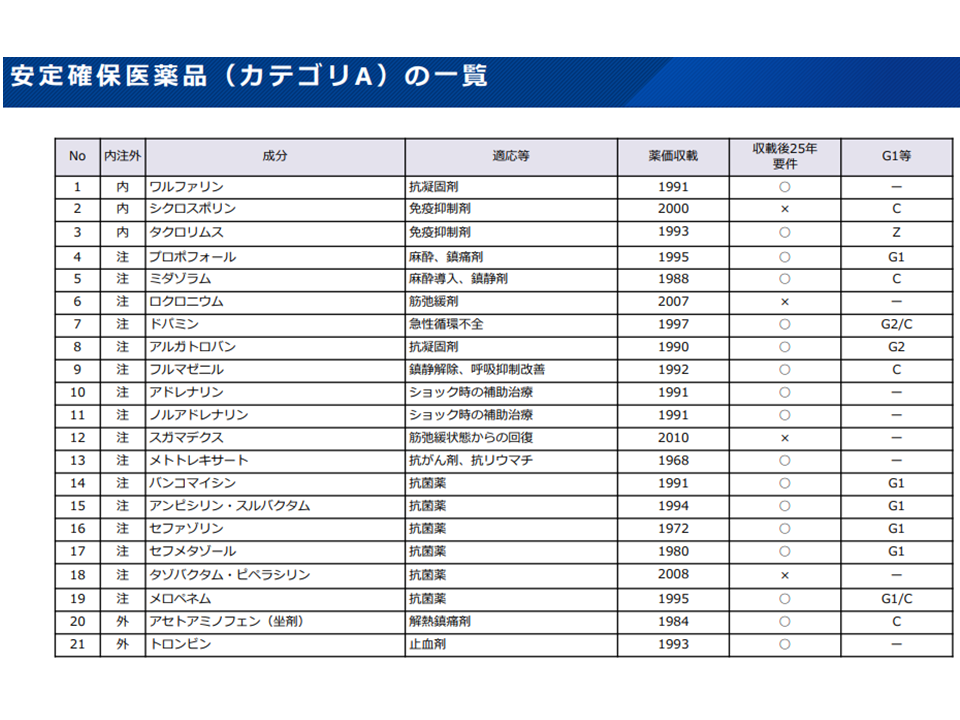
安定確保医薬品カテゴリA対象21成分(薬価専門部会11 211020)
(8)原価計算方式における薬価の透明性を確保する観点から次の見直しを行う
▽海外からの移転価格について、合理的な理由がある場合(輸入元企業で日本国内の臨床試験を行い、その試験費用が移転価格に計上される場合など)を除き、他国への移転価格(原則として最低価格、合理的理由があれば平均値・2番目に低い価格)を上限とする運用を明確化する
▽開示度50%未満の場合の加算係数を現在の「0.2」から「ゼロ」とする
▽一定期間、移転価格として日本に導入される品目のメーカーに対して、必要な営業利益率についてのデータ提出の協力を求める
(9)市場拡大再算定の特例の対象品または類似品として薬価が引き下げられた後、「特例の適用日の翌日から起算して4年を経過する日」までの間は、1回に限り他品目の市場拡大再算定の類似品対象から除く

市場競合性を確保するため、市場拡大再算定対象の類似薬が再算定対象となることもある(薬価専門部会13 211020)
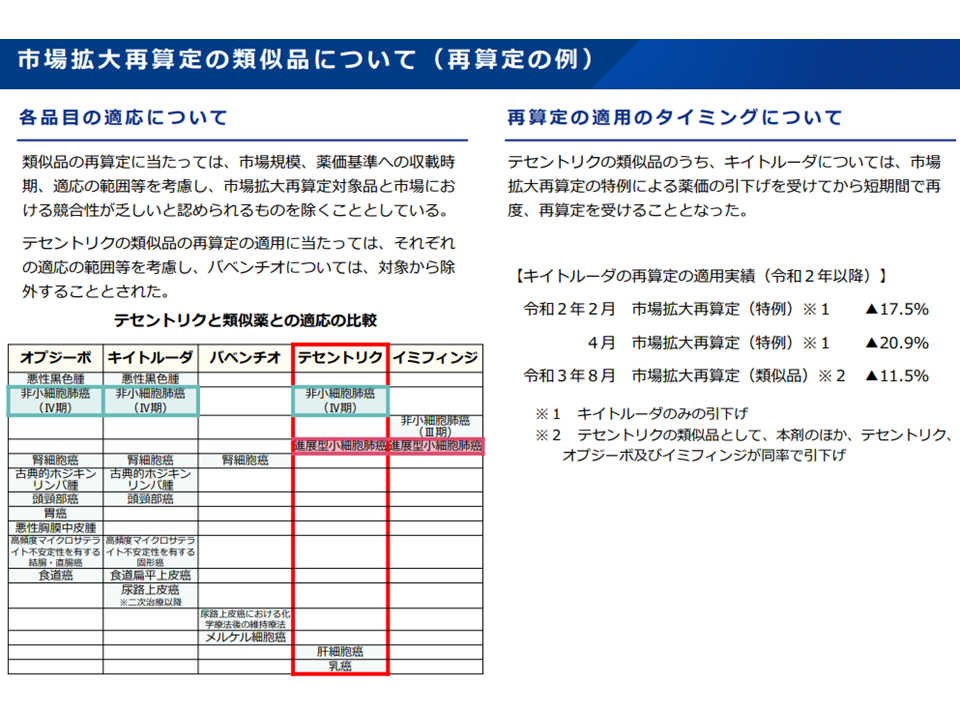
市場拡大再算定ルールにより短期間に繰り返し再算定を受けるケースもある(薬価専門部会14 211020)
(10)リポジショニング特例について、「未承認薬・適応外薬検討会議の議論を踏まえ開発公募が実施された品目」などを対象から除外する
(11)基礎的医薬品の改定ルールを、以下のように見直す
▽一度基礎的医薬品から外れた品目が再度基礎的医薬品の要件を満たす場合、基礎的医薬品として取り扱うものの、それ以外の基礎的医薬品まで価格を戻さず、その際の戻し幅を 50%分にとどめる(その薬価を当該品目の基礎的医薬品としての薬価とみなす)
▽これまで基礎的医薬品であった品目(A)が、基礎的医薬品から外れることにより、それ以外の基礎的医薬品外れ品目(B)との価格帯集約によりBの薬価を引き上げてしまう場合、Aはその集約後薬価、Bは改定前薬価とする(引き上げない場合は、AおよびBを集約する)
▽品目(規格)単位でなく「同一銘柄全体の乖離率の加重平均値」から該当性を判断する
(12)新規後発品の薬価算定は現在ルールを維持する
(13)今後、「年間1500億円の市場規模を超えると見込まれる品目」が薬事承認された場 合、通常の薬価算定手続きに先立って、直ちに中医協総会に報告し、当該品目の承認内容や試験成績などに留意しつつ薬価算定方法の議論を行う
また、「調整幅の在り方」「診療報酬改定がない年の薬価改定(毎年度改定)の在り方」については引き続き検討することになりました。
このうち(8)の「原価開示度50%未満の品目について加算係数をゼロとする」見直しについては、製薬メーカーサイドから「『有用性、革新性を認め加算で評価する』こととなったものを『その有用性、革新性を認めない』と判断しなおすことと同じで、革新的医薬品の開発が進まなくなってしまう」と強く反発していましたが当初案通りに決着しました。
ただし12月22日の薬価専門部会でも支払側の眞田享委員(日本経済団体連合会社会保障委員会医療・介護改革部会部会長代理)や支佐保昌一委員(日本労働組合総連合会総合政策推進局長)から「原価の透明性確保は極めて重要だが、イノベーション評価の観点に立てば『加算をゼロとする』点は気になる。今後、新薬開発に影響が出ないかをしっかり検証する必要がある」との指摘が出ています。「透明性を確保できたが、優れた医薬品開発が行われなくなってしまった」のでは困ります。しっかりとした検証が待たれます。
また(9)では、当初「3年間、他品目の市場拡大再算定の類似品としての対象外とする」との案が示されましたが、製薬メーカーサイドから「5年間は対象外にしてほしい」と要望。今般、間をとって「4年間」となりました。この見直しも「市場規模の大きな医薬品(=市場が優れていると認める、有用な医薬品)の開発」にどういった影響が出るのか、今後の検証に注目が集まります。
他方、継続検討課題となった「調整幅」については、支払側委員が「2000年度に調整幅を2%に設定してから動かしていない。当時と今とでは医薬品の流通コストが大きく変化しているのではないか。今後、卸業者の協力も得て必要なデータを揃え、現在の2%が妥当なのか検討していく必要がある」と要望しました(安藤伸樹委員:全国健康保険協会理事長、松本真人委員:健康保険組合理事)。
さらに支払側委員は、毎年度改定・中間年改定については「時間は限られており、早急に改定ルールなどの設定を議論する必要がある」と強く求めています。初の中間年改定は今年度(2021年度)に行われましたが、新型コロナウイルス感染症が大流行したため「特例的な改定」という位置づけになりました。今後の毎年度改定・中間年改定の基本ルールを設定することになる「2023年度改定」論議に注目が集まります。
【関連記事】
2022年度薬改革論議が大詰め、原価開示度が低い場合のペナルティ、調整幅の取り扱いなどポイント―中医協・薬価専門部会
市場規模が数千億円に上るような医薬品の登場を見据え、新たな価格調整ルールを検討すべきか―中医協・薬価専門部会
2022年度薬価改革、効能評価の整合性確保・原価開示の促進・市場拡大再算定の不合理解消など進める―中医協・薬価専門部会
2022年度薬価改革に向け、新薬創出等加算の拡大、原価開示促進方策など検討―中医協・薬価専門部会
特許期間中は薬価を維持する仕組みを構築することで、日本国内での新薬開発が活性化―中医協・薬価専門部会
2022薬価改定、新規後発品の価格設定ルール・原価計算方式の在り方・イノベーション評価などが重要論点―中医協・薬価専門部会





