2022年度薬改革論議が大詰め、原価開示度が低い場合のペナルティ、調整幅の取り扱いなどポイント―中医協・薬価専門部会
2021.12.6.(月)
2022年度の薬価制度改革論議が大詰めを迎えつつあります。12月1日の中央社会保険医療協議会・薬価専門部会では論点整理案が行われ、3日の薬価専門部会ではこれに対する業界からの意見聴取が行われました。間もなく、薬価制度改革の内容が固められます。
2021年度改定と同じく「実勢価格踏まえた引き下げ」の特例を設けるべきか否か
本稿では、論点整理の内容と業界からの意見とを併せて見ていきましょう。大きな改革項目は(1)革新的医薬品のイノベーション評価(2)国民皆保険の持続性確保に向けた適正化の推進(3)医薬品の安定供給確保・薬価の透明性等確保(4)その他—の4項目です。
まず(1)では、次の2つの改革案が議論されてきており、中医協委員からも業界段階からも特段の反論は出ていません。ただし業界サイドは前者について「評価対象品目を広めに設定してほしい」旨の注文を付けています。
▽「革新的な効能・効果の追加承認」があった新薬について、薬価収載後にも新薬創出・適応外薬解消等加算(以下、新薬創出等加算)の対象とする(以後、薬価が一定程度維持されることになる)
▽薬機法改正を受け、特定用途医薬品は新たな加算で評価(5-20%の加算)し、先駆的医薬品については従前の「世界に先駆けた日本での開発」としての評価(10-20%の加算)を継続する(項目の名称修正)
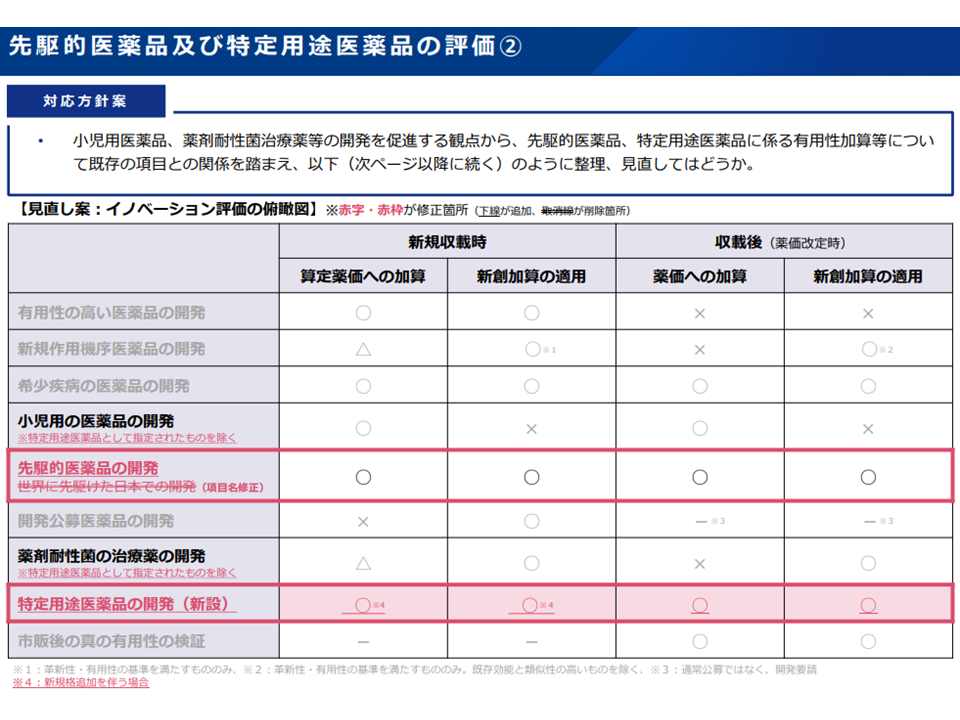
特定用途医薬品について新たに加算で評価する(中医協・薬価専門部会1 211201)
また(2)では、次の2項目の改革案が提示されています。ここにも特段の異論・反論は出ていません。
▽新薬創出等加算における企業指標について
・新たに特定用途医薬品の開発状況(過去5年)を評価する
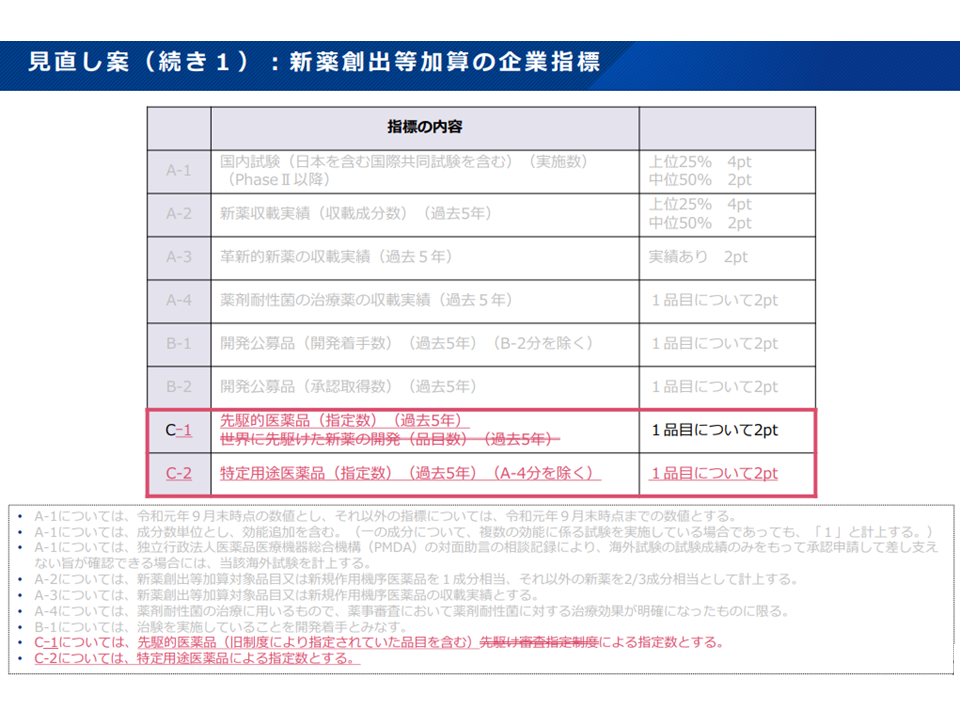
特定用途医薬品の開発状況を、新薬創出等加算の企業指標の評価対象に加える(中医協・薬価専門部会2 211201)
・新薬開発等の実績が低く、新薬創出等加算が0.8倍に低く設定される企業区分IIIについて、現在は「最低点数の企業」としているルールを、「2ポイント以下の企業」へと厳格化する(2021年度データをベースにすると、現行ルールでの企業区分III対象は8社だが、新ルールでは14社となる)
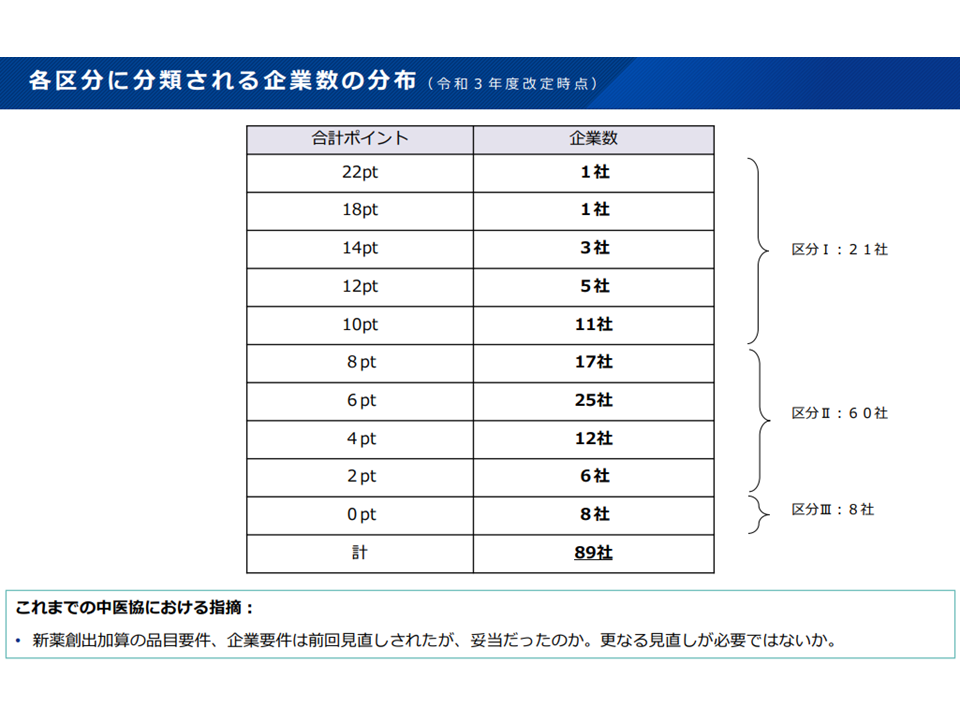
製薬メーカーの実績ポイント獲得状況(薬価専門部会9 211020)
▽長期収載品の薬価の更なる適正化を図るため、「段階的引き下げのスピードアップ」などを検討する
一方、(3)に関しては次の4項目の見直し案が示されています。
(a)安定確保医薬品のうち優先度が高い品目(カテゴリAに分類されている品目)について価格の下支えなどの工夫を行う
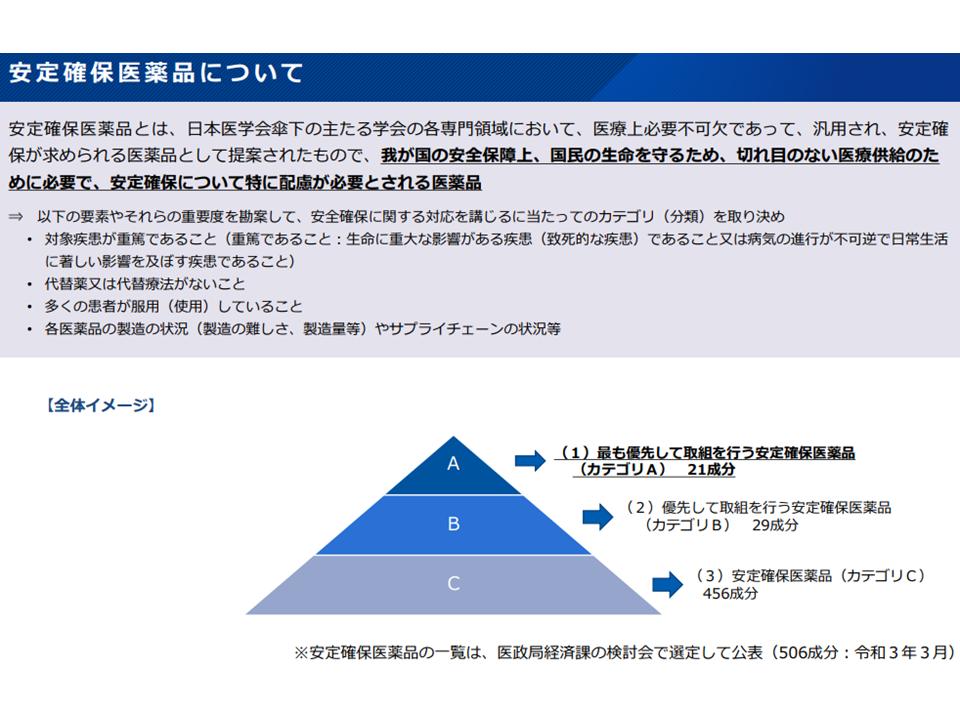
医学会の提唱する安定確保医薬品の概要(薬価専門部会10 211020)
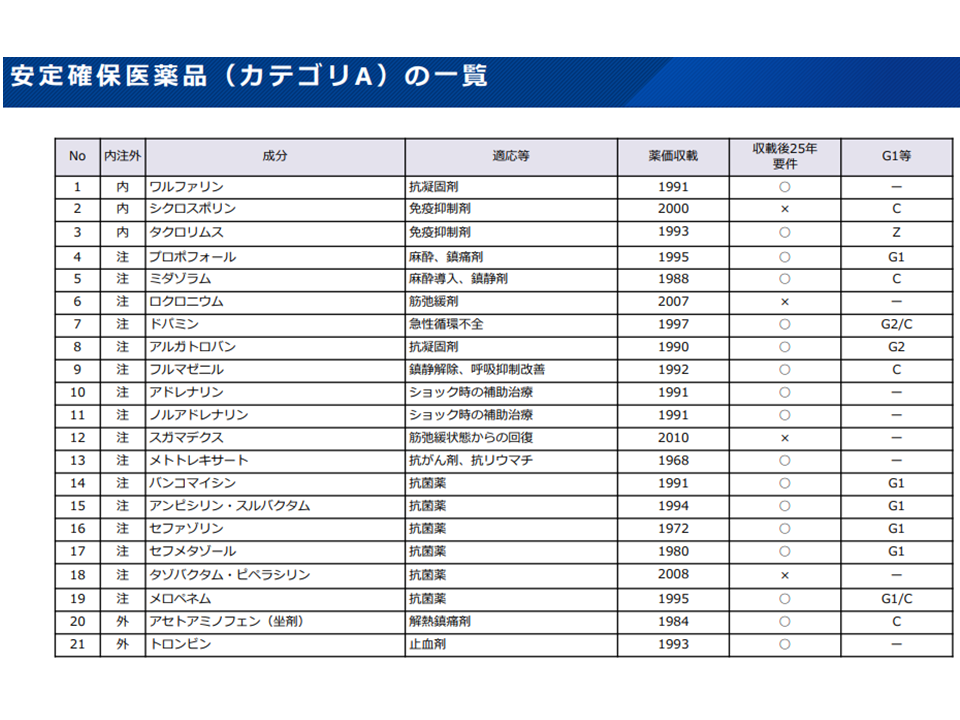
安定確保医薬品カテゴリA対象21成分(薬価専門部会11 211020)
(b)原価計算方式における製造原価の開示度向上を目指し、例えば開示度50%未満の場合の加算係数(開示度が低い場合には加算が小さくなる)について、現在「0.2」(つまり加算が20%に減額される)から「ゼロ」(つまり加算を付けない)に見直すことなどを行う
(c)市場拡大再算定の特例対象品目(年間販売額が極めて大きく(1000億円超、1500億円超)、予想よりも市場が大きくなるケース)および類似品について、再算定(価格引き下げ)から3年間は他品目の市場拡大再算定の類似品としての対象外とする
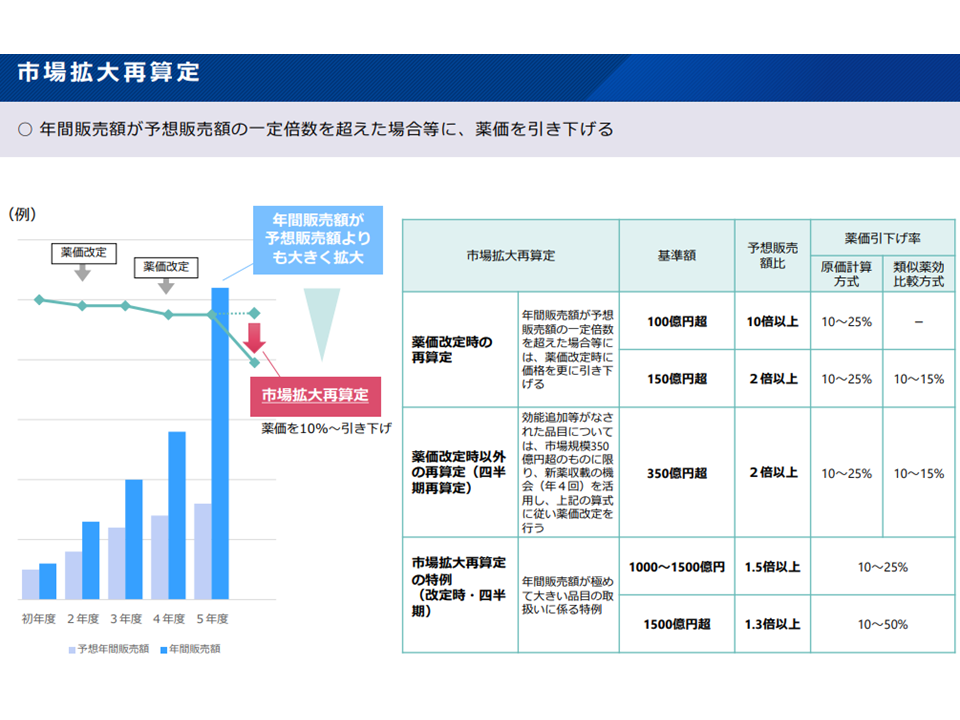
市場拡大再算定ルールの概要(薬価専門部会12 211020)

市場競合性を確保するため、市場拡大再算定対象の類似薬が再算定対象となることもある(薬価専門部会13 211020)
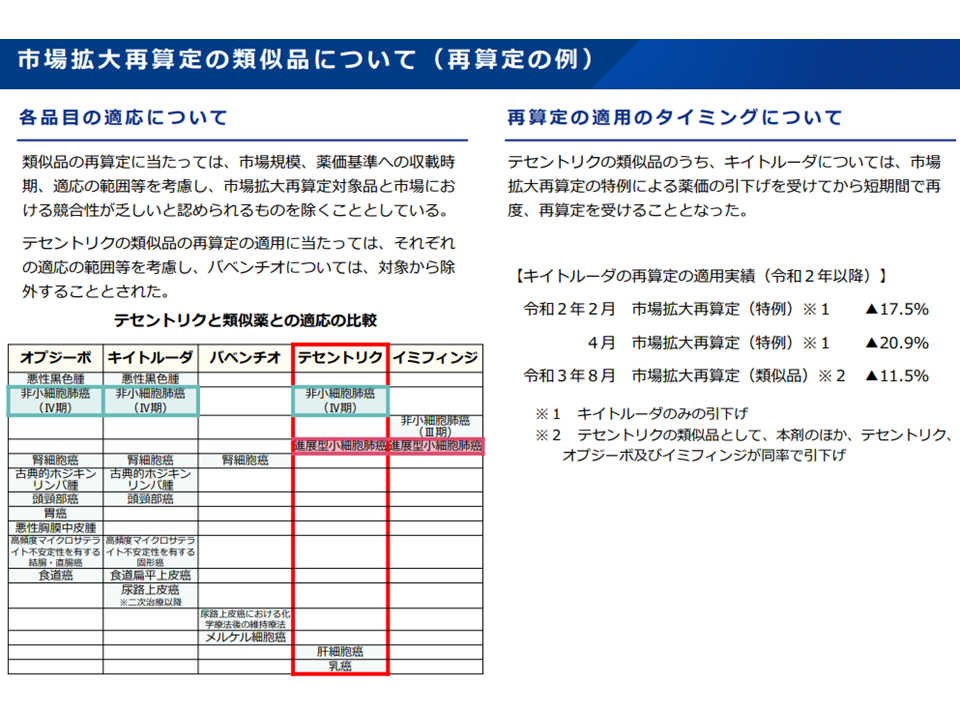
市場拡大再算定ルールにより短期間に繰り返し再算定を受けるケースもある(薬価専門部会14 211020)
(d)リポジショニング特例(「組成・投与形態が同一で効能・効果が異なる既収載品がある新薬」について、「類似薬がある場合でも原価計算方式によって算定される額を当該新薬の薬価とする」との特別ルール)の取り扱いについて、例えば「未承認薬検討会議の議論を踏まえ開発公募された品目」などを対象から除外する
この見直し方向については、12月3日に業界サイドから多くの異論・反論が出されています。例えば(b)について製薬メーカーサイドは「原価の開示は促進していく」としたうえで「開示度50%未満の場合の加算係数をゼロとするとことは、すなわち『有用性、革新性が認められて加算での評価を行う』こととなったものを『その有用性、革新性を認めない』と判断しなおすことと同じである。これでは革新的医薬品の開発が進まなくなってしまう」と猛烈に反発。実際に、原価開示度が50%未満であるが革新性の高い医薬品として、▼同種造血幹細胞移植患者におけるサイトメガロウイルス感染症の発症抑制に用いる「プレバイミス」▼遺伝性血管性浮腫の急性発作抑制に用いる「オラデオカプセル」などを例示し、「企業の優れた医薬品開発に向けたモチベーションを下げないでほしい」と求めています(原価計算方式となる新薬の7割で加算が付与されている)。
あわせて製薬メーカーサイドは、「開示度の区分をより細かくし、例えば開示度20%未満の場合にはより小さな加算係数(例えば0.1など)を設定することなどを検討してはどうか」との代替案も提示しています。
また(c)については、「一度、市場拡大再算定の特例等の対象となった医薬品について、一定期間、類似品対象外とする」という方向そのものは歓迎しましたが、「除外期間が短すぎる。これまでの市場拡大再算定特例の対象となった品目の平均薬価引き下げ率は25.6%であり、平均的な薬価改定率6.0%(2020年度には全体平均で約6%(乖離率8.0%から調整幅2%を除外))に比べて厳しい。引き下げによる減収を企業努力で埋めるためには一定の時間が必要であり、せめて通常改定2回分、つまり5年間の猶予(類似品対象外)としてほしい」と要望しました。
今後、こうした意見も踏まえて最終案を厚労省で練っていくことになります。
また(4)では、次のような見直し案・方向性が浮上しています。
▽基礎的医薬品の改定ルールについて、例えば「一度、基礎的医薬品から外れた品目が再度基礎的医薬品の要件を満たす場合には、基礎的医薬品に復活するものの、それ以外の基礎的医薬品まで価格を上げず、原則、その際の薬価に維持する」などの見直しを行う
▽新規後発品の薬価については、現行の「先発品薬価の50%」などのルールを維持する
▽今後「年間1500億円超の市場規模となる医薬品」が薬事承認された場合には、通常の薬価算定の手続きに先立って、まず中医協において「当該品目の承認内容や試験成績などに留意しつつ、薬価算定方法の議論を行う」こととする
また、「調整幅をどう見直していくか」「診療報酬改定がない年の薬価改定の適用ルール等の在り方」なども議論の俎上に上がっています。この点、製薬メーカー・卸サイドは「新型コロナウイルス感染症が収束しない中で、医薬品流通の混乱は続いている。2021年度改定と同様に『調整幅+一定幅』といった措置を行ってほしい」と要望しています。2021年度に行われた初の中間年改定では、コロナ感染症の影響を踏まえて、実勢価格を踏まえた薬価見直しについて、通常の「実勢価格+調整幅(2%)」ルールを「実勢価格+調整幅(2%)+一定幅(0.8%)」に緩和しました。通常よりも薬価の下げ幅が「0.8%小さくなる」特例ルールです。2022年度の薬価改定でもこうした特例を行うのか、今後の調整に注目が集まります。
【関連記事】
市場規模が数千億円に上るような医薬品の登場を見据え、新たな価格調整ルールを検討すべきか―中医協・薬価専門部会
2022年度薬価改革、効能評価の整合性確保・原価開示の促進・市場拡大再算定の不合理解消など進める―中医協・薬価専門部会
2022年度薬価改革に向け、新薬創出等加算の拡大、原価開示促進方策など検討―中医協・薬価専門部会
特許期間中は薬価を維持する仕組みを構築することで、日本国内での新薬開発が活性化―中医協・薬価専門部会
2022薬価改定、新規後発品の価格設定ルール・原価計算方式の在り方・イノベーション評価などが重要論点―中医協・薬価専門部会





