プログラム医療機器のコスト評価ではコスト情報開示が大前提、市販後の有用性データ収集に資する仕組みが必要—プログラム医療機器ワーキング
2023.5.31.(水)
プログラム医療機器(SaMD)の経済的評価(材料価格の設定、技術料の設定)を考えるにあたっては、「研究開発コストの評価が求められるが、その前提としてコスト情報の開示が必要ではないか」「2段階評価を行う場合に、有用性データを収集しやすくする仕組みの1つとして保険外併用療養の活用などが考えられるのではないか」「医師働き方改革への貢献については、メリットと評価の仕組みをシッカリ整理して考えていく必要があるのではないか」—。
5月30日に開催された「プログラム医療機器等専門ワーキンググループ」(以下、ワーキング)でこういった議論が行われたことが、厚生労働省保険局医療課医療技術評価推進室の中田勝己室長から明らかにされました。
今夏(2023年夏)頃を目途に、プログラム医療機器の評価の在り方をワーキングで整理
プログラム医療機器とは、アプリケーションや人工知能(AI)を活用した「疾病の診断・治療」を目的とする機器で、例えば、2020年11月には「禁煙治療を補助するアプリケーション」の保険適用が認められています(関連記事はこちらとこちら)。
すでに2022年度の医療材料価格制度改革の中でも「保険適用等の予見可能性を高める」「医師の負担が軽減されるのであれば、技術料の施設基準を緩和する」などの方向が固められていますが、今後、技術の進展によりプログラム医療機器が数多く開発され、保険診療の中でも活用されていくと考えられることから、2024年度の次期診療報酬改定に向け、中央社会保険医療協議会・保険医療材料等専門組織(保険医療材料の機能区分や償還価格などの原案を作成する専門家の集まる)の下に「プログラム医療機器等専門ワーキンググループ」を設置し、▼プログラム医療機器等の評価に関する技術的な事項▼プログラム医療機器等のチャレンジ申請(使用実績を踏まえ、より償還価格の高い機能区分への再評価を求められる仕組み)の評価の妥当性に関する事項▼プログラム医療機器等に関する技術的な助言—などを検討しています(関連記事はこちら)。
これまでに業界サイドからの意見聴取が行われ、主に(1)診療報酬上の評価における基準・予見可能性を明確化すべき(2)二段階承認の仕組みと連携した評価を行うべき(3)プログラム医療機器の特性に応じた再評価の仕組みを設けるべき(4)医科向けプログラム医療機器の「診療以外の分野」での活用を推進すべき—といった意見が出されています(関連記事はこちらとこちら)。
5月30日のワーキングでは、こうした業界意見も踏まえた意見交換が行われました。
まず、(1)の「診療報酬上の評価における基準・予見可能性を明確化」に関しては、次のような考え方が委員から出されています。
【有用性に対する評価】
▽疾病「治療」用プログラムと疾病「診断支援」用プログラムとでは、目的や使用形態などの性質が異なるため分けて検討する必要がある
▽個々のプログラム医療機器の性質に基づく一定の基準により、「特定保険医療材料での評価」「技術料への加算」「既存の技術料への包括」「施設基準の緩和等」のいずれの形式で評価されるかを、より具体的に整理していくべき
【医療の質の均てん化等への評価】
▽臨床上の有用性を含め、どのような観点で評価が行われるのかを明確化していくことが重要
【プログラム医療機器特有のコスト構造の評価】
▽安定供給の観点からもコスト構造を考慮する必要があるが、そのためには「企業においても製品毎のコストや収支などをより開示」していく必要がある
プログラム医療機器に限らず、メーカーサイドには「どのような機能を持つ製品を開発すれば、どの程度の評価が得られるのか(どの程度の収益を見込めるのか)」が一定程度明確になっていなければ研究・開発の推進が難しくなるという思いがあります。多大なコストをかけて製品を開発したが、想定よりもはるかに低い評価(収益)しか得られなかった、という事態が生じれば、「後の優れた製品の開発」に支障が出ることとなり、メーカーにとっても、国民にとっても、医療者にとっても不幸です。このため可能な限り「評価の基準や考え方などを明確化していく」ことが求められます。
また、「コスト倒れ」にならないよう、開発コストに対する評価も適切に行われる必要がありますが、そのためには委員が指摘するように「コスト情報の開示」が前提となるでしょう。開発コストなどは企業秘密に関連する部分も多くなりますが、可能な範囲での情報開示に期待が集まります。
また、(2)の二段階承認は、プログラム医療機器の開発に長期間がかかることを踏まえ、▼「有効性の推定」をもって第1段階承認を行う、これによりプログラム医療機器が広く臨床現場で使用され、データ収集をしやすくする▼「実臨床での有効性評価」をもって第2段階承認(本承認)を行う—というものです。厚生労働省で具体的な制度設計に向けた検討が進められ、「プログラム医療機器の特性を踏まえた適切かつ迅速な承認及び開発のためのガイダンス」として公表されます。
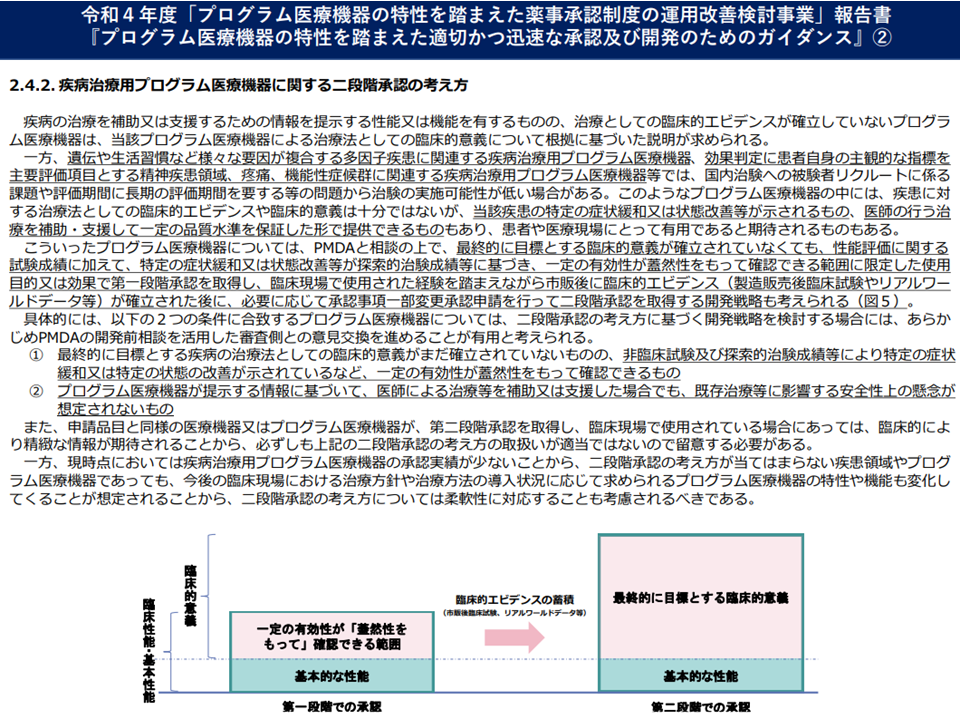
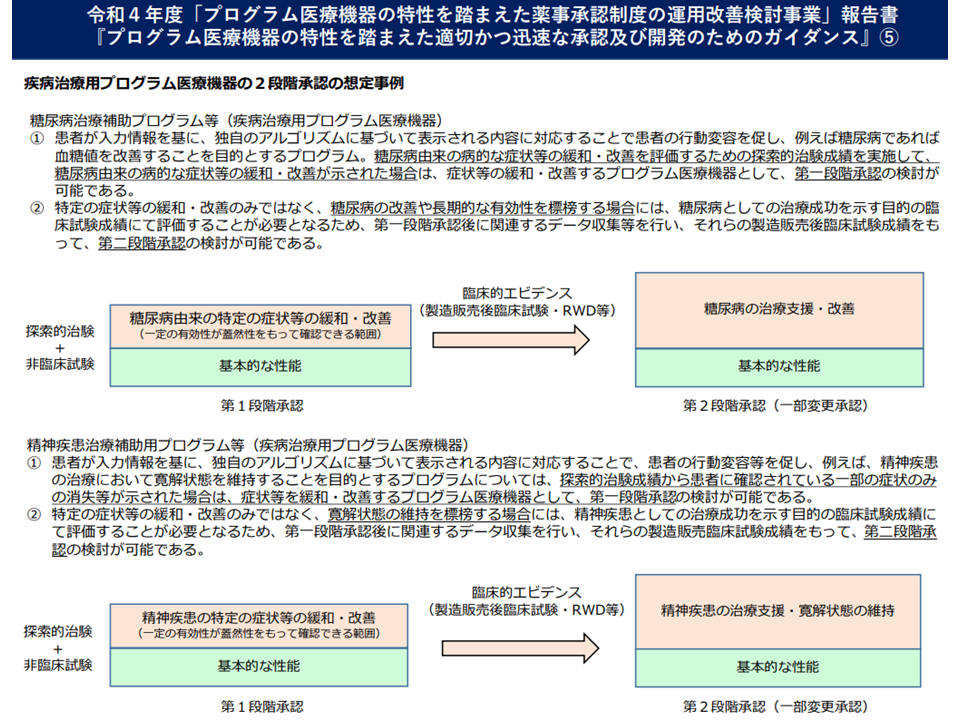
例えば「疾病治療用プログラム医療機器」には、▼疾患の特定の症状緩和、状態改善等が示される▼医師の行う治療を補助・支援して一定の品質水準を保証した形で提供できる—ものが該当します。この治療用プログラム機器において、「最終的に目標とする疾病の治療法としての臨床的意義」は確立されていないものの、「非臨床試験・探索的治験成績等により特定の症状緩和、特定の状態の改善が示されているなど、一定の有効性が蓋然性をもって確認できる」「プログラム医療機器が提示する情報に基づいて、医師による治療等を補助、支 援した場合でも、既存治療等に影響する安全性上の懸念が想定されない」場合には「第1段階評価」が行われます(薬機法上の第1段階承認を得られる)。その後、上市されて広く医療現場で使用される中で「エビデンス(製造販売後臨床試験やリアルワールドデータ等)が確立」された後に、必要に応じて第2段階承認(承認事項の一部変更承認)を受けることになります。

2段階承認について(1)

2段階承認について(2)
2段階承認について(3)
2段階承認について(4)
保険診療上の評価も「第1段階」→「第2段階」と順を追って行うことが考えられますが、第1段階では「有用性のデータ」などが十分にそろっていないため「低い評価」(低い価格、低い加算等)にならざるを得ません。
メーカーサイドは、この点について「低い評価」を行うのではなく、「保険外併用療養費制度」の活用を求めています(関連記事はこちら)。例えば、第1段階時点では「当該プログラムにかかる部分は自由診療(患者の全額自己負担)+他の医療部分は保険診療」とすることなどが考えられるでしょう(先進医療や患者申出療養などと類似する仕組み)。
この点について委員からは、「メーカーサイドからは『第1段階承認を受けたとしても、第2段階承認に向けたデータ収集コストは小さくならない』との声が出ており、第1段階承認後にデータ収集しやすくなる仕組みを考える必要がある」、「保険外併用療養とすることで、『患者の負担を抑えながら、当該プログラム機器の活用を促進する』環境が整えられると考えられる」、「ただし、保険外併用療養とする場合には、漫然とした利用を認めることはできず、必要な期間(第2段階承認に向けたデータ収集に必要な期間)を設定しなければならない」という意見が出ています。
例えば、「X年に限って第1段階承認を認め、保険外併用療養の対象とする」(当該機器は患者の自己負担、他の診療部分は保険使用(1-3割負担)可)→「X年の間に流通を図り、データ収集を進める」→「有用性のエビデンスが認められれば第2段階承認する(保険診療の中に正式に組み込む)」といったイメージが考えられます。
なお、この場合、X年の間に有用性エビデンスが構築されなければ「保険適用されない」(評価療養制度を漫然と継続することは認められないため)こととするのか?「低い評価で保険適用する」のか?などの詳細をさらに詰めていくことが必要になりそうです(後述する選定療養とも関連する)。
他方、(3)は、「上市後のドデータ活用によりプログラムのアップデート等がなされ性能が向上する」場合などには、再評価(向上した性能に基づく高い評価)を柔軟に行う仕組みが考えられないか、という朗点です。
この点、すでに「医療技術評価分科会による評価」や「チャレンジ申請」といった仕組みがありますが、前者には「2年に一度しか再評価のチャンスがない」といった課題、後者には「事前の申請が求められ、再評価は1回しかなされない」といった課題があり、メーカーサイドは「事後に再評価申請を複数回行える柔軟な仕組み」を求めています(関連記事はこちら)。
委員は、この提案に対し「イノベーションの評価を推進する観点からも、プログラム医療機器の特性を踏まえ、チャレンジ申請のほか、その他の制度の活用も含めた再評価のあり方について検討が必要」と前向きな姿勢を見せています。既存の仕組みを見直すのか、新たな仕組みを設けるのかなども含め、さらに議論が続けられます。
また、(4)では、「保険診療における適用期間が終了した後も、患者の希望に基づく継続使用のニーズに対して、保険診療外で使用できる仕組みの検討が必要ではないか」「保健指導に用いる場合や患者自らの選択で用いる場合など医療機関による診療以外の場面における活用も期待でき、それらを推進する方法を検討する必要がある」などの意見が出ています。
前者は、例えば、すでに保険適用されている「高血圧アプリ」について、「保険診療の中では6か月間という使用制限があるが、患者が『6か月以降も使用したい』と希望する場合に選定療養(当該アプリ使用部分は自己負担、他の通常診療部分は保険診療)として使用継続を認めてはどうか」といったメーカーの提案内容を踏まえた意見です。上述(2)の「第2段階承認のための有用性エビデンスが構築できなかった場合」にも通じる論点と言え、今後、詳細を煮詰めていくことになるでしょう。
なお、メーカーサイドは「プログラム医療機器の活用は診療時間の短縮など、医師働き方改革に大きく関連する」ことを強調しています。
この点については、すでに「施設基準の緩和」で対応の対応がなされています。例えばプログラム医療機器の活用で医師の負担軽減が認められる場合には、「専門技術を持つ医師の配置数を一定程度少なくしてよい」などの施設基準緩和が可能となるのです。
ただしメーカーサイドは、それを超えた「経済的評価」の必要性を強く訴えています(関連記事はこちらとこちら)。
この点については、委員から「プログラム医療機器の活用が例えば医療安全や医療の均てん化などに資するとして、それが『個々の患者のメリット』となるのか、『医療機関全体のメリット』となるのかなどを整理したうえで、どのようなメリットがあり、どのように評価していくべきか(加算などを行うべきか、施設基準緩和を行うべきか)などを考えていく必要がある」との指摘がなされたことが中田医療技術評価推進室長から報告されました。
ワーキングでは今後も議論を続け、夏頃(7月目途)に意見をまとめる予定です(その後、中医協で具体的な制度設計議論に入る)。
【関連記事】
プログラム医療機器の経済的評価、「コストの明確化」「追加データに基づく再評価」などが重要論点—プログラム医療機器ワーキング
プログラム医療機器活用による「医療従事者の負担軽減」などの要素を診療報酬等で評価すべきか—プログラム医療機器ワーキング
コロナ禍で「2020年度にDPC病棟等の在院日数が延伸してしまった」が、21年度には再び「短縮」—中医協総会(2)
プログラム医療機器、有用性や医師負担軽減効果踏まえた施設基準緩和等の考え方明確化―中医協・材料専門部会





