1回分1496万円の脊損機能改善薬を保険収載、近く超高額な白血病等治療薬の保険収載も―中医協総会(2)
2019.2.21.(木)
脊髄損傷に伴う神経症候および機能障害の改善を効能・効果とする再生医療等製品「ステミラック注」(1回分、1496万7555円)を保険収載(薬価収載)する―。
2月20日に開催された中央社会保険医療協議会・総会では、こういった点も了承されています。
極めて高額であり、最適使用推進ガイドラインおよび、保険診療上の留意事項通知も発せられます。

2月20日に開催された、「第409回 中央社会保険医療協議会 総会」
効果的な治療法のない外傷性脊損患者の機能改善が期待される
ステミラック注は、「患者本人から採取した骨髄液中の間葉系幹細胞」を体外で培養して増殖させた再生医療等製品です(点滴で静脈内に投与する)。
国内治験において、「外傷性脊髄損傷(ASIA機能障害尺度がA、BまたはC)の患者13例中、12例でASIA機能障害尺度が1段階以上改善する」との結果が示されました。外傷性脊髄損傷に対して、効果的な治療法はないため、本製剤の有効性に期待して、中医協が保険収載を認めたものです。
ただし、保険償還価格が「1回分、1496万7555円」と極めて高額なため(患者本人の幹細胞を採取・培養することから、必然的に高額となる)、安易な使用は医療保険財政に大きな影響を及ぼしてしまいます。そこで、厚生労働省は、保険収載に合わせて「最適使用推進ガイドライン」と「保険診療上の留意事項通知」を示すこととし、医療現場における適正使用を促します。

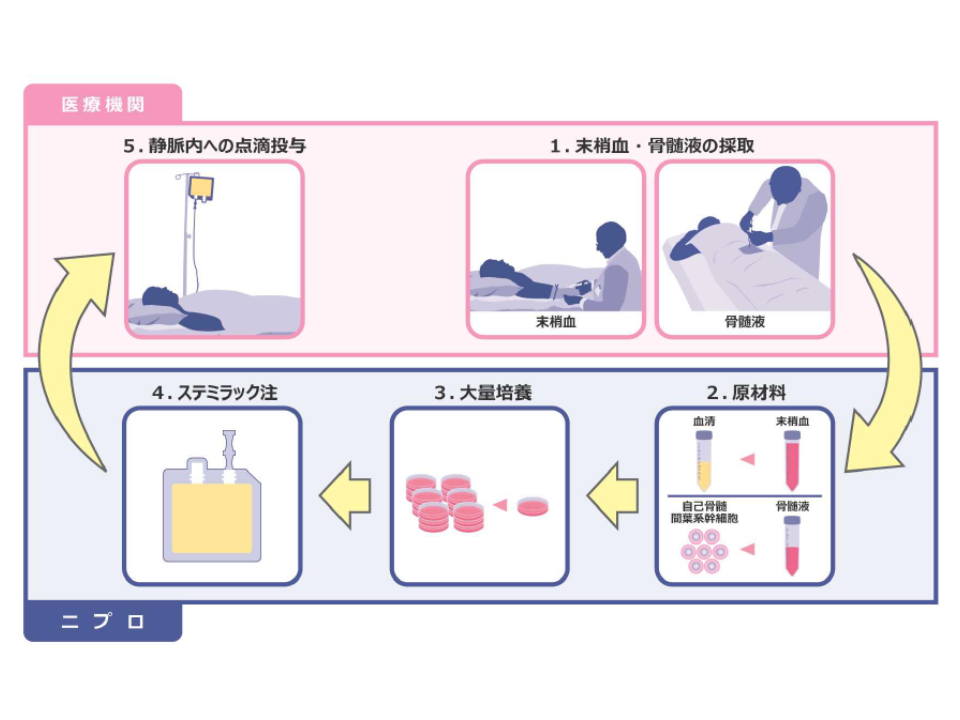
最適使用推進ガイドラインでは、ステミラック注を用いた治療について▼実施可能な施設▼対象患者▼留意事項―などが整理されています(ガイドライン案はこちら(厚労省サイト、中医協資料))。
施設については、まず▼安全かつ清潔に骨髄液・末梢血の採取が可能である▼悪性腫瘍検査が自施設・連携施設で実施可能である▼脊損患者の全身管理が可能なICU等を有している▼ICUの早期離床・リハビリテーション加算(または一般病棟のADL維持向上等体制加算)・脳血管疾患等リハビリ料(I)・運動器リハビリ料(I)の施設基準をすべて届け出て、脊損患者への標準的なリハビリ実施が可能である▼回復期リハビリ病棟1の届け出または連携により、脊損患者への標準的回復期リハビリが実施可能である▼レジストリへの患者登録などを実施可能である―ことが求められます(すべて満たさなければならない)。
さらに、外傷性脊損の診断・治療・不具合・副作用発現時の対応に十分な知識と経験を有し、メーカーの実施する「本品使用にあたっての講習」を修了した医師を治療責任者として配置することが必要です。具体的には、医師免許取得の後、「脊髄領域を含む整形外科に関する10年以上の修練」または「脊髄領域を含む脳神経外科に関する10年以上の修練」を行い、脊損の十分な臨床経験(計30件以上)を有し、AIS評価が適切に行える医師が、講習を修了していることが求められます。
必要な施設基準(早期離床・リハビリテーション加算など)を満たしていること、治療責任者となる医師が必要な要件(修練期間など)を満たしていることは、保険診療上の留意事項としても記載されます(通知案はこちら(厚労省サイト、中医協資料))。
このほか、▼再生医療等製品に関する情報管理体制の整備▼副作用・不具合が生じた場合の体制整備―も必要となります。
また投与対象となるのは、「AISがA、BまたはCの外傷性脊髄損傷患者」です。「本品の成分(添加剤)に対し過敏症の既往歴のある患者」は「禁忌」、以下の患者では「他の治療選択肢がない場合に限り、慎重投与を考慮できる」とされています。
▽悪性腫瘍の合併また既往のある患者
▽アレルギー素因のある患者
▽凝固能が亢進している患者
▽感染症を合併している患者
▽体重が低い患者(特に小児)や貧血の患者
▽全身状態が極めて不良な患者(例:内分泌代謝疾患、循環器疾患、呼吸器系疾患、消化器系疾患、重度の多発性外傷、多臓器障害など)
▽重度の頭蓋内病変、主要血管の高度狭窄、解離性大動脈瘤、強い動脈硬化性変化、重度の石灰化等が認められる患者
▽重度の脊髄・脊椎疾患(骨粗鬆症、脊髄腫瘍、脊髄血管奇形、脊髄空洞症など)を認める患者
▽血圧を「収縮期140mmHg以下、拡張期90mmHg以下」にコントロールできない患者
再生医療等製品の性質から価格は高額に、近く超高額な白血病治療薬も保険収載へ
現在、ヒトや動物の細胞等を利用した「再生医療等製品」の保険収載については、▼医薬品に近いと考えられる場合には、薬価算定ルールに沿って価格案を設定する▼医療材料に近いと考えられる場合には、材料価格算定ルールに沿って価格案を設定する―ことになっています。本剤は、医薬品に近いと判断され、薬価算定ルールに沿って価格案が設定されました(関連記事はこちら)。
再生医療等製品では、類似品がないケースが多く、その場合、原価計算方式で価格案を設定することになります。また本製剤のように「患者個々人の幹細胞を採取し、培養する」製品では、どうしても高コストとなり(原価が高くなる)、高額な保険償還価格が設定されます。この点、支払側の幸野庄司委員(健康保険組合連合会理事)は「原価計算方式の採用が妥当なのか。再生医療等製品の特性を踏まえた価格設定ルールが必要なのではないか」とコメント。
厚労省保険局医療課の田宮憲一薬剤管理官は、この考えに対し、「再生医療等製品の事例を積む中で、再生医療等製品に特化した価格算定ルールを検討していくことになろう」と見通した上で、「製品の安定供給も考えなければならない」とし、「低価格となることだけを目指すルール設定」には慎重な考えを示しています。
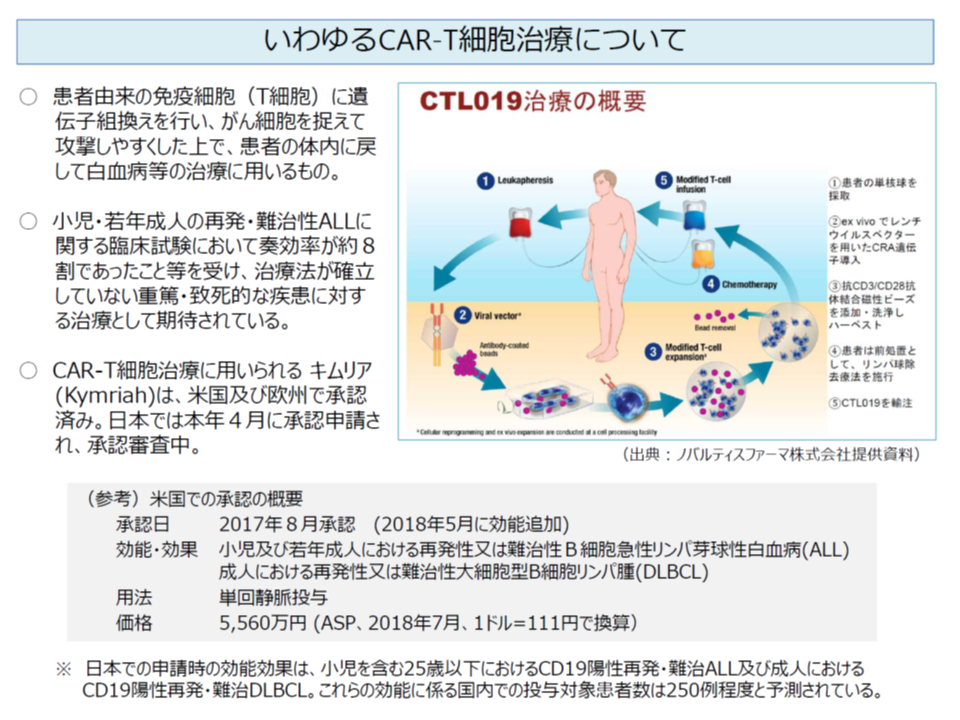
なお、同日の薬事・食品衛生審議会「再生医療等製品・生物由来技術部会」では、白血病治療等に用いる再生医療等製品「キムリア点滴静注」(我が国初のCAR-T細胞治療、米国では奏効率8割との優れた臨床試験結果が示されている)の製造販売が了承されています。早ければ5月にも保険適用が見込まれますが、価格は極めて高額(米国の高齢者向け医療保険制度MediCareでは5560万円の償還価格が設定されている)になると見込まれています。優れた医療技術の登場は、患者・国民にとって何よりも喜ばしいことではあるものの、「医療保険制度の維持という視点で、超高額医薬品等をどう考えていくか」がさらに大きな課題となってきそうです(関連記事はこちら)。
【関連記事】
医薬品等の価格設定における「費用対効果評価」の概要固まる、2019年4月から実施―中医協総会(1)
白血病等患者の治療法選択を補助する新たな遺伝子検査を2月から保険収載―中医協総会





