医療用医薬品の広告・説明、「事実誤認の恐れがある表現」などが散見される―厚労省
2018.5.14.(月)
医療用医薬品の広告や説明(以下、広告)について、昨年度(2017年度)の5か月間、調査をしたところ67件の違反が疑われる事例があった。最も多いのは「事実誤認の恐れのある表現」を用いた広告で、違反全体の4割強を占めている。ほか「事実誤認の恐れのあるデータ加工を行った」広告や、「未承認の効能効果や用法用量を示した」広告も目立つ―。
厚生労働省が5月12日に公表した「医療用医薬品の広告活動監視モニター事業報告書」から、こういった点が明らかになりました(厚労省のサイトはこちら(概要版)とこちら(報告書))。
2017年度中の5か月調査で、67件の不適切な広告・説明
「臨床研究の不正事案」(高血圧症治療薬での臨床試験データ操作や、製薬メーカーによる臨床試験への極めて深い関与など)への反省から、医療用医薬品広告の適正化が求められ、その一環として「医療用医薬品を対象とした広告活動監視モニター制度」が構築されました。
具体的には、▼全国の医療機関の中からモニター医療機関を選定し、「医療用医薬品について製薬企業から適切性について疑義のある広告資材や情報提供活動等を受けた」場合に、報告をお願いし、その広告内容を精査する(医療関係者向け広告活動に関するモニター調査)▼医療関係者向けの専門誌・学会誌、製薬企業ホームページ、医療関係者向け情報サイトを対象に、不適切な広告がないかを調査する(医学専門誌・製薬企業ホームページ等に関する調査)—ことを通じ、不適切事例に対する行政指導を行ったり、業界に自主規制の改善を依頼したりするものです。
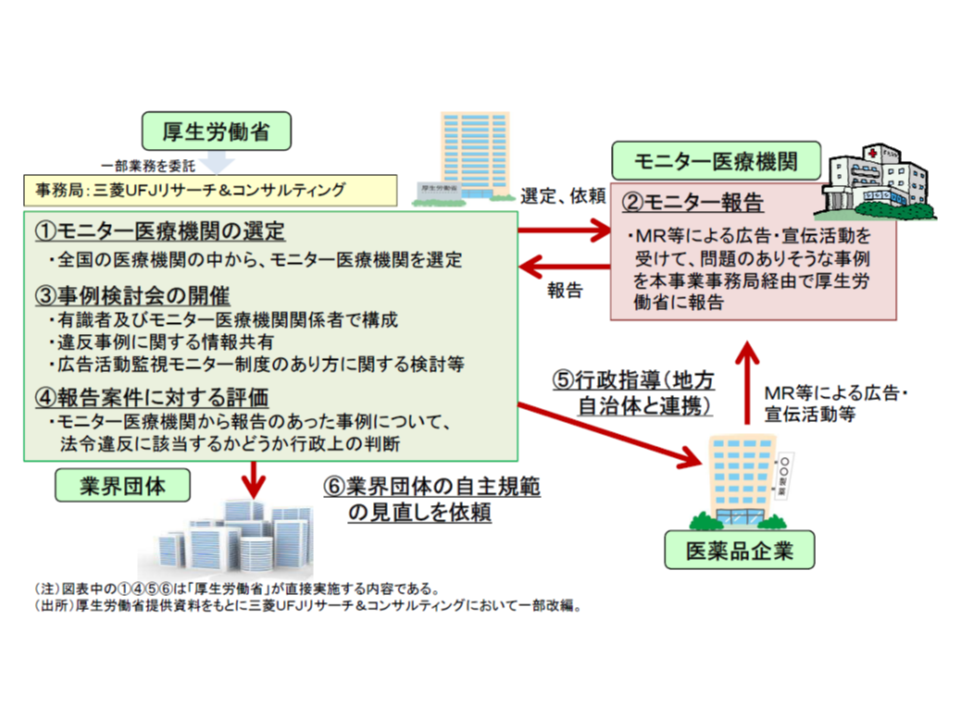
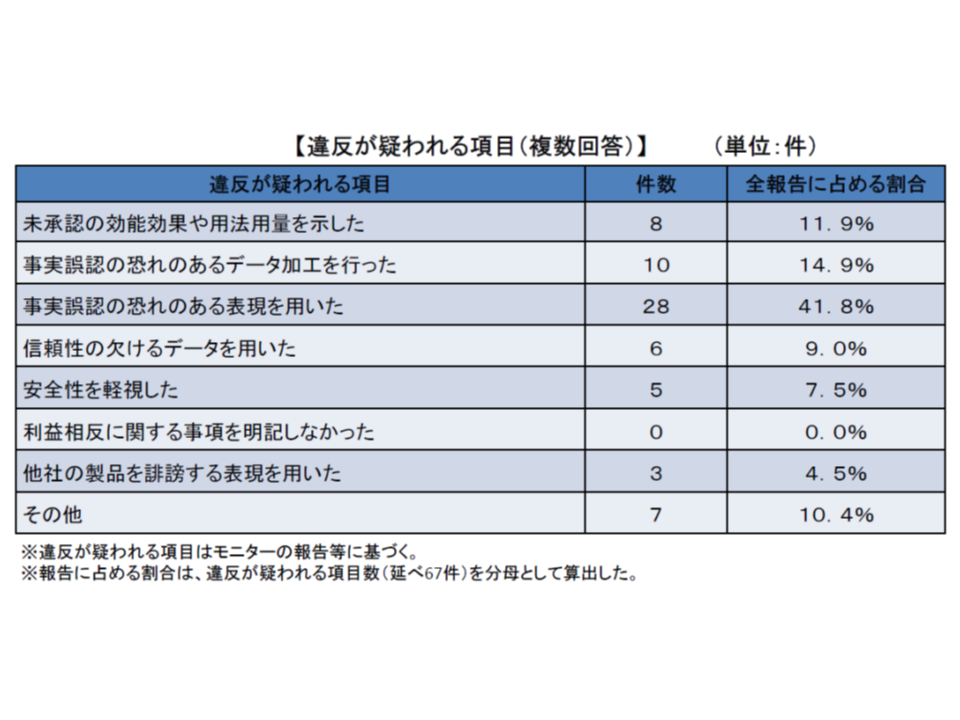
昨年度(2017年度)には、5か月間の調査期間中に、延べ52医薬品等について適切性に関する疑義報告があり、延べ67件の違反が疑われる項目が見つかりました。ただし、健康被害への重大性・悪質性等の観点から「ただちに取締を実施する」までの明白事例は幸いありませんでした。
67件の違反項目の内訳は、「事実誤認の恐れのある表現を用いた」広告が28件・41.8%と最も多く、次いで「事実誤認の恐れのあるデータ加工を行った」広告(10件・14.9%)、「未承認の効能効果や用法用量を示した」広告(8件・11.9%)、「信頼性の欠けるデータを用いた」広告(6件・9.0%)、「安全性を軽視した」広告(5件・7.5%)、「他社の製品を誹謗する表現を用いた」広告(3件・4.5%)、「その他」(7件・10.4%)となっています。
厚労省は不適切な広告について、メーカー名・製品名を伏せた上で例示しています。
例えば、ある便秘関連治療薬について、メーカーのMRは医師に対し「将来的に既存薬剤に置き換わる製品で、便秘症治療薬の第一選択薬になると考えられる」、「海外での適応は日本よりも広い」、「便秘を訴える患者に広く使用可能である」と伝えるなどしており、「承認外の効能効果をほのめかす発言が多く見られ、不適切である」とされています。
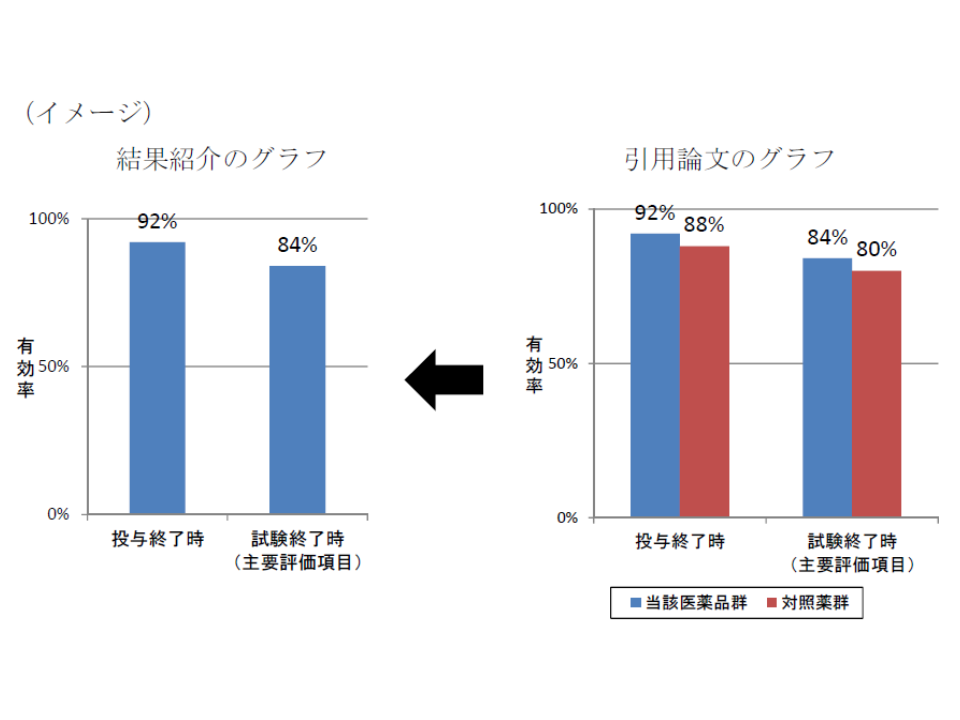
また、ある抗がん剤について、MRが薬剤部にプレゼンテーションを行った際、臨床試験結果であるPFS(無増悪生存期間、Progression Free Survival)のグラフに、インタビューフォームと製品情報概要には記載のない「補助線」を追加し、「対照薬群と比較して有意にPFSを延長した」という趣旨の文章がありました。しかし、科学的に明確な理由はなく「細部を注意深く見なければ、有効性を過大に評価しかねない」内容であり、「誇大で不適切である」と判断されています。
さらに、ある抗菌薬について、MRによる資料・メーカーホームページの臨床試験結果紹介において、「引用論文には記載のあった対照薬の結果が削除されており、当該製品の効果・安全性を正確に評価できない」ものとなっていました。不適切なデータ加工であると判断されています。
一方、ある利尿薬について、製品情報概要に「80歳未満と80歳以上で全有害事象および重篤な有害事象は変わらなかった」との照会がありました。しかし、80歳以上では「高ナトリウム血症」のリスクが高いことが引用文献などにも記載されており、「製品情報概要の見直しだけでは、安全性について誤認する恐れがある。誇大な表現である」と判断されています。
また、ある潰瘍性大腸炎治療薬については、MRが製品説明会の場で「副作用発現症例数は全体の10%程度」と説明。しかし、添付文書では「約55%に副作用が発生」との記載があり、パンフレット・スライドでは「添付文書で主な副作用として記載されている事例については、盲検性の点で医師に開示しなかったため、有害事象の評価対象外とした」と注釈がありました(この点についてはMRからの説明なし)。これらを含め「安全性を軽視している」と判断されています。
対象薬との「差」を大きく見せるような加工や、事実誤認の恐れある表現は不適切
こうした事例をもとに、報告書では「製薬メーカーによるプロモーション」における不適切な事例・行動を次のようにパターン化しています。端的に言えば、「次のようなプロモーションは不適切」と判断され、内容によっては行政指導などの対象になることがあります。
【MRによる不適切な口頭説明の例】
○承認範囲外の効能効果や用法用量をほのめかす説明
▽「日本の効能効果は限定的だが、海外では○○も効能効果として認められている」などの海外での効能効果を紹介
▽「今後は日本でも○○が効能効果に認められるだろう」などの効能効果拡大の示唆
▽「(成分○○が過剰となる副作用の医薬品で)○○の上昇が期待できる」など、副作用を効能効果のように紹介すること
▽「適応外だが○○という使い方であれば査定されない」など、レセプト審査で査定されにくい用法用量の紹介
○効能効果や安全性等を誇大に見せる説明
▽「他院では○○と評判である」などといった、科学的根拠のない、伝聞調での紹介
▽「自社では○○な医薬品を製造しているので、この製品も○○である」とった他医薬品の特徴を、あたかも本剤の特徴であるかのような紹介方法
▽「ガイドラインの掲載順が他剤よりも前である」、「AGと後発品における溶出性の差は効能効果に影響がある」など、関連性のない事実を根拠に優位性を主張すること
▽「(有効成分は同じだが剤型が異なる対照薬のデータを示して)有効成分も剤型も同じ対照薬に対して優位性がある」、「(活動期では既存薬Aのみ、寛解期では既存薬Bのみに対して非劣性が示された事実について)活動期も寛解期も既存薬に比べて非劣性が確認できた」など、対照薬と1対1対応していないデータや事実に基づく優位性の主張
▽医薬品リスク管理計画(RMP)の記載内容や副作用について情報提供しない
【不適切なプロモーション資料】
○信頼性に欠けるデータを用いた資料
▼承認時資料や査読を受けた論文以外のデータ紹介▼症例数が少ないデータ(1医療機関でのデータ、症例数9例など)での優位性主張▼臨床データと関連のない非臨床データの紹介▼優位性を顕著に示せる臨床試験結果のみの紹介▼統計手法や統計解析の結果不記載▼承認されていない用法用量・効能効果に関するデータの紹介—
○引用文献の図表を加工した資料
▼軸の最大値の調整、軸の尺度変更による「差」の強調▼補助線や矢印の追加、着色等による「差」の強調▼引用文献からの「優位な部分のみ」の抜粋(対照薬と自社製品の比較結果から自社製品のみを抜粋する、3時点比較結果から最も差の大きい1時点のみを抜粋する、など)▼引用文献にないデータの追記▼引用文献のデータ掲載順の変更▼引用文献の補足事項をもとにしたデータ修正(いずれも、例えば「差が大きくなる」ような加工が施されることがある)—
○事実誤認の恐れのある構成・表現を用いた資料
▼製品説明会の趣旨とは異なる内容についての説明(適応追加に関する説明会で「従来の適応」に関するデータを混在させるなど)▼明確に区別すべき情報(承認審査の対象データと非対象データ、主要評価項目と副次評価項目、参考情報など)の混在や並列扱い▼データを誇張したかのような見出しやタイトル▼利益相反の非明示—
報告書では、「製薬企業担当者が医療機関を訪問して、現場の医師・薬剤師等に対して製品説明・情報提供を行う『クローズドな場』において、依然、不適切な情報提供活動が多く行われている」と指摘。今後、製薬企業や業界団体自らがコンプライアンス遵守の徹底を図り、適切な広告活動を行うよう求めるとともに、医療関係者に対して「製薬企業からの適切な広告活動についての教育を実施する」ことも要請しています。


【関連記事】



