材料・機器の内外価格差是正をさらに進め、A2・B3製品の保険適用迅速化を図る―中医協・材料専門部会
2021.10.15.(金)
医療機器・材料については、外国価格調整ルールによって内外価格差の是正が図られてきているが、依然として不合理な内外価格差が存在しているようだ。2022年度の次期材料価格制度改革でも、内外価格差是正に向けて▼基準値の見直し▼外国平均価格算出ルールの見直し―を検討していく―。
また医療材料の保険適用迅速化、改正薬機法対応も進めていく―。
10月15日に開催された中央社会保険医療協議会の保険医療材料専門部会(以下、材料専門部会)では、こういった議論が行われています。
内外価格差のさらなる是正、A2・B3製品の迅速な保険適用
2022年度には材料改革制度改革も行われる予定です。材料専門部会では▼保険医療材料専門組織(材料価格算定ルールに基づいて、個別医療機器の価格設定などを行う中医協の下部組織)からの改革案▼材料・機器メーカー等の意見―を踏まえて、具体的な見直し方向に関する論議を続けています。10月15日の材料専門部会には、厚生労働省保険局医療課医療技術評価推進室の中田勝己室長から、第2弾として(1)内外価格差の是正(2)保険収載の迅速化(3)変更計画確認手続制度への対応—の3つの論点が提示されました(第1弾の見直し論議に関する記事はこちら)。
まず(1)は、特定保険医療材料について「外国価格」と「本邦での償還価格」との格差をできるだけ縮小していこうという論点です。2002年度の材料価格制度改革で「外国における平均的な価格」をベースに、償還価格(材料価格)を調整する仕組みが導入され、▼価格調整の厳格化▼外国における平均価格の算出方法見直し―などが進められてきています。
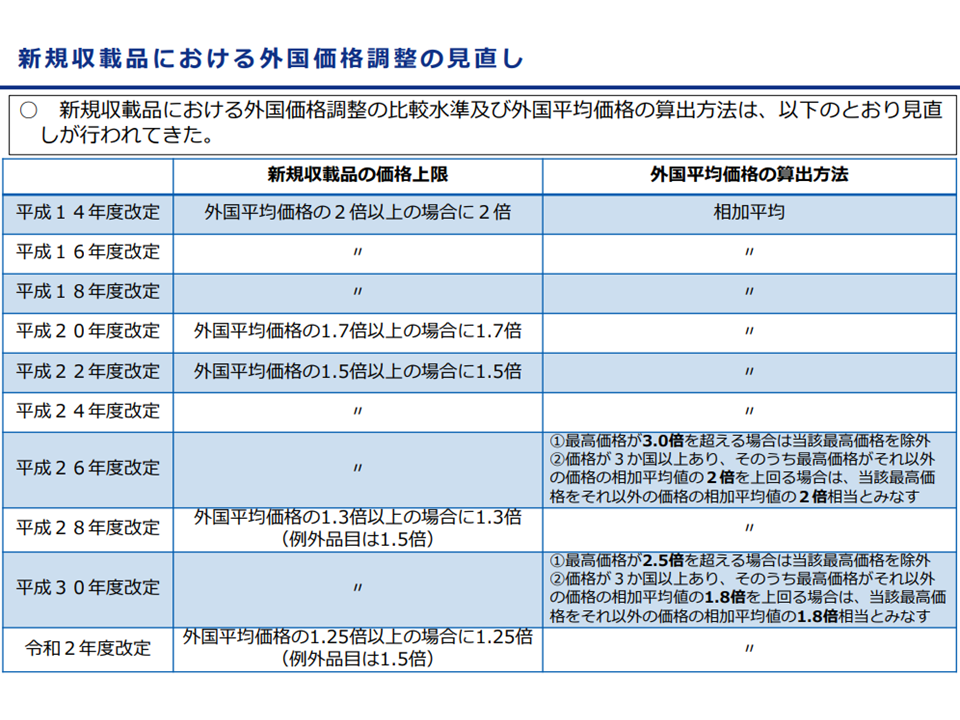
新規収載品についての価格調整基準の推移(材料専門部会1 211015)
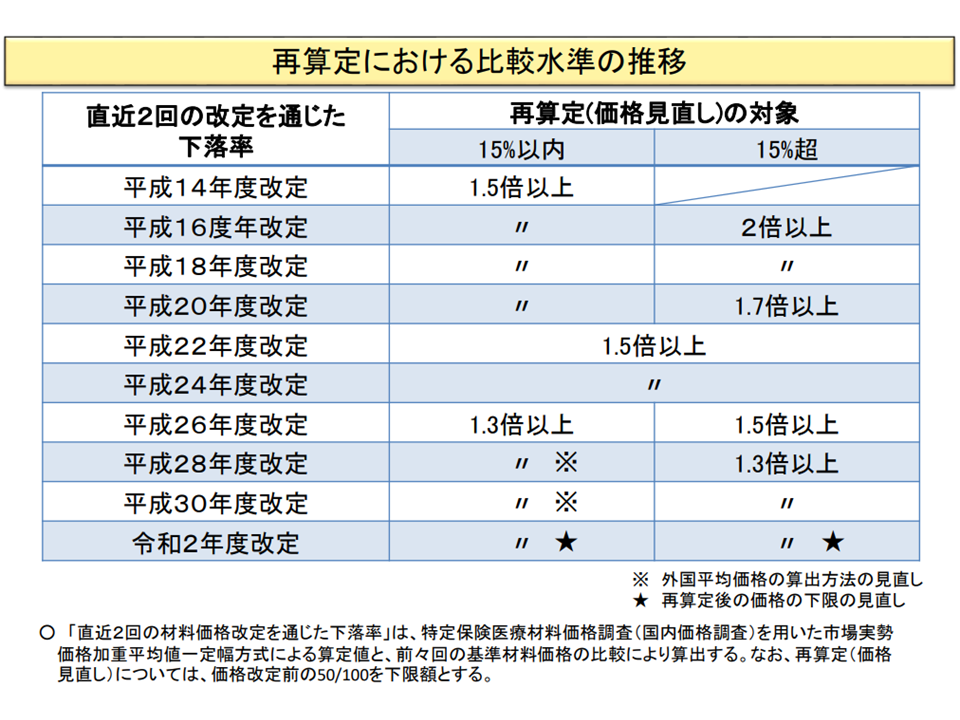
既収載品についての価格調整基準の推移(材料専門部会2 211015)
中田医療技術評価推進室長は、逐次の改革で外国価格差は縮小してきているものの「依然として内外価格差が存在する」(2018年6月から2021年6月までに新規保険適用された材料のうち、1製品が外国価格調整の対象となっている)ため、2022年度改革でもこの方向に沿った見直しを行う考えを提示。委員もこれに賛同していますが、「製品の安定供給にも十分な配慮を行うべき」との声も多くの委員から出ています(単なる価格引き下げでは安定供給に支障が出かねない)。
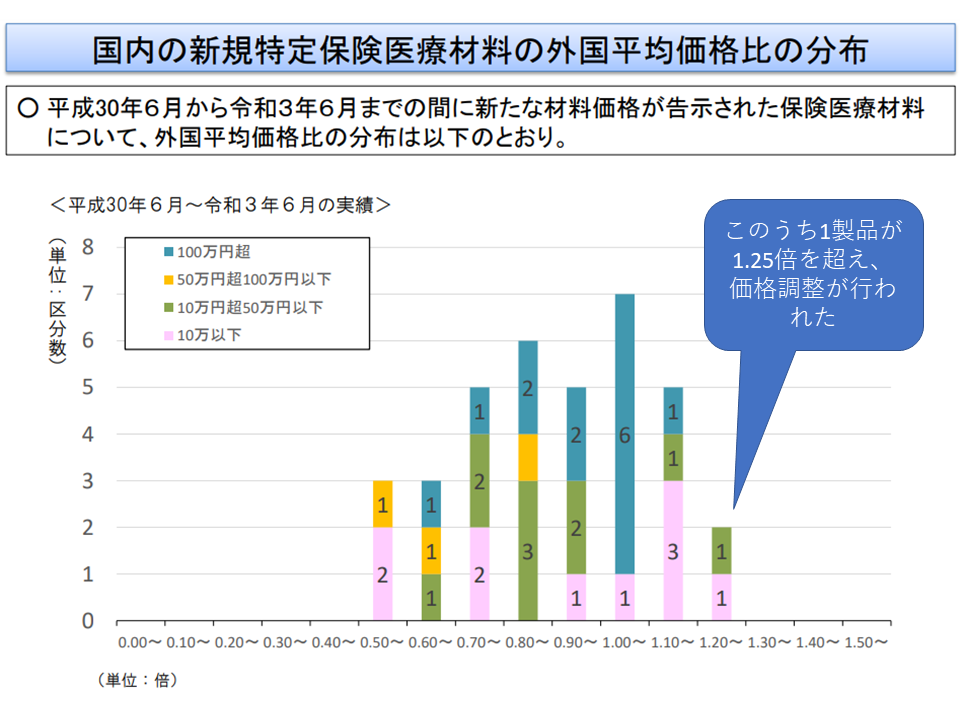
内外価格差は是正されてきているが、直近でも1製品が外国平均価格の1.25倍を超え、価格調整(引き下げ)が行われた(材料専門部会3 211015)
この点、支払側の幸野庄司委員(健康保険組合連合会理事)は「新規収載品目と再算定(既収載品目)とで、価格調整の上限率は揃えるべき」と提案(現在、新規製品について「外国平均価格の1.25倍を超える製品は、1.25倍にまで償還価格を引き下げる」、既収載について「同じく1.3倍を超える製品は、1.3倍にまで償還価格を引き下げる」という基準値が置かれている)。
また、林利史専門委員(エドワーズライフサイエンス社ガバメントアフェアーズ部長)は、とりわけ再算定時の外国平均価格調整方法について適切な運用を行うべき旨の提案を行いました。
内外価格差是正においては「外国における平均価格」を参照しますが、同じ医療材料であっても外国での販売価格はさまざまで、中には「極点に高い、極端に低い」ケースもあります。材料価格制度では、こうした言わば「外れ値」を除外する(例えば、最も高い外国価格が、最も低い外国価格の2.5倍を超えるケースでは、当該「最も高い価格」を除外する)ルールとしています。こうしたルールについて「外国価格を適正に示しているのか」という妥当性の検証がまず重要です。
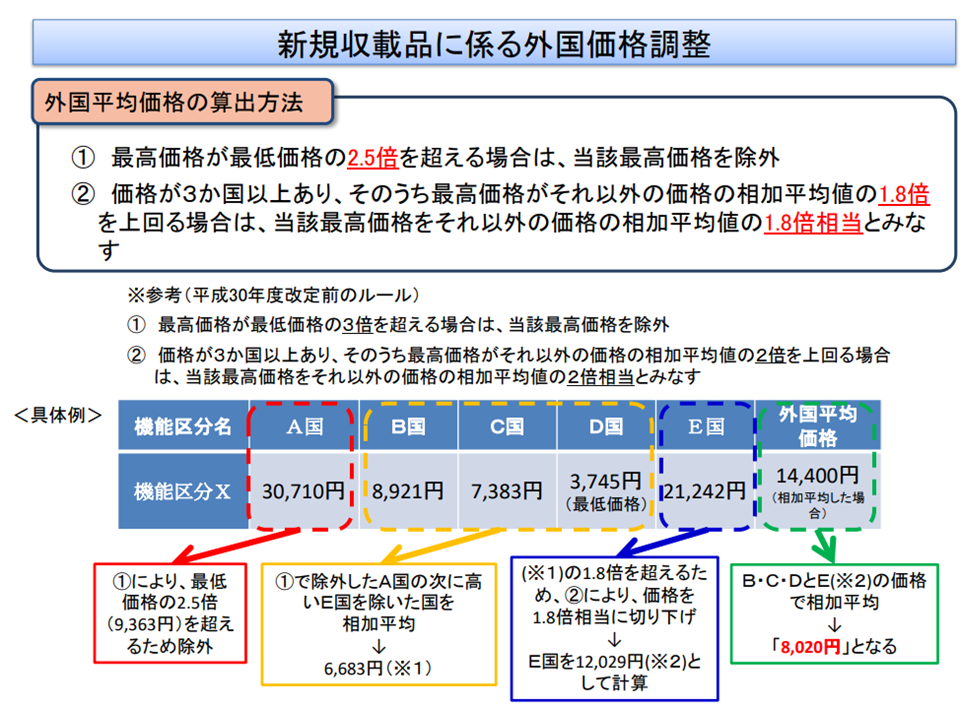
外国平均価格を計算する際には、いわゆる「外れ値」を除外する(材料専門部会4 211015)
また既収載の材料については、「類似の機能を持った製品」をグループ化(機能区分)し、その機能区分に含まれた製品について外国平均価格との比較を行うため、「ある製品では外国価格と比べて大きな差はないが、別の製品で価格差が大きなために、それに引っ張られて償還価格が引き下げられてしまう」という不合理も出てきかねません(同じ機能区分の製品は、同じ償還価格が設定される)。こうした不合理については、現行制度でもケースごとに「区分の細分化」などで対応されていますが、林専門委員は「適切な対応が行われているのかの検証も必要である」との問題意識を持っていると考えられそうです。
委員・専門委員の意見を踏まえて、外国価格調整ルール改正の詳細を詰めていくことになります。
ところで医療材料は、使われ方などによって下図のとおり▼A▼B(個別)▼C(新機能)―などに区分されます。
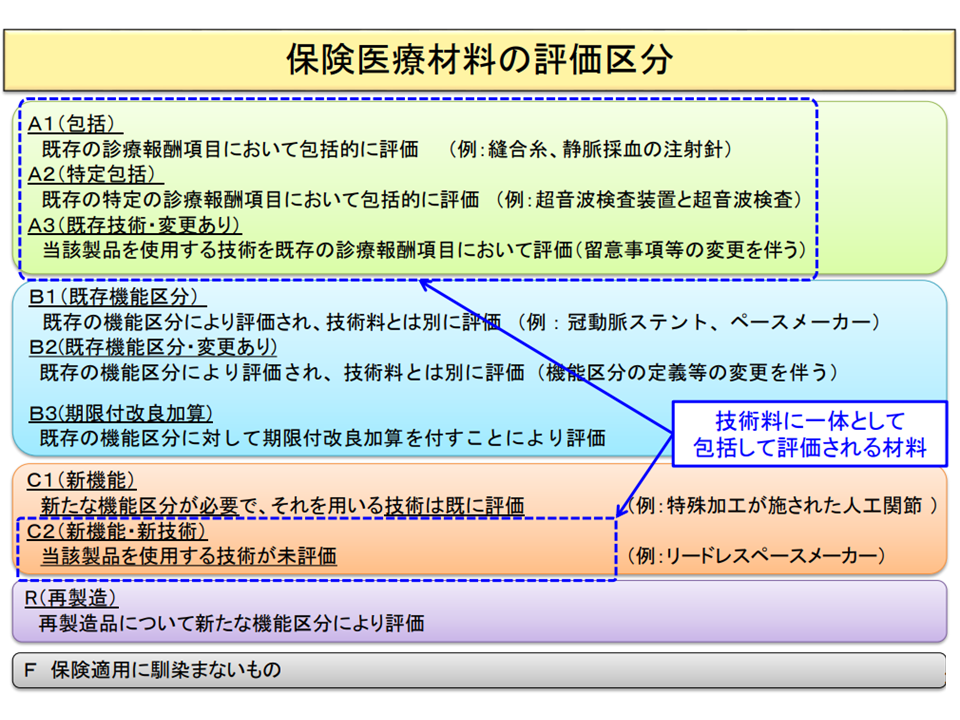
保険医療材料の決定区分
このうち「A3」と「B2」の区分になった材料は、体外診断薬に比べて保険適用の時期が「1か月遅くなるケースがある(暦月の11日以上に区分決定がなされた場合)」という制度上の問題点があります。優れた製品をより迅速に患者に届け、またメーカーサイドの開発意欲に応えるために、中田医療技術評価推進室長は「A3・B2区分つぁれた医療機器について、E2区分の体外診断用医薬品と同様の取り扱いとする」考えを提示しています。
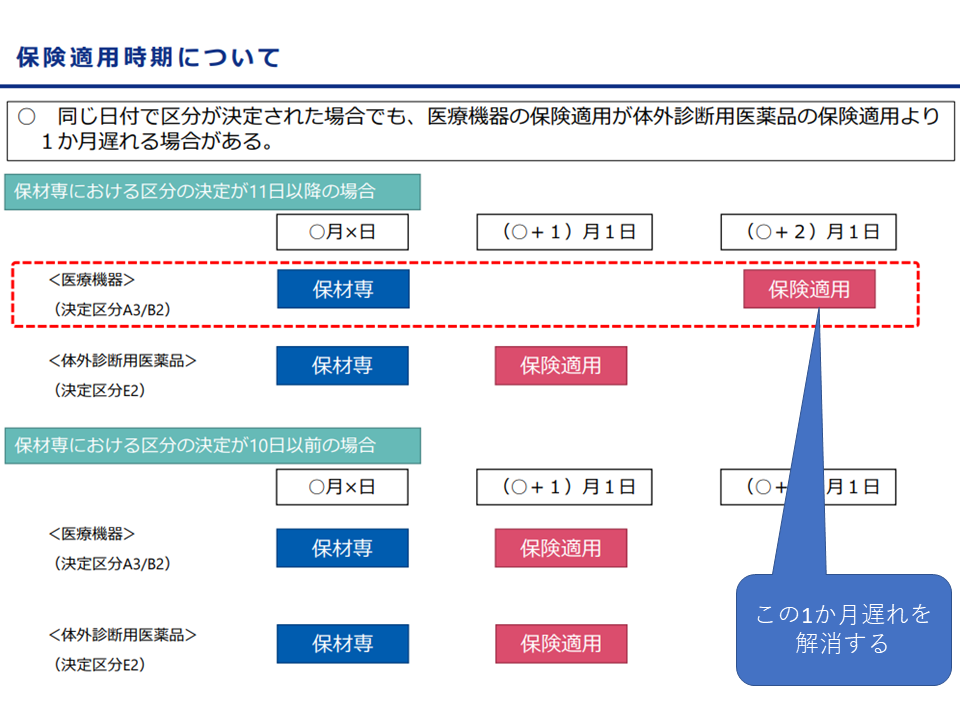
A2・B3区分となった新規医療材料の保険適用が、場合により1か月遅くなってしまう事例の解消を行う(材料専門部会5 211015)
また薬機法(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律)が改正され、「最終的な製品の有効性、安全性に影響を及ぼさない医薬品等の製造方法等の変更」について、事前に厚生労働大臣が確認した計画に沿って変更する場合には「承認制」でなく「届出制」とするとの見直しが行われました(変更計画確認手続制度)。
一方、材料価格制度(保険制度)の中には「届け出」された製品についてメーカーが保険適用希望書を提出するルールがありません(一部変更承認・認証のケースのみ可)。そこで、企業が希望する場合には「変更計画確認手続制度に係る届け出を行った製品についても保険適用希望書を提出できる」とのルール見直しを行うことになります。例えば▼材料の形状の一部変更▼新たなサイズの追加―などが、この見直しルールの対象となる見込みです。
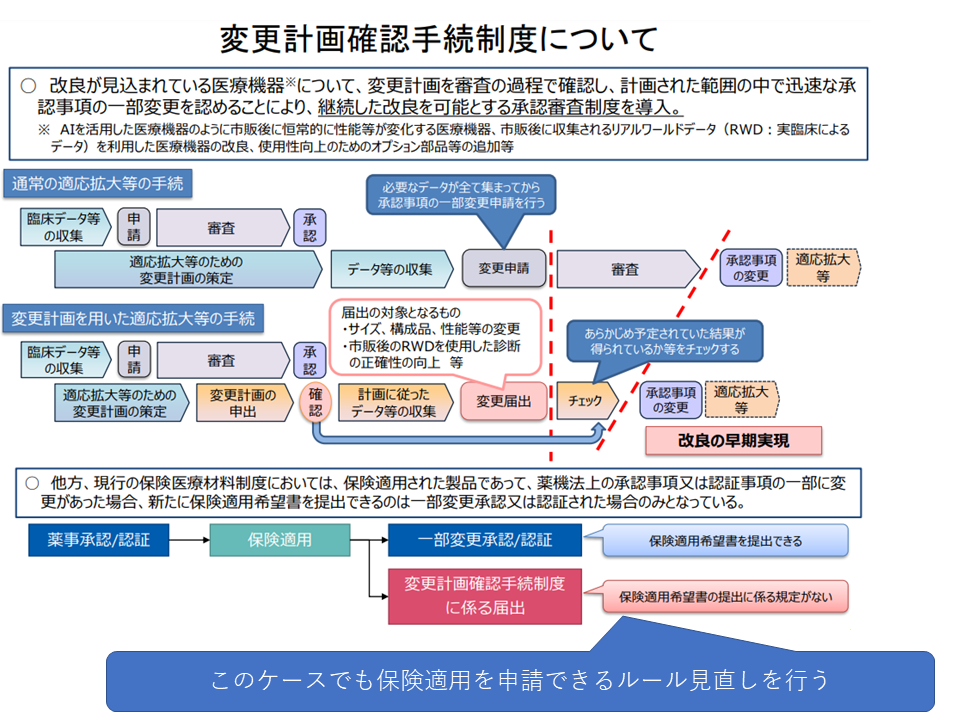
改正薬機法による「変更計画確認手続き制度」に係る届け出を行った医療材料についても、保険適用申請を可能とする(材料専門部会6 211015)
これらの見直し方向についても委員から異論は出ておらず、今後、厚労省で詳細を詰めていくことになります。
【関連記事】
技術料と一体評価される機器等、チャレンジ申請の場合に有用性等をどう切り分けて再評価すべきか―中医協・材料専門部会
医療機器の償還価格下支え、技術料で評価する機器のチャレンジ申請、プログラム機器の評価など進めよ―中医協・材料専門部会
2022年度材料価格改革、チャレンジ申請拡大やプログラム医療機器の評価明確化などが重要論点―中医協・材料専門部会
2022年度材料価格制度改革、イノベーション評価・プログラム医療機器の評価方法等が重要論点―中医協・材料専門部会
2020年度材料価格制度改革を了承、市場拡大再算定ルールの新設、チャレンジ申請の拡大など―中医協総会(3)
ニコチン依存症患者に対する「アプリを使った禁煙治療」を診療報酬で評価―厚労省
唾液を検体に、新型コロナとインフルエンザを迅速鑑別できる検査方法を保険適用―中医協総会(1)





