条件・期限付き承認を受けた再生医療等製品、本承認までの間「有用性加算等での評価」を控えるべきか—中医協総会
2025.10.15.(水)
条件・期限付き承認を受けた再生医療等製品について、「条件期限付き承認→保険適用」の時点で有用性加算等を付すべきか?「本承認→保険適用」の時点で各種加算を付すべきではないか?
10月15日に開催された中央社会保険医療協議会の総会、および費用対効果評価専門部会・薬価専門部会・保険医療材料専門部会の合同部会でこういった議論が行われました。今後、業界からのヒアリングを行ったうえで「条件・期限付き承認を受けた再生医療等製品」の保険適用の在り方をさらに議論していきます。なお、同日には2026年度の保険医療材料制度改革・費用対効果評価制度改革論議も行われており、別稿で報じます。
条件・期限付き承認を受けた再生医療等製品の保険適用(価格設定)ルールを検討
例えば難病治療薬などについては、患者数が極めて限られるために「有効性に関するデータを治験段階で得ることができない」ケースがままあります。これを「データが十分でないので薬事承認・保険適用しません」と厳格に対応したのでは、患者が最新の医療技術へアクセスする機会が大きく削がれてしまいます。
そこで一定の有効性が推定される場合などには、「まず条件・期限付きで承認、保険適用する」→「保険適用により投与症例数を一定程度確保し、有効性に関するデータを収集しやすくなる」→「市販(保険適用)後のデータも含めて有効性を確立し、本承認、保険適用する」といった仕組みが設けられています。例えば、新型コロナウイルス感染症治療薬のゾコーバ錠についても、この仕組みによって「条件・期限付き承認時の保険適用(薬価基準収載)」→「本承認時の保険適用(薬価基準収載)が行われています。
また、注目される小児(3歳以上8歳未満)の「デュシェンヌ型筋ジストロフィー」(DND)患者に対する画期的な再生医療等製品である「エレビジス点滴静注」(一般名:デランジストロゲン モキセパルボベク)についても、条件・期限付き承認が行われ、今後、保険適用論議が進められます(関連記事はこちら)。
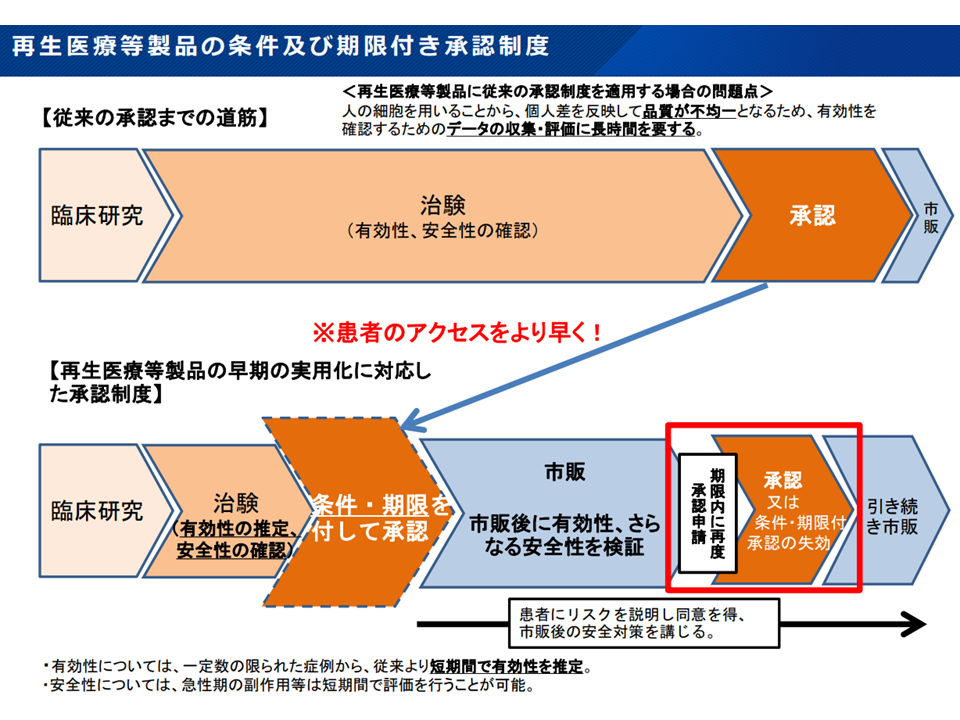
条件・期限付き承認制度の概要(中医協総会1 251015)
「最新の優れた医療技術に対する患者のアクセスを確保する」ことを目指す優れた仕組みですが、条件・期限付き承認を受けた「再生医療等製品」の中には、有効性・安全性を確認できず「取り下げ→保険適用からの削除」となるものが続けて2例現れてしまいました(慢性動脈閉塞症等治療に用いる「コラテジェン筋注用」、重症心不全治療に用いる細胞シート「ハートシート」)。
このため中医協では「条件・期限付き承認を受けた製品の保険診療上の評価の在り方」を検討していく方針を決定しています(関連記事はこちら)。
10月15日の中医協総会・合同部会では、この方針に沿った議論が行われました。
厚生労働省保険局医療課の清原宏眞薬剤管理官は、まず「薬価・材料価格算定」(再生医療等製品は特性に応じて医薬品または医療材料として保険適用が検討される)に当たって次のような論点を提示しました。
(1)薬価・材料価格算定の「原価計算」(類似薬などがない場合に原価を積み上げて薬価等を設定する仕組み)において、一般管理・販売費、営業利益率、流通経費の係数をどう考えるか
(2)薬価算定において、主に薬事承認で用いられた臨床試験成績における評価に基づいて画期性加算・有用性加算を行う仕組みとなっている(ただしこれまでに加算が付された医薬品はない)が、この点をどう考えるか
(3)薬価算定において、「希少疾病用医薬品として指定されたものを評価する市場性加算(I)」など、画期性加算・有用性加算以外の補正加算も行う仕組みとなっている(ただし、これまでに加算が付された医療機器はない、医薬品ではある)が、この点をどう考えるか
(4)薬価基準収載等における「外国平均価格調整」(外国価格と著しい乖離がないように調整する制度))を行う仕組みとなっている(ただし、医薬品、医療機器ともこれまでに加算が付された製品はない)が、この点をどう考えるか。
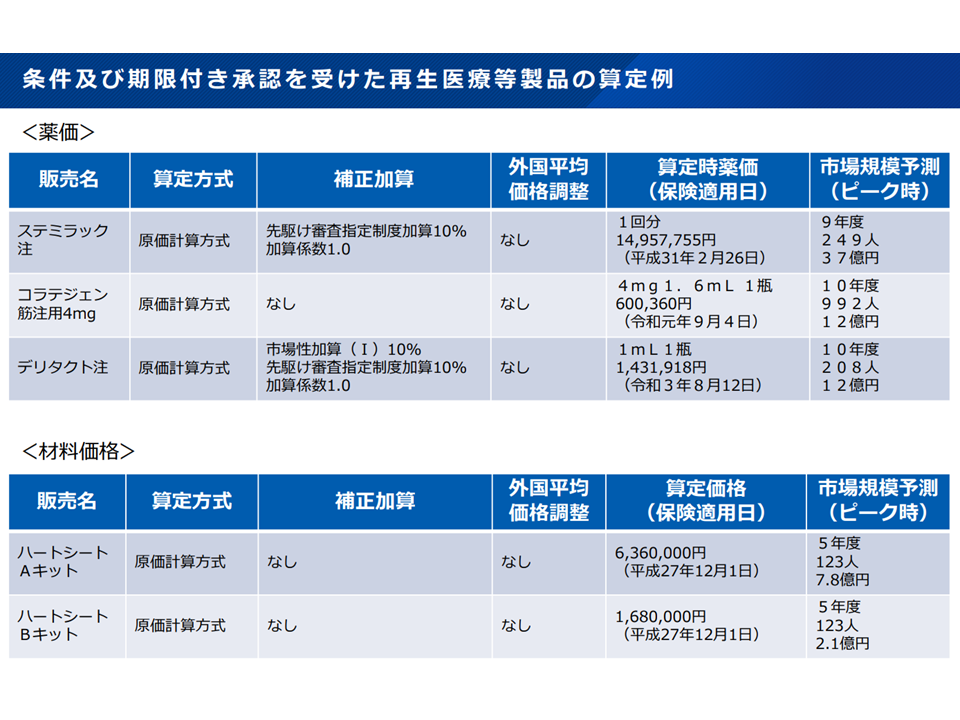
これまでに保険適用された条件・期限付き承認を受けた再生医療等製品(中医協総会2 251015)
この点について中医協委員からは、▼条件・期限付き承認時には「有効性の推定」がなされているにすぎず、有用性加算等の取り扱いは通常承認時とは異なるべきではないか。外国価格調整の適用も慎重に検討すべき(診療側の江澤和彦委員:日本医師会常任理事)▼条件・期限付き承認は言わば「仮免許」であり、各種加算の適用は慎重に考慮すべき。なお「事後に有用性が確認され、本承認を受けた」際に、改めて加算等を適用することも考えられる(診療側の森昌平委員:日本薬剤師会副会長)▼条件・期限付き承認時には「有効性の推定」がなされているにすぎず、有用性加算を付すことはあり得ない。これまでの製品はすべて原価計算方式で薬価等が設定されているが、「開発途上」である点を踏まえた原価積み上げ等が必要であろう。その際には「原価の開示」度についても勘案する必要がある(支払側の松本真人委員:健康保険組合連合会理事)—といった声が出ています。
これまで「条件・期限付きでの承認」であっても、「通常の薬事承認」を受けた製品と同様に保険適用(価格算定)が行われてきていますが、中医協委員は「条件・期限付きでの承認」段階では「有効性が『推定』されているに過ぎない」点を踏まえた別の保険適用(価格算定)ルールを設けるべきと考えていることが分かります。
また、「条件・期限付きでの承認→保険適用」となった後に、▼市場拡大再算定(予想を超えて市場が大きく拡大した場合などに、医療保険財政への影響を考慮して価格を引き下げる仕組み)▼費用対効果評価(設定された薬価・材料価格を「費用対効果」を踏まえて調整する仕組み)—をどう考えるかという論点もあります。
このうち市場拡大再算定については「再生医療等製品は高コストであることは承知しているが、高額な製品は医療保険財政への影響も大きく、市場拡大再算定は通常承認を受けた製品と同様に行うべき」との声が診療側・支払側の双方から出ています。
一方、費用対効果評価に関しては、支払側の松本委員は「通常承認を受けた製品と別扱いにする必要はない」との考えを示しましたが、診療側委員は少し異なる考えのようです。
現在の費用対効果評価制度は、類似品目と比べて費用対効果評価が良ければ「価格を据え置く」、悪ければ「価格を引き下げる」ことになりますが、価格引き下げ・調整の範囲は「加算部分」のみとされています(原則)。
すると、上述のように診療側委員は「条件・期限付き承認時点では、有効性は推定されているにすぎず、加算評価を行うべきではない」とコメントしていることから、「費用対効果評価結果に基づき価格調整を行う場合、どういった価格調整を行えば良いのか」との疑問が生じます。
この点、森委員は「当該製品の加算評価が固まってから費用対効果評価を検討すべきではないか」と提案。また江澤委員は「価格調整範囲の拡大(加算以外の部分も引き下げ対象とする)も検討すべきではないか」との考えを示しました。
この論点については、「費用対効果評価制度において価格調整をどう考えるか、現行どおり『加算部分の調整』の仕組みを維持するか、『加算以外の部分も含めた調整』の仕組みを導入するか」という議論とセットで考える必要があるでしょう。
なお、認知症治療薬「レケンビ」については、特例的に「加算以外の部分も含めた調整」の仕組み、具体的には▼費用対効果評価の結果「ICERが500万円/QALYとなる価格」(言わば、低い効果に見合った低い価格)と「見直し前の価格」の差額を算出し、差額の25%を調整額とする(有用性加算部分にとどめず、償還価格(薬価)全体を見直しの対象とするイメージ)▼価格が引き下げとなる場合には、調整後の価格の下限は「価格全体の85%(調整額が価格全体の15%以下)」とする—という特別ルールが適用されている点にも留意が必要です(今後、こういった考え方が拡大される可能性も否定できない)。
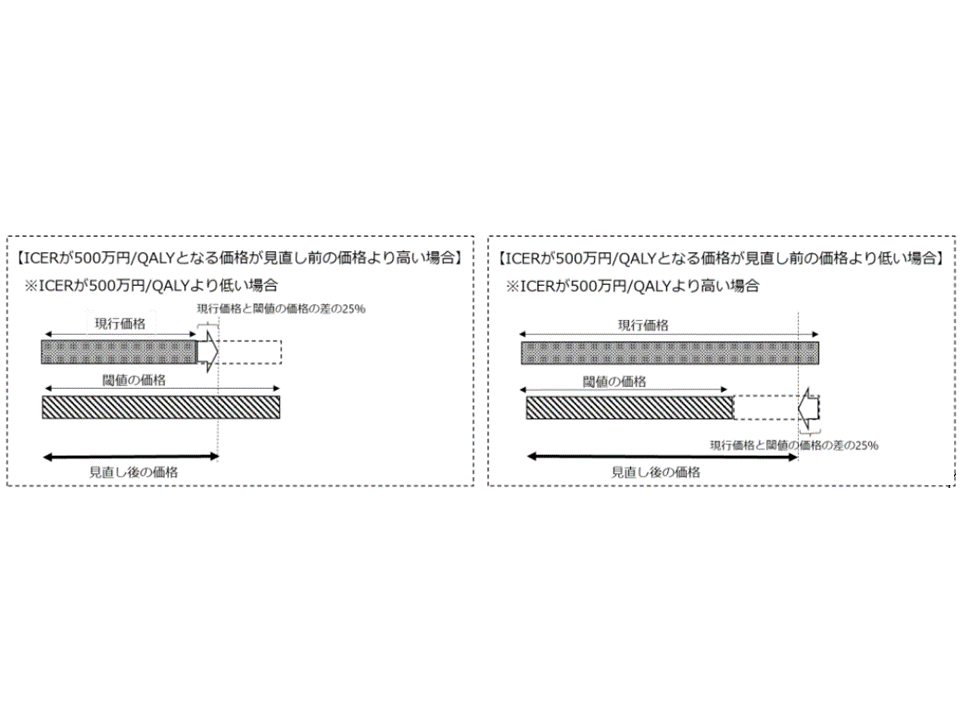
レケンビの費用対効果評価における「価格調整範囲」の特例的な考え方(中医協総会(1)4 231213)
さらに「条件・期限付き承認を受けた製品」について、「保険適用後に有効性が確認され、本承認を受けた」際には、改めて保険適用(価格設定)を検討することになりますが、清原薬剤管理官は次のような点を検討する必要がある中医協に要請しています。
(a)条件・期限付き承認を受けた再生医療等製品が「改めての承認」(本承認)を受けた際には、その際の審査に用いられた試験結果等に基づき「改めて有用性の補正加算の該当性を評価する」こととなっている
↓
▽他の補正加算も含め、改めて承認を受けた際の補正加算の評価をどう考えるか
(b)条件・期限付き承認を受けた再生医療等製品が「改めての承認」(本承認)を受けた際の費用対効果評価品目の指定についてどう考えるか
本承認となる場合には「条件・期限付き承認→保険適用」時には明らかになっていなかった有効性等が確認される可能性があり、その際には(a)のように「加算での評価」を行うことが考えられ、また異なる条件に基づく費用対効果評価を行うことも考えられます(従前よりも「費用対効果評価が良い」と判断される可能性がある)。
(a)の「本承認時の加算評価」については、「十分な有効性・安全性のデータを揃えて本承認を受ける際に、『条件・期限付き承認』時に分からなかった有効性などが明らかになることもあろう。その際には加算で評価することが妥当である」との見解が江澤委員・森委員・松本委員のいずれからも示されました。
なお江澤委員は「有効性・安全性のエビデンスを示せず、本承認前に『取り下げ』とするケースについては、それまでに保険適用によって得られた利益への対応について何らかの検討が必要なのではないか。逃げ得は、条件・期限付き承認制度そのものの信頼性を損ね、好ましくない」との問題意識を示しています。
また(b)の「本承認後に、異なる条件に基づく費用対効果評価を行う」方向に異論は出ていません。
委員意見を眺めると「条件・期限付き承認時点では低い評価にとどめる」→「その後、本承認の段階で、有効性のデータに基づく加算評価等を十分に行う」という大きな考えが見て取れます。
今後、こうした意見や上記論点そのものに対し「医薬品・医療機器業界がどのように考えているのか」を聞き(中医協でヒアリングを実施)、業界意見も踏まえながら「条件・期限付き承認となった再生医療等製品の保険適用ルール」を検討していきます。このルールは2026年度の薬価・材料価格・費用対効果評価制度に関する改革の一部になります。なお、DND治療薬「エレビジス点滴静注」について、現行ルールが適用されるのか、新ルールが適用サレルノ化については、今後の動きを待つ必要があります。
このほか5月14日の中医協総会では、次のような点が承認等されています。
【新たに保険適用される臨床検査】(本年(2025年)11月保険適用予定)
▽血清中の赤痢アメーバ抗体を検出し「赤痢アメーバ感染」診断を補助する補助する「赤痢アメーバ抗体 ELISA-IBL」(D012【感染症免疫学的検査】の「49 赤痢アメーバ抗体半定量、赤痢アメーバ抗原定性」(223点)を準用して評価する)
【新たに保険適用される医薬品】(本年(2025年)10月22日に保険適用(薬価基準収載)予定)
→以下の製品を含めた5成分・11品目
▽「初」の副甲状腺機能低下症治療薬「ヨビパス皮下注168μgペン(168μg0.56mL1キット)」(57万1509円)、「同皮下注294μgペン(294μg0.98mL1キット)」(58万4139円)、「同皮下注420μgペン(420μg1.4mL1キット)」(59万6310円)
→高額ゆえ、DPC制度において「当該製品を用いて『100240 副甲状腺機能低下症』治療を行う」場合には、当該入院医療は出来高算定となる
→当該製品は【在宅自己注射指導管理料】の対象薬剤に追加される
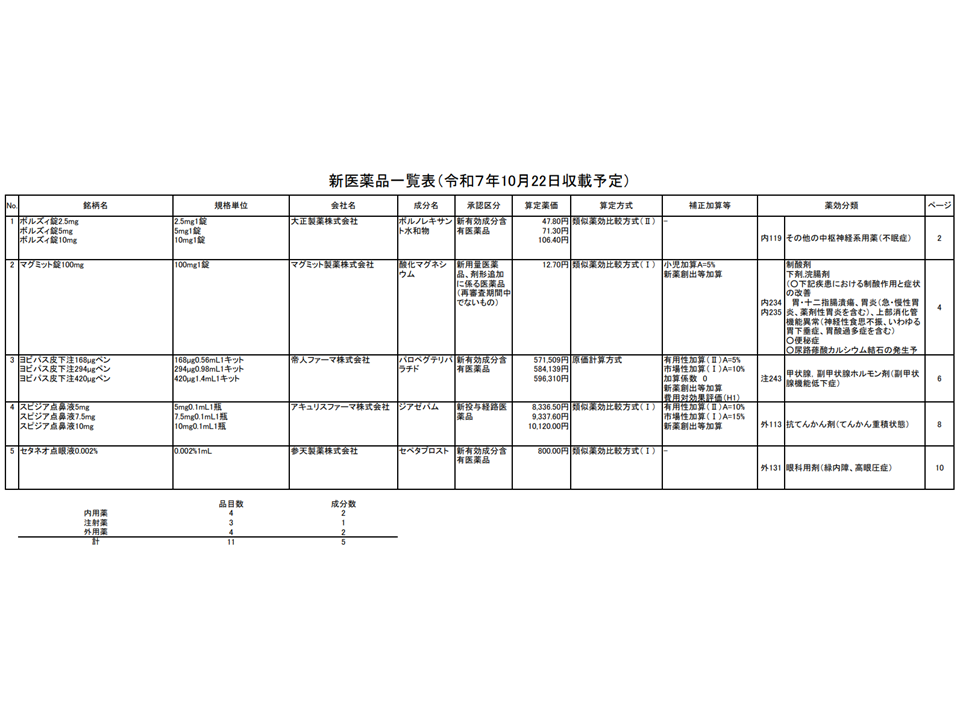
新薬の保険適用を承認(中医協総会4 251015)
【新たに保険適用される再生医療等製品】(本年(2025年)10月22日に保険適用(薬価基準収載)予定)
▽栄養障害型表皮水疱症の治療に用いる「バイジュベックゲル(2瓶1組)」(一般名:ベレマゲン ゲペルパベク)(295万5232円70銭)
→高額ゆえ、DPC制度において「当該製品を用いて『080110 水疱症』治療を行う」場合には、当該入院医療は出来高算定となる
【DPC制度からの退出】
▽遠賀中間医師会 おんが病院(福岡県、地域包括医療病棟への病棟再編を行うため本年(2025年)9月1日付で退出)
▽医療法人社団志朋会 加納渡辺病院(岐阜県、地域包括医療病棟への病棟再編を行うため本年(2025年)11月1日付で退出)
▽医療法人貝塚病院(福岡県、地域包括医療病棟への病棟再編を行うため本年(2025年)11月1日付で退出)
【関連記事】
2026年度薬価制度改革、市場拡大再算定の特例ルールの是非をどう考えるか、医薬品の原価開示をどう進めるか—中医協(3)
小児のデュシェンヌ型筋ジストロフィーの治療薬「エレビジス点滴静注」、投与前に各種検査を実施、感染症発生等に留意を—厚労省
小児のデュシェンヌ型筋ジストロフィー治療に用いる「エレビジス点滴静注」、安全性を再確認するまで保険適用論議をストップ—中医協(2)
小児の筋ジストロフィー治療に用いる「エレビジス点滴静注」、米国で5億円近い価格設定がなされ、どう保険適用を考えるか—中医協総会(2)





