2022年度薬価改革の内容固まる、タケキャブやヌーカラなど市場拡大再算定等の対象に―中医協総会(2)
2022.1.19.(水)
1月19日に開催された中央社会保険医療協議会・総会および、先立って開催された薬価専門部会で2022年度の「薬価算定基準の見直し」内容が決定しました。
すでに固められた「2022年度薬価制度改革の骨子」を詳細に詰めたものです。今後の答申(2月上旬予定)を経て正式決定となります。
タケキャブやヌーカラなど23成分の医薬品、市場拡大再算定等の対象に
薬価制度見直し内容は、これまでに薬価専門部会を中心に議論されてきた内容を整理したものです。すでにGem Medでも報じていますが、大枠を振り返ると次のような見直しが行われます。
●「薬価算定基準の見直し」(案)はこちら(原案通り中医協で承認)
(1)新薬創出適用外薬解消等促進加算(以下、新薬創出等加算)の対象に、新たに▼薬価改定までに有用性加算等(要件「ニ」のみに該当する場合を除く)に相当すると認められる効能・効果が追加されたもの(既存の効能・効果の対象患者の限定を解除したものなど「既存効能と類似性が高い」場合は除く)(2022年4月以降に追加された効能・効果が対象)▼先駆的医薬品で当該医薬品の指定に係る効能・効果、用法・用量について承認を受けているもの▼特定用途医薬品で、当該医薬品の指定に係る効能・効果、用法・用量について承認を受けているもの―を追加する
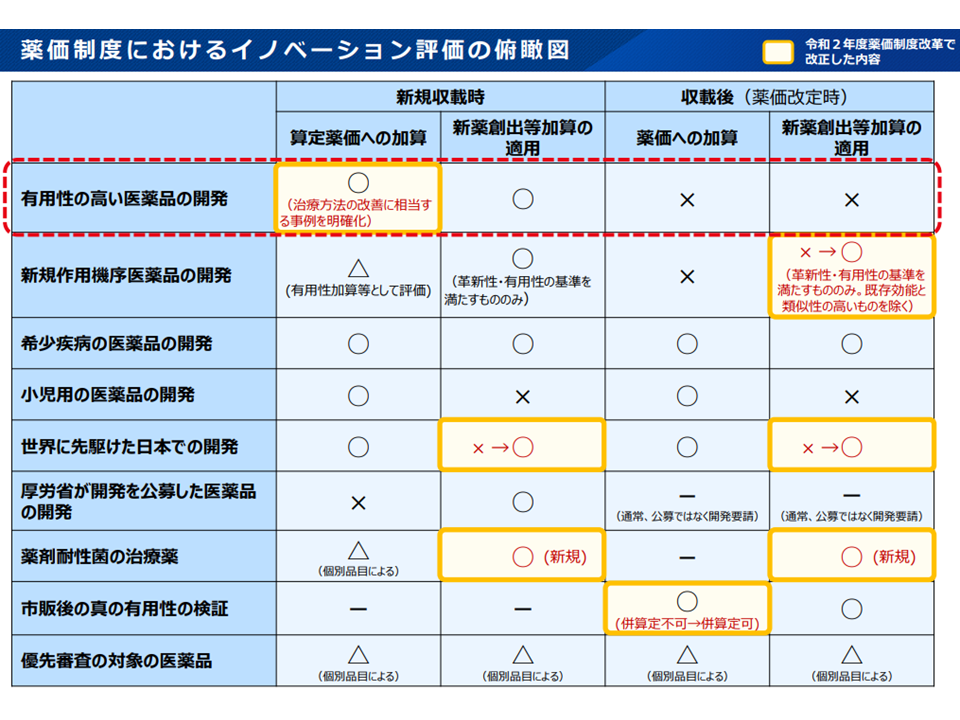
有用性の評価について、新規収載時と効能効果追加時とでズレがある(薬価専門部会1 210804)
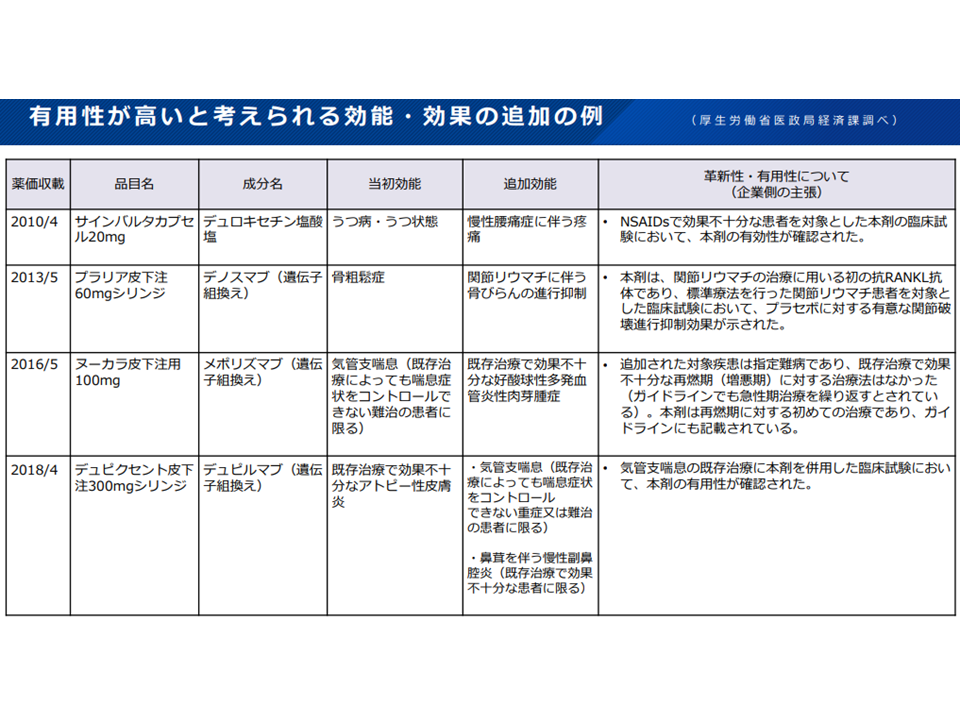
有用性が高いのではないかと思われる効能追加の例(薬価専門部会2 211020)
(2)「特定用途加算」(5-20%)の新設:▼特定用途医薬品である▼当該新規収載品の比較薬が特定用途加算の適用を受けていない―新規医薬品(市場性加算Iの対象を除く)を対象とする(あわせて「小児加算」について所要の見直しを行う)。過去5年間の開発状況は新薬創出等加算の企業指標の中でカウントされる(1品目について2ポイント獲得可)
(3)「先駆け審査指定制度加算」を「先駆加算」に見直す(10-20%)
(4)新薬創出等加算の企業指標において、▼特定用途加算の開発(1品目につき2ポイント)▼ワクチンを含めた新型コロナウイルス感染症の治療等に用いる医薬品開発(同4ポイント)―を評価する
(5)長期収載品の薬価を適正化するために、特例引下げ(Z2)・補完的引下げ(C)にかかる「後発品への置換え率別の薬価引下げ率」を次のように見直す
▼2.0%引き下げ:(現行)50%未満 → (見直し後)60%未満
▼1.75%引き下げ:(現行)50%以上70%未満 → (見直し後)60%以上80%未満
▼1.5%引き下げ:(現行)70%以上80%未満 → (見直し後)廃止
(6)新薬創出等加算の企業区分について、企業区分III(加算係数が0.8と低く設定される企業)の対象範囲を現在の「最低点数」(現在はゼロポイント)から「2ポイント以下」に見直す
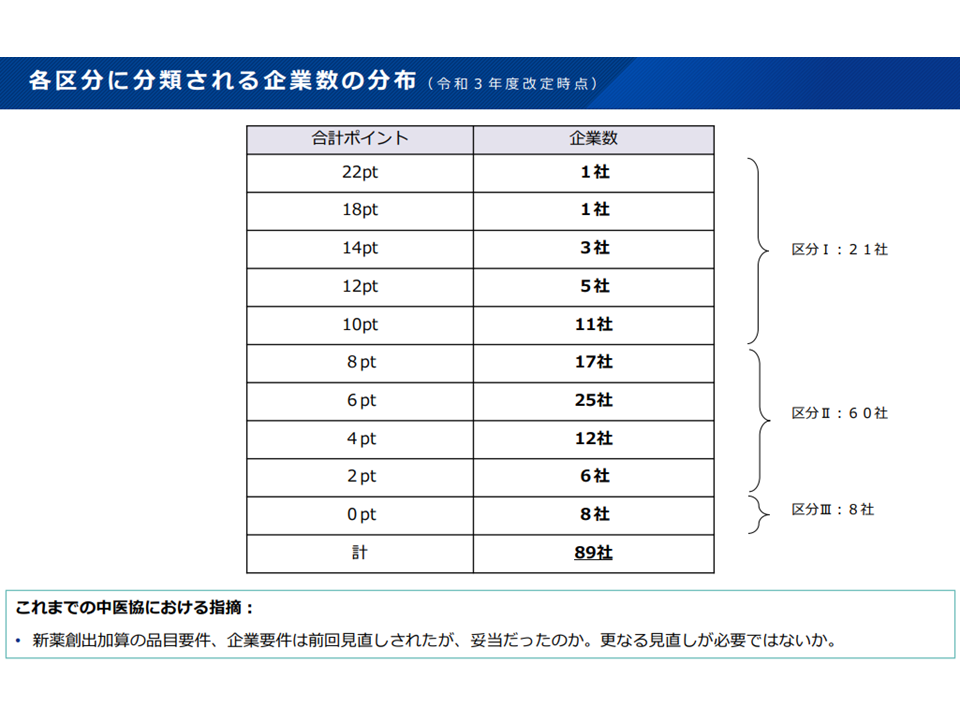
製薬メーカーの実績ポイント獲得状況(薬価専門部会9 211020)
(7)長期間薬価収載されている臨床上の必要性が高い医薬品について、次の取り扱いとする
▽基礎的医薬品の区分として「現時点で安定確保医薬品のうち優先度が高い品目(カテゴリ A、ただしZ期間終了前のものを除く)」を追加し、基礎的医薬品の要件に該当するものを基礎的医薬品と扱う
▽安定確保医薬品の「基礎的医薬品としての改定」に当たっては他のルールとの整合性を図る(G1(長期収載品から後発医薬品への置き換え促進ルールの1つ、後発品への置き換えが進んでいるもの(置き換え率80%以上)の段階的引き下げ)該当から6年以内、またはG2(長期収載品から後発医薬品への置き換え促進ルールの1つ、後発品への置き換えが困難なもの(置き換え率80%未満)の段階的引き下げ)該当から10年以内の先発品を対象外とするなど)
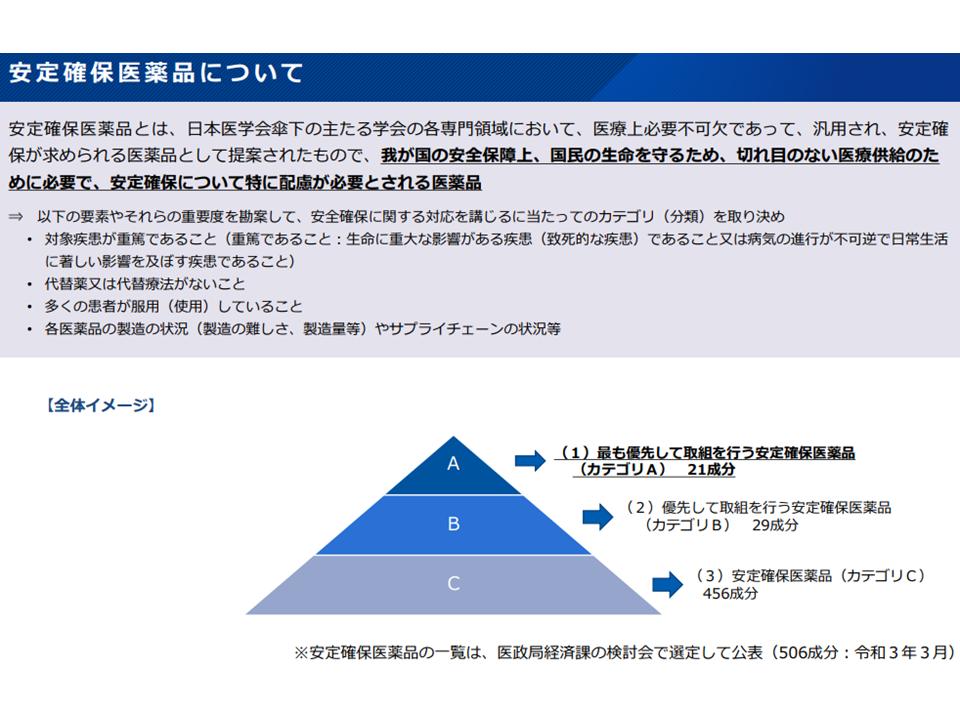
医学会の提唱する安定確保医薬品の概要(薬価専門部会10 211020)
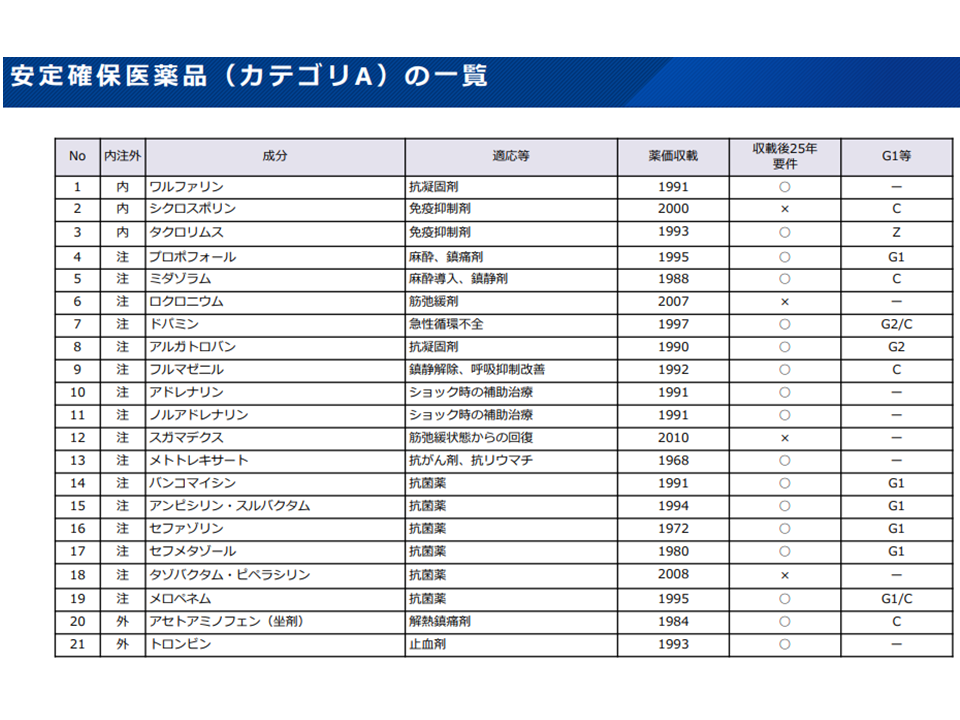
安定確保医薬品カテゴリA対象21成分(薬価専門部会11 211020)
(8)原価計算方式における薬価の透明性を確保する観点から次の見直しを行う
▽「日本以外の国への輸出価格の状況などの資料」提出があった場合は、日本を含む各国(原則として米国、英国、ドイツ、フランス)への輸出価格のうち最低の価格を日本への輸出価格とみなすこととする。ただし合理的な理由がある場合には「各国への輸出価格の平均価格」または「2番目に低い価格」などを日本への輸出価格とみなすことができることとする
▽原価開示度50%未満の場合の加算係数を現在の「0.2」から「ゼロ」とする
▽一定期間、移転価格として日本に導入される品目のメーカーに対して、必要な営業利益率についてのデータ提出の協力を求める
(9)市場拡大再算定の特例の対象品または類似品として薬価が引き下げられた後、「特例の適用日の翌日から起算して4年を経過する日」までの間は、1回に限り他品目の市場拡大再算定の類似品対象から除く

市場競合性を確保するため、市場拡大再算定対象の類似薬が再算定対象となることもある(薬価専門部会13 211020)
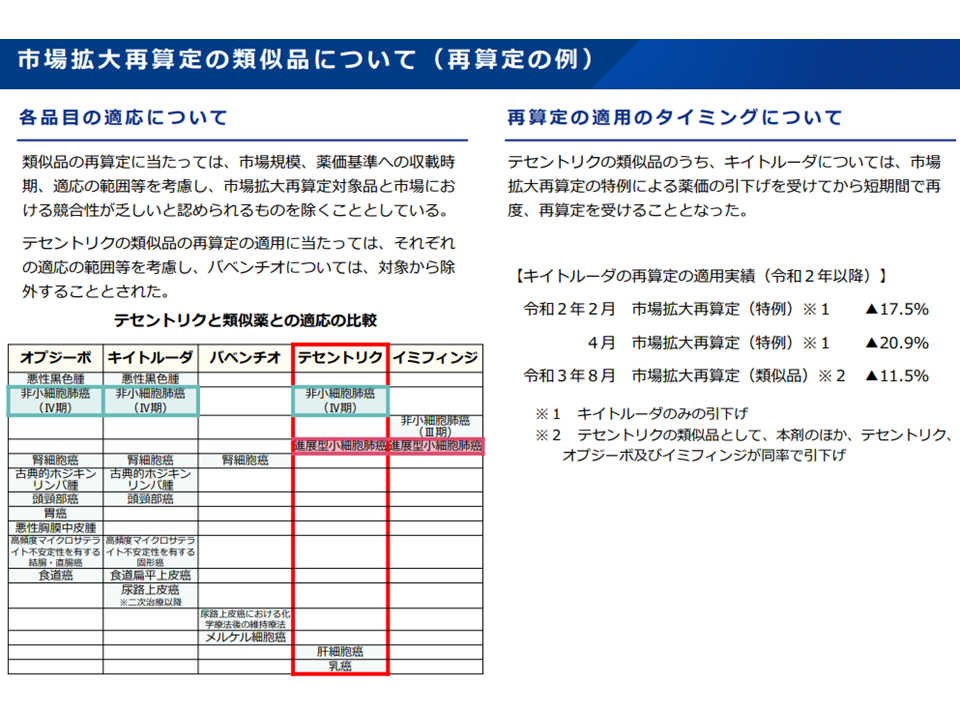
市場拡大再算定ルールにより短期間に繰り返し再算定を受けるケースもある(薬価専門部会14 211020)
(10)リポジショニング特例について、「未承認薬・適応外薬検討会議の議論を踏まえこうる省が開発を要請・公募した品目」を対象から除外する
(11)基礎的医薬品の改定ルールを、以下のように見直す
▽一度基礎的医薬品から外れた品目が再度基礎的医薬品の要件を満たす場合、基礎的医薬品として取り扱うものの、それ以外の基礎的医薬品まで価格を戻さず、その際の戻し幅を 50%分にとどめる(その薬価を当該品目の基礎的医薬品としての薬価とみなす)
▽これまで基礎的医薬品であった品目(A)が、基礎的医薬品から外れることにより、それ以外の基礎的医薬品外れ品目(B)との価格帯集約によりBの薬価を引き上げてしまう場合、Aはその集約後薬価、Bは改定前薬価とする(引き上げない場合は、AおよびBを集約する)
▽品目(規格)単位でなく「同一銘柄全体の乖離率の加重平均値」から該当性を判断する
(12)新規後発品の薬価算定は現在ルールを維持する
(13)今後、「年間1500億円の市場規模を超えると見込まれる品目」が薬事承認された場 合、通常の薬価算定手続きに先立って、直ちに中医協総会に報告し、当該品目の承認内容や試験成績などに留意しつつ薬価算定方法の議論を行う
こうした見直し内容に異論・反論は一切出されず、中医協総会として承認されました。2月上旬予定の答申を経て、見直し内容が正式決定されます。
また1月19日の中医協総会では、次の医薬品を2022年度改定時に市場拡大再算定などの対象とすることも了承されました。予測よりも市場が大きく拡大した場合などに「薬価を一定程度引き下げる」ルールです。医療保険財政を維持するためのルールではありますが、「優れた医薬品を開発し医療現場で広く使用される」と「かえって薬価が下がってしまう」仕組みであり「イノベーションを阻害する」ものとの批判もある点に留意が必要です。
【市場拡大再算定】(17成分・33品目)
▽抗てんかん剤の「イーケプラ」
▽ウィルソン病(肝レンズ核変性症)、低亜鉛血症治療薬の「ノベルジン」
▽慢性特発性血小板減少性紫斑病、再生不良性貧血治療薬の「レボレード」
▽再発・難治性の多発性骨髄腫の治療に用いる「ポマリスト」
▽ニューモシスチス肺炎治療などに用いる「サムチレール」
▽気管支喘息(既存治療によっても喘息症状をコントロールできない難治の患者に限る)、既存治療で効果不十分な好酸球性多発血管炎性肉芽腫症の治療に用いる「ヌーカラ」、および類似薬である「ファセンラ」
▽2型糖尿病治療薬の「ビクトーザ」、および類似薬である「ゾルトファイ」「バイエッタ」「ビデュリオン」「リキスミア」「ソリクア」「トルリシティ」「オゼンピック」
▽がん化学療法後に増悪した治癒切除不能な膵がんの治療に用いる「オニバイド」
▽根治切除不能な悪性黒色腫などの治療に用いる「ヤーボイ」
▽アレルギー性結膜炎治療に用いる「アレジオン」(点眼薬)
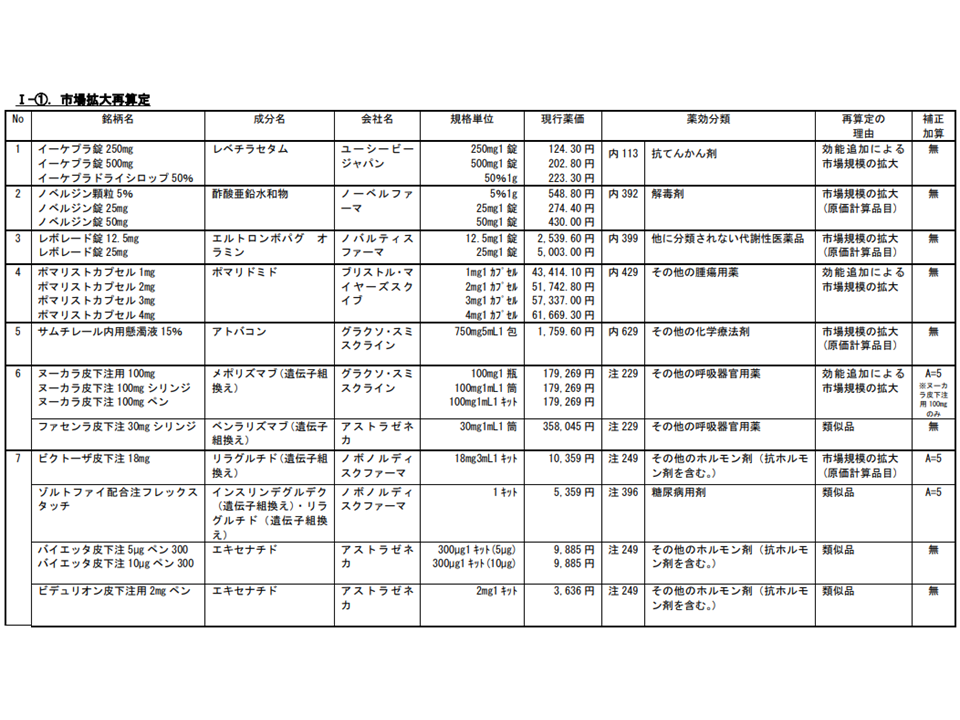
2022年度改定での市場拡大再算定等の対象品目(その1)(中医協総会(2)1 220119)
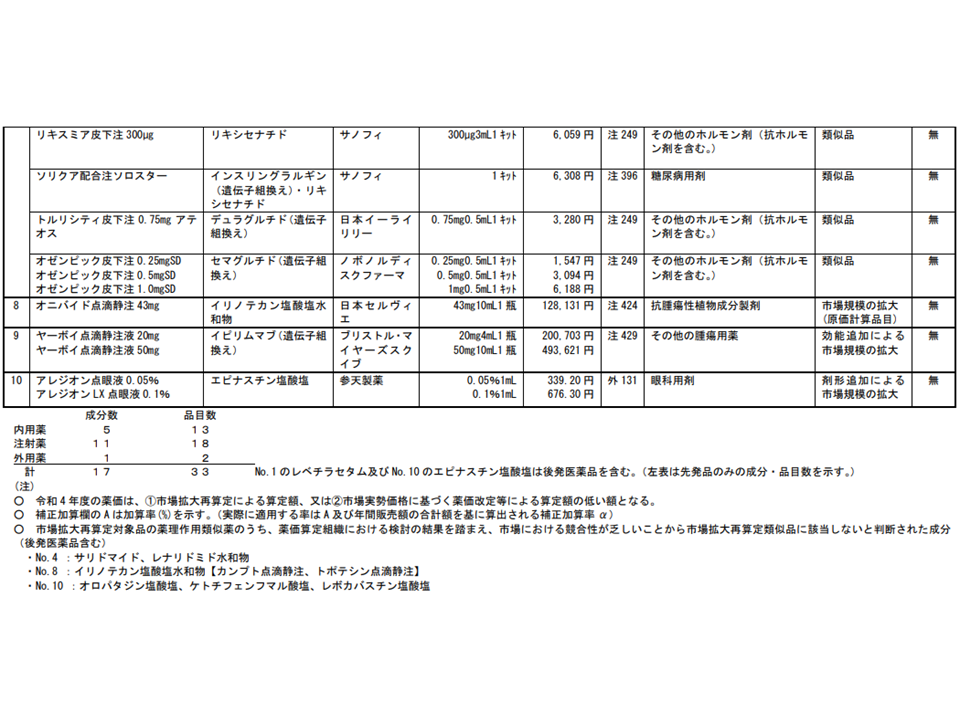
2022年度改定での市場拡大再算定等の対象品目(その2)(中医協総会(2)2 220119)
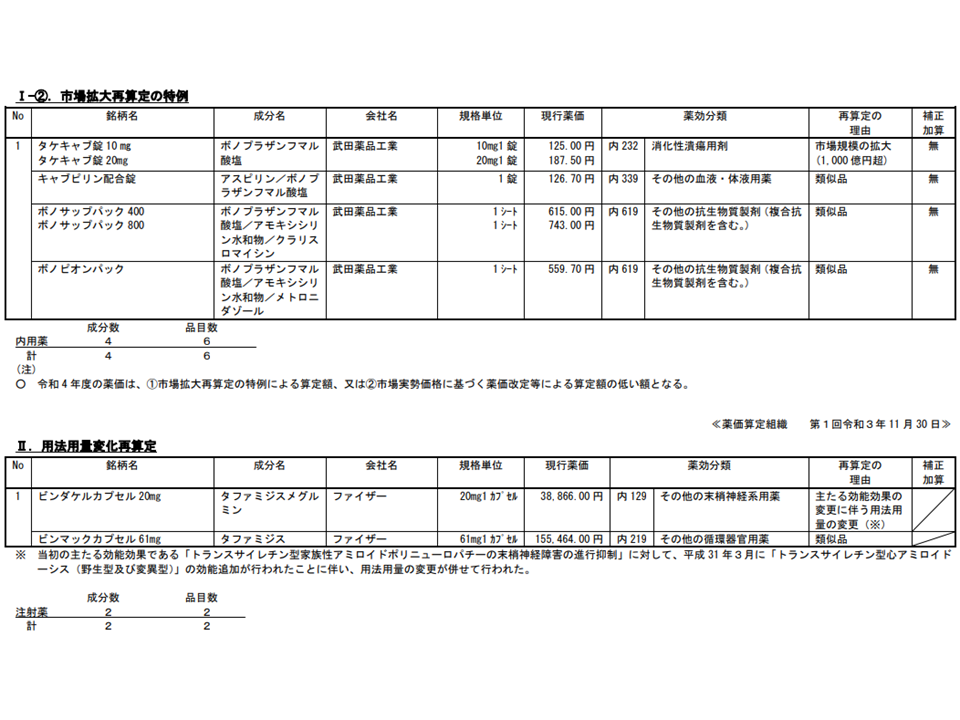
【市場拡大再算定の特例】(4成分・6品目)
▽胃潰瘍・十二指腸潰瘍などの治療に用いる「タケキャブ」、および類似薬である「キャブピリン」「ボノサップパック」「ボノピオンパック」
【用法用量変化再算定】(2成分・2品目)
▽トランスサイレチン型家族性アミロイドポリニューロパチーの末梢神経障害の進行抑制などに用いる「ビンダケル」、および類似薬である「ビンマック」
2022年度改定での市場拡大再算定等の対象品目(その3)(中医協総会(2)3 220119)
【関連記事】
原価計算方式における「原価開示度50%未満」のペナルティ、加算係数「ゼロ」で決着―中医協総会(2)
2022年度薬改革論議が大詰め、原価開示度が低い場合のペナルティ、調整幅の取り扱いなどポイント―中医協・薬価専門部会
市場規模が数千億円に上るような医薬品の登場を見据え、新たな価格調整ルールを検討すべきか―中医協・薬価専門部会
2022年度薬価改革、効能評価の整合性確保・原価開示の促進・市場拡大再算定の不合理解消など進める―中医協・薬価専門部会
2022年度薬価改革に向け、新薬創出等加算の拡大、原価開示促進方策など検討―中医協・薬価専門部会
特許期間中は薬価を維持する仕組みを構築することで、日本国内での新薬開発が活性化―中医協・薬価専門部会
2022薬価改定、新規後発品の価格設定ルール・原価計算方式の在り方・イノベーション評価などが重要論点―中医協・薬価専門部会




