「非代償性肝硬変へのハーボニー投与」、5種類目の患者申出療養に―患者申出療養評価会議
2018.8.23.(木)
非代償性肝硬変疾患の患者に対し、大阪大学医学部附属病院において、適応外薬であるハーボニー配合錠(一般名:レジパスビル アセトン付加物、ソホスブビル)を12週間投与する―
8月23日に開催された「患者申出療養評価会議」(以下、評価会議)で、こうした技術が5種類目の患者申出療養として認められました。保険診療と保険外診療との併用が認められます。

8月23日に開催された、「第10回 患者申出療養評価会議」
目次
進行した非代償性肝硬変治療に、C型肝炎治療薬のハーボニー投与は有効か
患者申出療養は、一昨年(2016年)4月1日からスタートした新たな保険外併用療養制度(保険診療と、未承認の抗がん剤などの保険外診療との併用を認める仕組み)です。「海外で開発された未承認(保険外)の医薬品や医療機器を使用したい」などの患者からの申し出を起点として、安全性・有効性を評価会議で確認した上で、保険診療との併用を可能とするものです。
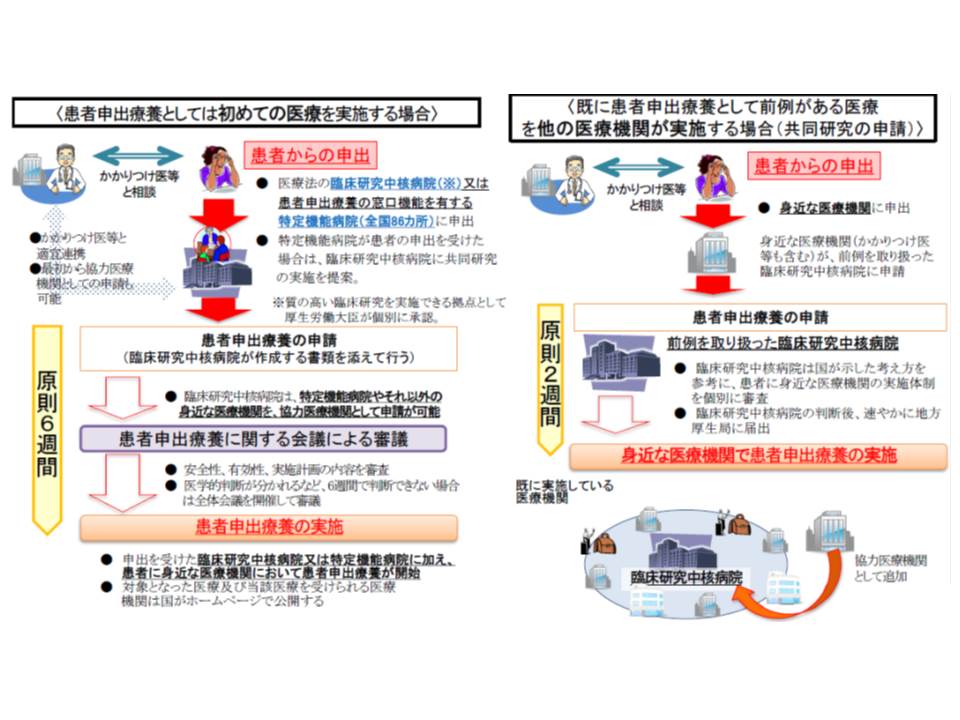
前例のない医療技術については原則6週間で保険外併用の可否を判断し、前例のある医療技術については原則2週間で「身近な医療機関での実施」の可否を判断する
これまでに、次の4種類の患者申出療養が認められています。
(1)腹膜播種・進行性胃がん患者への「パクリタキセル腹腔内投与及び静脈内投与並びにS-1内服併用療法」(2016年10月14日告示、東京大学医学部附属病院ほか18の協力医療機関で、121名に実施予定)
(2)心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」(2017年3月3日告示、大阪大学医学部附属病院で6名に実施予定)
(3)難治性天疱瘡患者への「リツキシマブ静脈内投与療法」(2017年5月2日告示、慶應義塾大学病院で10名に実施予定)
(4)髄芽腫、原始神経外胚葉性腫瘍または非定型奇形腫様ラブドイド腫瘍患者への「チオテパ静脈内投与、カルボプラチン静脈内投与及びエトポシド静脈内投与並びに自家末梢血幹細胞移植術の併用療法」(2017年5月2日告示、名古屋大学医学部附属病院で5名に実施予定)
今般、5種類目の患者申出療養として、冒頭の「非代償性肝硬変疾患の患者に対するハーボニー投与」が認められました。
ハーボニーは、現在、セログループ1(ジェノタイプ1)またはセログループ2(ジェノタイプ2)の▼C型慢性肝炎▼C型代償性肝硬変—治療に適用が認められていますが、さらに進行した「C型非代償性肝硬変」治療には、本剤を保険診療で用いることができません(あえて使用する場合には、全額患者負担の自由診療となる)。
現時点では、我が国において「抗ウイルス剤によるC型非代償性肝硬変治療」は承認されておらず(次に述べるように承認申請中)、「対症療法」や「肝移植」を待つよりありません。
もっとも、ハーボニーの開発メーカーであるギリアド・サイエンシズ社では、ハーボニーとは異なる「ソホスブビル・ベルパタスビル配合錠」(欧州での販売名はエプクルサ)を、C型非代償性肝硬変治療薬として承認申請中です。このため、「進行した非代償性肝硬変」患者が、新薬(ソホスブビル・ベルパタスビル配合錠)による治療を希望しましたが、残念なことに▼治験はすでに終了し、今後の予定もない▼薬事承認の申請中であり、保険診療の対象とならない▼先進医療としての実施も困難である(薬剤が高額で、多くの患者も見込めない)―という状況でした(つまり、当該新薬による治療は困難)。このため、今般、「適応外薬であるハーボニーを患者申出療養として使用したい」との要望を行ったものです。評価会議の成川衛構成員(北里大学大学院薬学研究科医薬開発学教授)は、「ハーボニーによってC型肝炎ウイルスが激減すれば、肝機能の向上も期待できる」とコメントしています。
なお米国では、「ハーボニー+リバビリン」の併用療法が、非代償性肝硬変治療に有効であるとして2016年に承認されていますが、我が国では「リバビリンは重度の肝機能障害のある患者荷は禁忌」とされていることなどを踏まえ、阪大病院では「ハーボニーの単剤投与」を選択しています。
保険給付されない「患者申出療養に係る費用」は487万6000円と、非常に高額です(ハーボニー錠は高額であり、保険給付の対象とならないため)(保険給付される費用は35万円)。
当該技術の対象患者は「1名」、2人目以降の希望者が現れた場合には、都度、検討
ところで、患者申出療養は、「病魔と闘う患者が、早期に『最新の医療技術』にアクセスできるようにする」仕組みですが、いわゆる混合診療を認めるものではなく、「当該技術の保険収載」を目指し、臨床研究として実施することとされています。そこで、臨床研究中核病院で「実施計画書」を作成する必要がありますが、あまりに厳密な計画書作成を求めれば、患者の当該医療技術へのアクセスが、それだけ遅くなります(関連記事はこちら)。
非代償性肝硬変は、肝機能が維持できなくなる重度の肝硬変であり、腹腔鏡により「非代償性」と診断された肝硬変の50%生存期間は2.1か月という研究論文もあります。このため、まさに「一刻も早い医療技術へのアクセス」が必要とされ、今般、わずか「1症例」のみ(つまり当該申し出を行った患者のみ)を対象として、患者申出療養が認められることとなりました。
1症例の治療成績をもって、当該技術の「有効性」「安全性」を判断することは困難ですが、阪大病院では3年間の追跡を行い、▼重篤な有害事象の発生状況(安全性)▼有害事象発生状況(同)▼早期死亡状況(同)▼治療関連死亡の発生状況(同)▼治療終了後のC型肝炎ウイルス排除率(有効性)▼肝予備能改善効果(同)▼肝発がん抑制効果(同)—などを評価指標として、有効性・安全性を探索する考えであり、「患者へ迅速に最新技術を提供する」ことと「保険収載を目指す」こととのバランスを無視したものとは言えないようです。
なお、前述のように非代償性肝硬変治療の新薬が薬事承認待ちの状況であることなども踏まえ、今後、同様に「非代償性肝硬変治療にハーボニーを用いたい」との要望が出てきた場合には、都度、厚労省・企業・評価会議で「どのような手法が最適か」を探っていく(新薬が承認されれば保険診療が可能となるが、そうでない場合には、今般の患者申出療養に組み入れるのか、あるいは未承認薬の提供を依頼するなど別の手法をとるのか、などを検討)ことになります。
本技術を患者申出療養として認めることに評価会議で異論は出ませんでしたが、委員からは「企業等に対し、患者申出療養の趣旨や仕組みなどを、これまで以上に周知していく必要があるのではないか」との指摘が多数出ています。
未承認・適応外の医療技術を用いた治療を受けるためには、「先進医療」や「治験」「拡大治験」(人道的見地からの治験)などをまず検討し(対象患者の拡大など)、そこに該当しない患者を「患者申出療養」で救済するという順序が決まっています(関連記事はこちらとこちら)。評価会議の石川広己構成員(日本医師会常任理事)は、医師会内で「まず拡大治験の実施などを企業側に要請するべきではないか」といった意見が出たことを紹介(拡大治験などの対象となれば、患者の費用負担はごくわずかで済み、医療保険財政への影響も微々たるものとなる)。さらに企業側に「医薬品の無償提供協力などを求めてはどうか」といった見解も述べました。
しかし、治験の拡大などは企業にとって極めて大きな負担(費用や時間、計画の見直しなど)となるため、「医薬品を無償提供せよ、それをしないのは非協力的だ」と単純に批判することはできません。この点に関連して、福井次矢座長(聖路加国際病院院長)や上村尚人構成員(大分大学医学部臨床薬理学講座教授、当該技術については利益相反の関係で決議には参加せず)は「薬事承認の申請中に、別ルート(例えば患者申出療養など)で有害事象が生じた場合、審査に影響が出る可能性があることなども企業は懸念していると思う。その点についてプロテクトしてあげるような仕組みも必要かもしれない」との考えを述べています。

まず治験や先進医療の実施の可否を考慮し、その上で患者申出療養の適否を検討することになるが、柔軟な運用がなされる
1種類目の患者申出療養、一部施設では実施・追跡調査が終了
また、上記(1)(1種類目)の患者申出療養である「腹膜播種・進行性胃がん患者への「パクリタキセル腹腔内投与及び静脈内投与並びにS-1内服併用療法」については、一部の協力施設(▼大阪警察病院▼斗南病院▼自治医科大学附属病院▼坪井病院▼福井大学医学部附属病院▼愛知県がんセンター中央病院▼北野病院▼九州医療センター▼福島県立医科大学附属病院▼国立国際医療研究センター▼群馬大学医学部附属病院―)で追跡調査を含めた実施が終了し、協力施設の取り下げがなされたことが報告されました(他施設では実施中)。他の協力施設も含めた全121症例での実施・追跡調査が終了した後に、「総括報告」が臨床研究中核病院である東京大学医学部附属病院からなされます。ただし、全症例の終了時期は不明なため、天野慎介構成員(全国がん患者団体連合会理事長)から「中間報告を求めてはどうか」との提案がなされています。
なお、天野構成員は、病魔と闘う患者が、より迅速に最新医療技術へアクセスできるよう「患者申出療養の手続き簡素化」も提案しています。この点、5種類の技術の運用状況などを十分に踏まえる必要があり、厚労省保険局医療課の森光敬子課長は「検討する」との答弁にとどめています。
【関連記事】
阪大病院での患者申出療養すべてで死亡含む重篤事象が発生、適切な患者選択を―患者申出療養評価会議
有効性・安全性の確立していない患者申出療養、必要最低限の患者に実施を—患者申出療養評価会議
心移植不適応患者への植込み型人工心臓DT療法、2例目の患者申出療養に―患者申出療養評価会議
2018年度改定に向けて、入院患者に対する「医師による診察(処置、判断含む)の頻度」などを調査―中医協総会
患者申出療養、座長が審議の場を判断するが、事例が一定程度集積されるまでは本会議で審議―患者申出療養評価会議
患者申出療養評価会議が初会合、厚労省「まずは既存の先進医療や治験の活用を」
患者申出療養の詳細固まる、原則「臨床研究」として実施し、保険収載を目指す―中医協
患者申出療養の提案受けた臨床研究中核病院、「人道的見地からの治験」の有無をまず確認―中医協総会
大病院受診、紹介状なしの定額負担など16年度から-医療保険部会で改革案まとまる





