患者申出療養でも「未承認薬等の投与は大学病院、日常的な観察は近隣病院」との役割分担を認めてはどうか—患者申出療養評価会議
2025.6.23.(月)
16番目の患者申出療養「ALS患者への未承認薬『EPI-589』再投与」を終了する。安全性に問題はなかったが、症状の増悪が見られた。ただしALSが進行したために、薬剤の効果が現れにくかった背景もある—。
6月20日に開催された患者申出療養評価会議で、こういった総括報告書が了承されました。本来なら、このデータも踏まえて「薬剤の薬事承認・保険適用」へと進むことが期待されますが、本剤については国内での開発は中止され、海外でも研究開発は未定となっています。
また同日には「実施医療機関と『連携する医療機関』で患者申出療養の一部を行う」ことを認める方針も概ね了承されました。今後、具体的な申請を待って詳細を議論していきます。

6月20日に開催された「第61回 患者申出療養評価会議」
16番目の患者申出療養「ALSへの未承認薬EPI-589再投与」を終了
「未承認や適応外の医薬品・医療機器等を用いた診療」については安全性・有効性が確認されていないため、医療保険制度では、これらを使用した場合には「保険診療部分も含めて、すべてが自己負担になる」のが原則です(混合診療の禁止)。しかし、この原則を貫くと「現在、傷病と闘っている患者」が最新の医療技術に極めてアクセスしにくくなるという問題点もあり、「保険診療」と「未承認や適応外の医薬品・医療機器等を用いた診療」との併用を一定の範囲内で認める仕組みも準備されています(先進医療、患者申出療養など)。
患者申出療養は、傷病と闘う患者による「海外で開発された未承認(保険外)等の医薬品や医療機器を使用してみたい」という希望・申し出を起点に、当該医療技術(未承認の医薬品等)に一定の安全性・有効性があることを評価会議で確認した上で、保険診療との併用を許可するものです(2016年4月スタート)。
これまでに、次の18種類の患者申出療養が認められています(ただし「1」「2」「3」「4」「5」「6」「7」「9」「10」「11」「12」「13」「16」の技術がすでに新規患者の登録終了、対象技術の保険適用等による取り下げとなっている)。
(1)腹膜播種・進行性胃がん患者への「パクリタキセル腹腔内投与および静脈内投与ならびにS-1内服併用療法」
(2)心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」(関連記事はこちら)
(3)難治性天疱瘡患者への「リツキシマブ静脈内投与療法」(関連記事はこちら)
(4)髄芽腫、原始神経外胚葉性腫瘍または非定型奇形腫様ラブドイド腫瘍患者への「チオテパ静脈内投与、カルボプラチン静脈内投与およびエトポシド静脈内投与ならびに自家末梢血幹細胞移植術の併用療法」(関連記事はこちら)
(5)ジェノタイプ1型C型肝炎ウイルス感染に伴う非代償性肝硬変患者への「レジパスビル・ソホスブビル経口投与療法」(関連記事はこちら)
(6)進行固形がん(線維芽細胞増殖因子受容体に変化を認め、従来治療法が無効、かつインフィグラチニブによる治療を行っているものに限る)患者への「インフィグラチニブ経口投与療法」(関連記事はこちら)
(7)早期乳がん患者への「ラジオ波熱焼灼療法」(関連記事はこちら)
(8)遺伝子パネル検査でactionableな遺伝子異常を有すると判断された固形腫瘍に対する「マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」(関連記事はこちらとこちら)
(9)HER2陽性の手術不能または再発の乳房外パジェット病患者に対する「トラスツズマブ エムタンシン(カドサイラ点滴静注用)静脈内投与療法」(関連記事はこちら)
(10)ROS1融合遺伝子陽性の進行性小児脳腫瘍患者に対する「エヌトレクチニブ(販売名:ロズリートレクカプセル)の経口投与療法」(関連記事はこちら)
(11)免疫グロブリンGサブクラス4自己抗体陽性難治性慢性炎症性脱髄性多発神経炎患者に対する「リツキシマブ追加投与療法」(関連記事はこちら)
(12)BRAFV600変異陽性の進行性神経膠腫を有する小児を対象とした「ダブラフェニブ・トラメチニブ併用療法」(関連記事はこちら)
(13)BRAFV600変異陽性の局所進行・転移性小児固形腫瘍に対する「ダブラフェニブ・トラメチニブの第II相試験」(関連記事はこちら)
(14)EZH2阻害薬の有効性が期待される標準治療がない、または治療抵抗性の小児・AYA悪性固形腫瘍に対する「タゼメトスタット療法」(関連記事はこちら)
(15)胸部悪性腫瘍に対する「経皮的凍結融解壊死療法」(関連記事はこちらとこちら)
(16)筋萎縮性側索硬化症(ALS)に対する「EPI-589再投与」の安全性に関する研究こちら)
(17)線維芽細胞増殖因子受容体阻害薬投与歴のある進行固形がん患者に対するペミガチニブ経口投与療法(関連記事はこちら)
(18)小児・AYAがんに対する遺伝子パネル検査結果等に基づく複数の分子標的治療(関連記事はこちら)
6月20日の会合では、「16」の医療技術が終了したことを受け、総括報告書のとりまとめ論議を行いました。
「16」の技術は、国内外ともに未承認の「EPI-589」という医薬品を医師主導治験で投与されていた筋萎縮性側索硬化症(ALS)患者が、「同剤投与で一定の状態改善が見られたので、医師主導治験後もこの薬を使用したい」と要望し、その要望に応える形で患者申出療養としての実施が認められたものです(関連記事はこちら)。
▽対象患者:先行する医師主導治験(DA350103試験、下図の上段中央)を受け安全性、忍容性に問題のない筋萎縮性側索硬化症患者
▽目的:「EPI-589再投与」の安全性・忍容性を評価する
▽評価項目:「安全性」「改訂版ALS機能評価スケールによる有効性」
▽症例数見込み:3症例
▽予定期間:2024年12月まで
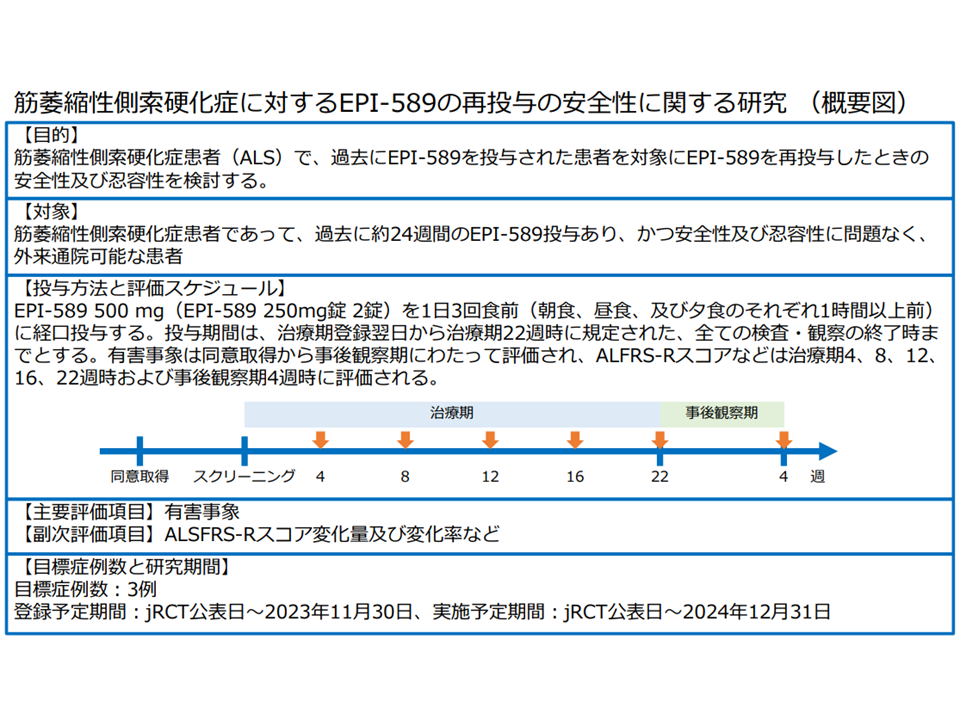
16番目の患者申出療養「筋萎縮性側索硬化症(ALS)に対するEPI-589再投与の安全性に関する研究」の概要(患者申出療養評価会議1 230622)

16番目の患者申出療養「筋萎縮性側索硬化症(ALS)に対するEPI-589再投与の安全性に関する研究」の薬事承認間でのロードマップ(患者申出療養評価会議2 230622)
予定期間までに「1例」の患者に本技術が実施され、今般、次のような有効性・安全性の結果が示されました。
【有効性】
▽ALSの機能評価を行う「ALSFRS-R」合計点はスクリーニング時(患者申出療養スタート前)に33点だったが、徐々に減少し、治療期22週には19点となった(変化量は4週当たり2.5点の増悪)
▽医師主導試験の終了から本治療開始までの間の同変化量は4週当たり0.8点であったため、「明らかな有効性」は認められない
▽肺活量を評価する「%SVC」についても、スクリーニング時の50.1から治療期22週には28.6となり、増悪を示していた
▽非侵襲的呼吸補助装置の終日装着、侵襲的呼吸補助装置の装着、または死亡は見られなかった
【安全性】
▽有害事象の発現はなかった
▽臨床検査値については血中クレアチニンキナーゼ(CK)値の軽度上昇があったが、スクリーニング時にすでに高値であり、「治療開始後の更なる上昇はなく、被検薬とは無関係の原疾患による影響」と考えられた(その他の臨床検査値の異常変動はなし)
▽バイタルサインの異常変動もみられなかった
▽体重はスクリーニング時の59.0kgから治療期22週には52.5kgに減少したが、被検薬による影響ではなく、「経過観察中の嚥下障害の進行に伴う経口食事摂取量の低下」によるものと考えられた
この結果を踏まえて、評価主担当者である近藤直樹構成員(国立がん研究センター東病院薬剤部薬剤部長)は、▼安全性・忍容性には問題はなかった▼治療期間中に増悪したが、「病態の進行とともに、本薬による抑制効果が得られにくくなっていた」ことが考えられる—とし、本薬を含め、今後、ALS薬剤の開発を行うにあたっては「早期診断法の確立」と「診断後できるだけ早期からの治療介入」が必要と指摘しています(ALS進行によって、薬剤効果が十分に出ず、状態が増悪した可能性あり)。評価副担当者である新谷歩構成員(大阪公立大学大学院医学研究科医療統計学教授)も同様の考えを示しています。
ところで患者申出療養も、先進医療と同様に「試験データを活用して、未承認薬や適応外薬の保険適用を目指す」仕組みであり、上記のデータも、「わずか1症例」ではあるものの、今後の「薬剤の保険適用」に利活用されることが期待されます。
ただし、本薬剤については▼国内企業は開発中止▼権利元の米国企業は、今後、開発を進める予定はあるものの、詳細は未定—であり、今回データも含めて「保険適用に向けた動き」が活発化することは期待できない状況です。
近藤構成員は「研究。開発の再開の可能性は不明だが、本薬剤の有効性や安全性を示すデータを改めて精査しておく」ことを考慮すべきと進言しています。
患者申出療養でも「未承認薬等の投与は大学病院、日常的な観察は近隣病院」との役割分担
また6月20日の会合では「分散型の臨床試験の患者申出療養での活用」に関する議論も行われました。
「治験実施医療機関にまで来院せず、近隣のパートナー医療機関で経過観察等を行う」分散型治験(Decentralized Clinical Trial:DCT)が普及してきています。分散型治験(DCT)では、治験実施医療機関が「治験実施医療機関以外のパートナー医療機関」と業務の範囲に係る委託契約を締結し、治験実施業務の一部を実施することになります(経過観察、有害事業への一次対応など)。
患者申出療養でも、実施医療機関は主に大学病院等であり、患者の通院負担が大きいことなどから、「実施医療機関の要件を満たさない医療機関が、DCTのパートナー医療機関に相当するものとして参画できないか」との検討が現場で始まっているようです。
そこで、厚労省は次のような対応案を提示しました。
▽患者申出療養制度において、DCTパートナー医療機関に相当するものを、現行の実施医療機関とは異なる「分散型臨床試験連携医療機関」と位置づけてはどうか
▽患者申出療養制度における「分散型臨床試験連携医療機関」は、実施医療機関に求められる手続きは不要とし、「分散型臨床試験連携医療機関」の要件は患者申出療養実施届出書・研究実施計画書に記載することとする
▽患者申出療養制度において、「分散型臨床試験連携医療機関」の施設要件を満たすかどうかの確認は、治験の場合にならって、当該申出に係る医療機関において行うこととする
▽実施医療機関と「分散型臨床試験連携医療機関」の違いは以下の通りとしてはどうか
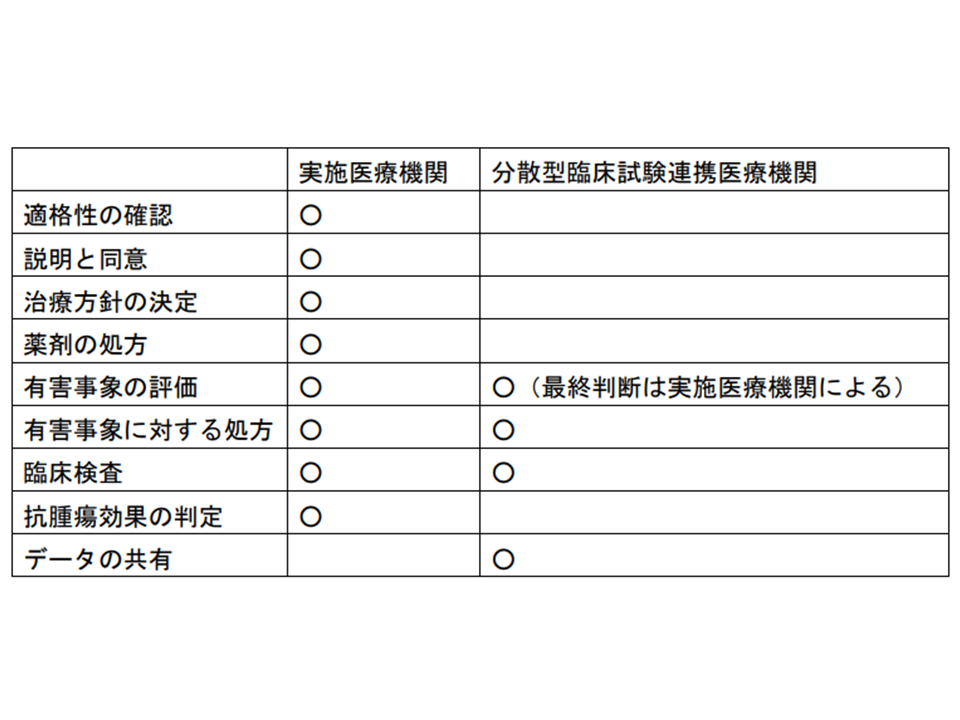
実施医療機関と分散型臨床試験連携医療機関との役割分担イメージ(患者申出療養評価会議 250620)
▽実施医療機関と「分散型臨床試験連携医療機関」の想定される役割は大きく異なるため、▼当該申出に係る医療機関がその要件と医療機関名を試験実施計画に記載することとし、「分散型臨床試験連携医療機関」の追加があった場合は当該申出に係る医療機関がその適格性を確認した上で保険局医療課に報告する▼必要に応じて患者申 出療養評価会議で審議する—こととする
患者申出療養においても、例えば「患者のアクセス」を考慮して、実施医療機関(大学病院など)とは別の「分散型臨床試験連携医療機関」での経過観察や有害事象発生時の一次対応などを行う仕組みを設けるものです。
ただし、「分散型臨床試験連携医療機関」の要件をどう設定するか、「分散型臨床試験連携医療機関」の役割をどう設定するか、などは個別の技術によって大きく異なる(上記(1)から(18)では、それぞれ使用する薬剤の種類や投与方法、患者の状態なども大きく異なる)ため、具体的な内容は「個別の申請」を踏まえて検討していくことになります。
いわば「実施医療機関(大学病院など)とは別の、患者の近隣の医療機関での経過観察などを可能とする」という枠組みを6月20日の会合で設けることを了承し、詳細は今後、個別に検討していくイメージです。
構成員からは、▼実施医療機関と分散型臨床試験連携医療機関との「責任の範囲」を明確にする必要がある。患者申出療養では海外でも未承認の医薬品を用いることもあり、リスクも高く、不確かなことも多い。患者アクセスも重要だが、「患者の安全性確保」を最優先に考えなければならない(松井健志構成員:国立がん研究センターがん対策研究所生命倫理・医事法研究部長)▼DCTのような仕組みが患者申出療養でも可能になると良い、安全性に配慮しながら積極的に進めるべき(天野慎介構成員:全国がん患者団体連合会理事長)▼実施医療機関と分散型臨床試験連携医療機関との役割分担について、モニタリングなども含めて詳細に検討していく必要がある(近藤構成員)▼▼この仕組みにより、被検者のリクルートが比較的容易になり、症例確保がしやすくなることも期待できる(福井 次矢座長:日本薬科大学学長)—などの意見が出ています。
今後、個別の技術申請があり、その中で「分散型臨床試験連携医療機関を定めたい」との計画が上がってきた際に、上記の構成員意見も参考に「分散型臨床試験連携医療機関の要件設定や役割分担は適切か」といった議論が行われる見込みです。
松井構成員の指摘するように「安全性を最優先」に考えたうえで、分散型臨床試験連携医療機関を定めることで、例えば「未承認の薬剤は大学病院などの実施医療機関で受ける」→「平時の健康確認やデータ取集のための採血、有害事象が生じた場合の一次対応などは、近隣のかかりつけ医療機関で受ける」こととすれば、患者サイドは患者申出療養をより活用しやすくなると期待されます。今後の動きに注目が集まります。
【関連記事】
北大病院、岡山大病院でも「小児・AYA世代のがん患者へ最適な抗がん剤治療を可能とする患者申出療養」を開始—患者申出療養評価会議
6番目の患者申出療養「進行固形がんへのインフィグラチニブ投与」、有効性等評価は困難も、患者希望に応える重要な意味―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、メキニスト小児ドライシロップを対象薬剤に追加―患者申出療養評価会議
「最適だが保険適応外の抗がん剤」を保険診療と併用するための患者申出療養、薬剤の添付文書改訂踏まえ実施計画見直し―患者申出療養評価会議
岡山大病院でも、小児がん患者が「遺伝子検査に基づいた最適な抗がん剤」治療を受けられる環境を整備—患者申出療養評価会議
15番目の患者申出療養「胸部悪性腫瘍に対する経皮的凍結融解壊死療法」、患者負担を考慮して実施期間を18か月延長—患者申出療養評価会議
より身近な施設で、小児がん患者が、遺伝子検査に基づいた「最適な抗がん剤」治療を受けられる環境を整備—患者申出療養評価会議
BRAFV600変異陽性グリオーマ小児へのダブラフェニブ・トラメチニブ併用療法、腫瘍縮小などの優れた成果―患者申出療養評価会議
小児・AYAがん患者へ「効果ある未承認等の分子標的薬」を迅速投与する仕組み、製薬メーカー協力で対象薬剤さらに拡大―患者申出療養評価会議
1番目の患者申出療養「進行性胃がんへのパクリタキセル・S-1併用療法」最終評価、対象患者絞り標準治療との比較を―患者申出療養評価会議
小児・AYAがん患者へ「効果のある未承認等の分子標的薬」を迅速投与できる仕組み、メーカー協力で対象薬剤を拡大―患者申出療養評価会議
13番目の患者申出療養、「BRAF V600変異陽性の小児固形がん」への抗がん剤併用療法を条件付きで承認―患者申出療養評価会議
進行性胃がんへのパクリタキセル・S-1併用療法、乳房外パジェットへのカドサイラ投与など実施計画見直し―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、ニラパリブを対象薬剤に追加―患者申出療養評価会議
耳介後部コネクター用いるDT療法の有効性に期待、遺伝子パネル検査による抗がん剤治療で対象薬剤追加―患者申出療養評価会議
患者申出療養から「初の薬事承認・保険適用」技術登場、抗がん剤「適応拡大」にも期待集まる―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、リキッドバイオプシーも検査対象に追加―患者申出療養評価会議
12番目の患者申出療養、「BRAF V600変異陽性の小児神経膠腫」への抗がん剤併用療法を承認―患者申出療養評価会議
11番目の患者申出療養として、難病CIDPへのリツキシマブ追加投与療法を認める―患者申出療養評価会議
患者申出療養で実施される保険外の医療技術、しかるべき時期に安全性・有効性の評価が必要—患者申出療養評価会議
患者申出療養の計画変更を了承、ただし「野放図な期間延長」などは好ましくない―患者申出療養評価会議
10番目の患者申出療養として、小児脳腫瘍へのエヌトレクチニブ投与療法を認める―患者申出療養評価会議
小児がん患者も迅速に「適応外の分子標的薬」にアクセスできる環境を整備―患者申出療養評価会議(2)
乳房外パジェットへのカドサイラ投与、9番目の患者申出療養として導入―患者申出療養評価会議(1)
小児がん患者が「最適な抗がん剤にアクセスしやすい環境」の整備に向け、患者申出療養を拡充―患者申出療養評価会議
遺伝子パネル検査に基づく「適応外抗がん剤」使用、患者申出療養での実施を承認―患者申出療養評価会議
遺伝子パネル検査に基づく抗がん剤の適応外使用想定した事前準備、国がんで進む―患者申出療養評価会議
患者申出療養評価会議からメーカーに「薬剤等供給」協力を要請する仕組み設ける―患者申出療養評価会議
早期乳がんのラジオ波熱焼灼治療を患者申出療養に導入、再発リスク説明等が必要―患者申出療養評価会議
遺伝子パネル検査で「適応外の抗がん剤治療」の可能性ある場合、迅速に治療開始できる準備進める―患者申出療養評価会議
「非代償性肝硬変へのハーボニー投与」、5種類目の患者申出療養に―患者申出療養評価会議
阪大病院での患者申出療養すべてで死亡含む重篤事象が発生、適切な患者選択を―患者申出療養評価会議
有効性・安全性の確立していない患者申出療養、必要最低限の患者に実施を—患者申出療養評価会議
心移植不適応患者への植込み型人工心臓DT療法、2例目の患者申出療養に―患者申出療養評価会議
2018年度改定に向けて、入院患者に対する「医師による診察(処置、判断含む)の頻度」などを調査―中医協総会
患者申出療養、座長が審議の場を判断するが、事例が一定程度集積されるまでは本会議で審議―患者申出療養評価会議
患者申出療養評価会議が初会合、厚労省「まずは既存の先進医療や治験の活用を」
患者申出療養の詳細固まる、原則「臨床研究」として実施し、保険収載を目指す―中医協
患者申出療養の提案受けた臨床研究中核病院、「人道的見地からの治験」の有無をまず確認―中医協総会
大病院受診、紹介状なしの定額負担など16年度から-医療保険部会で改革案まとまる





