患者申出療養評価会議からメーカーに「薬剤等供給」協力を要請する仕組み設ける―患者申出療養評価会議
2019.3.14.(木)
患者申出療養(保険診療と保険外診療を併用できる仕組み)において必要となる薬剤等についてメーカー側の協力が得られない場合には、その薬剤等の必要性やメーカー側の事情を考慮した上で、患者申出療養評価会議からメーカーに「協力を要請する」仕組みを新たに設ける―。
厚生労働省の「患者申出療養評価会議」(以下、評価会議)が3月14日に、こういった方針を固めました。

3月14日に開催された、「第15回 患者申出療養評価会議」
目次
「近く治験を開始する。治験が終了した」などの理由でメーカーが協力を拒むケースも
患者申出療養は、2016年4月1日からスタートした新たな保険外併用療養制度(保険診療と、保険外診療との併用を認める仕組み)です。傷病と闘う患者の「海外で開発された未承認(保険外)等の医薬品や医療機器を使用したい」などの希望・申し出を起点として、安全性・有効性を評価会議で確認した上で、保険診療との併用を可能とするものです。
これまでに、次の7種類の患者申出療養が認められています。
(1)腹膜播種・進行性胃がん患者への「パクリタキセル腹腔内投与及び静脈内投与ならびにS-1内服併用療法」
(2)心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」
(3)難治性天疱瘡患者への「リツキシマブ静脈内投与療法」
(4)髄芽腫、原始神経外胚葉性腫瘍または非定型奇形腫様ラブドイド腫瘍患者への「チオテパ静脈内投与、カルボプラチン静脈内投与およびエトポシド静脈内投与ならびに自家末梢血幹細胞移植術の併用療法」
(5)ジェノタイプ1型C型肝炎ウイルス感染に伴う非代償性肝硬変患者への「レジパスビル・ソホスブビル経口投与療法」
(6)進行固形がん(線維芽細胞増殖因子受容体に変化を認め、従来治療法が無効、かつインフィグラチニブによる治療を行っているものに限る)患者への「インフィグラチニブ経口投与療法」
(7)早期乳がん患者への「ラジオ波熱焼灼療法」
当然、これらの技術においては未承認等の医薬品・医療機器が必要になり、医療機関・患者が製薬企業等に「薬剤等を提供してほしい」と協力を求めることになります(無償・有償いずれの場合も)。しかし、医療機関・患者がこうした要請を行う場合、事務負担が大きく、時には「当該医薬品が手元にない」「安全性が確認されておらず、リスクが大きい」などの理由で、製薬企業からの協力が得られないこともあります。現に、上記(5)では、薬事承認前の「ソホスブビル/ベルパタスビル」(エプクルーサ配合錠、2019年2月に保険収載)の使用について「治験が終了している」として協力が得られず、適応外のハーボニー配合錠を用いた患者申出療養を行うことになりました(関連記事はこちら)。
最悪のケースでは「製薬企業等の協力が得られないために患者申出療養も受けられない」こととなってしまうことから、厚労省は「薬剤へのアクセス」を確保するために、患者申出療養制度の中で、新たに次のような仕組みを構築することを提案しました。
▽医療機関・患者が製薬企業等に協力を依頼する(ここは従前どおり)
↓
▽製薬企業等が「協力できない」と判断した場合、定められた様式に基づいて、その理由を医療機関・患者に提示する(様式1)
↓
▽医療機関・患者が、製薬企業等の理由に納得できない場合、厚労省に「当該医薬品等が必要となる根拠」などを定められた様式で提出する(様式2)
↓
▽「患者申出療養評価会議」で、▼製薬企業等の提示した理由(様式1)▼医療機関・患者の示した根拠(様式2)―を吟味し、「当該薬剤の使用が妥当である」と判断した場合、製薬企業に再検討を要請する
↓
▽製薬企業等で再検討を行う
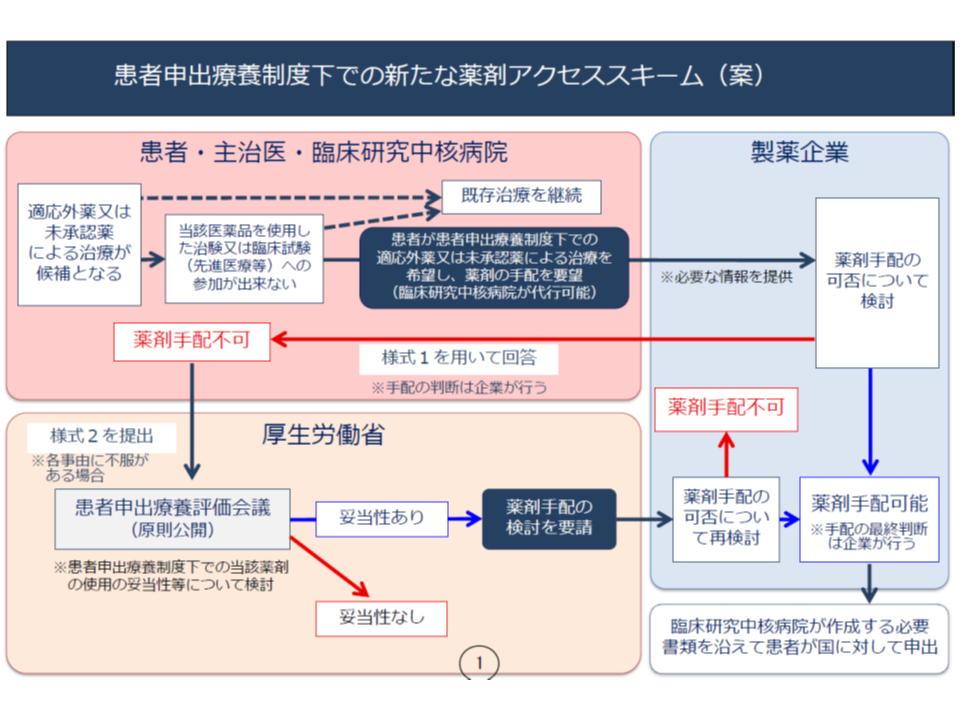
製薬企業等が協力を拒む場合、その理由はさまざまです。例えば、「当該医薬品が手元にない(権利を他社に譲渡してしまった)」といった絶対事由、「安全性が確認されていない」「他の治療法での対応が可能」といった制度的事由、「近く本治験が始まり、当該患者は治験の対象となるので、そちらに参画してほしい」といった時期的事由、「当該患者の年齢や病状を考えるとリスクが高すぎる」といった個別事由などが考えられ、ケースごとに、評価会議で「製薬企業側に理があるのか、医療機関・患者の要請に応えてもらうべきなのか」を判断することになります。
天野慎介構成員(全国がん患者団体連合会理事長)や山口俊晴構成員(がん研究会有明病院名誉院長)ら多くの構成員が、「厚労省の後ろ盾を持って、製薬企業等に要請を行える」として、この仕組みを歓迎しています。
なお、評価会議で「協力してほしい」との再検討要請が出た場合であっても、それに強制力はありません(企業側は改めて協力を拒否できる)。ただし山口委員は「可能な範囲で協力を拒否した理由などが公開されることになる(評価会議は原則公開)」とし、企業側の積極的な協力に期待を寄せています。またメーカーサイドにとっては、「適正な理由があって薬剤を提供できない」(非協力的なわけではない)ことを明確にすることができます。
厚労省では、今後、製薬企業や関係部局と調整を進め、仕組みの詳細を詰めていきます。
遺伝子パネル検査後の「適応外の抗がん剤を患者申出療養で使用したい」との要望に応える仕組み
3月14日の評価会議では、がん遺伝子パネル検査後に、患者申出療養制度で適応外の抗がん剤を使用する仕組みについても議論を行っています。
ゲノム(遺伝情報)解析技術が進み、「Aという遺伝子に変異の生じたがん患者にはαという抗がん剤を、Bという遺伝子変異のある患者にはβとγという抗がん剤を併用投与することが効果的である」などといった知見が徐々に明らかになってきています。こうしたゲノム情報に基づいて抗がん剤を選択できれば、個々のがん患者に「効果の低い治療法を避け、効果の高い、最適な治療法を実施する」ことが可能となります。
我が国でも、こうした「がんゲノム医療」を推進していくため、例えば、多数の遺伝子変異の有無を一括して検出する「遺伝子パネル検査」の開発が進められています。すでに2種類が薬事承認を受け(▼NCCオンコパネル▼FoudationOne CDx―)、別の2種類が先進医療として実施されています(▼東京大学医学部附属病院(Todai Onco Panel)▼大阪大学医学部附属病院(Oncomine Target Test)―、国立がん研究センター中央病院(NCCオンコパネル)では登録を終了)(関連記事はこちらとこちらとこちら)。
遺伝子パネル検査の結果、「xという遺伝子に変異が見つかった。これに効果のある抗がん剤はX1、X2、X3などである」という情報が国立がん研究センターの「がんゲノム情報管理センター」(C-CAT)から示され、これをがんゲノム医療中核拠点病院(11か所指定)の専門家会議(エキスパートパネル)で解釈し、当該患者に最適な抗がん剤を決定します。
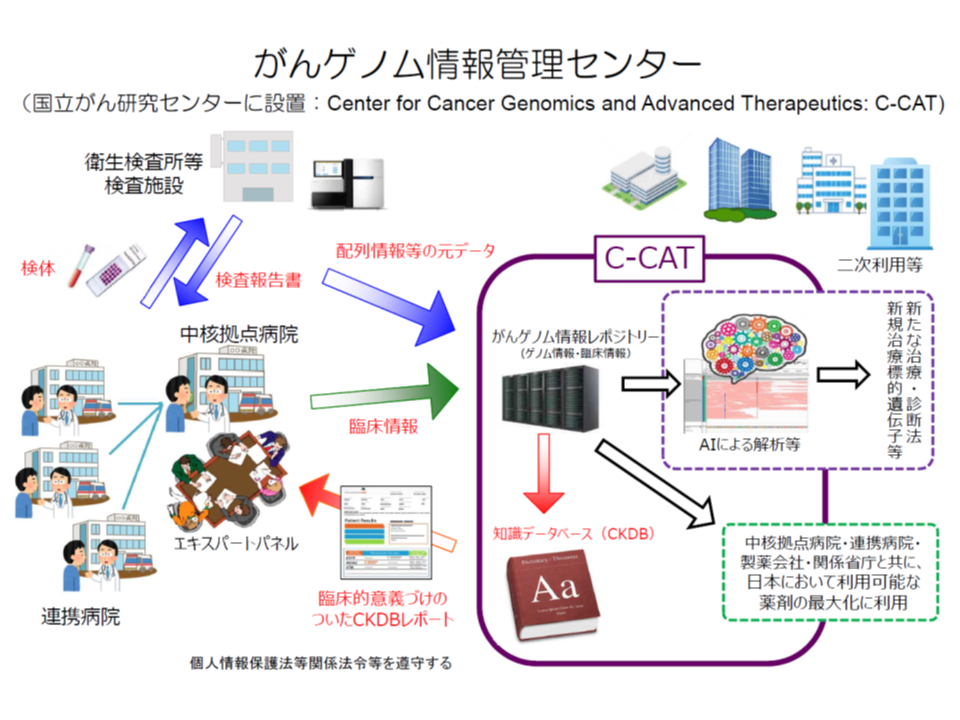
ただし、最適な抗がん剤が見つかるケースは全体の10-20%にとどまり、また、見つかったとしても「その抗がん剤が、当該患者のがん種について、薬事承認が得られていない」ケースも少なくないでしょう(X1抗がん剤はx遺伝子変異のがんに効果があるが、効能効果が「肺がん」に限られている、など)(関連記事はこちらとこちら)。
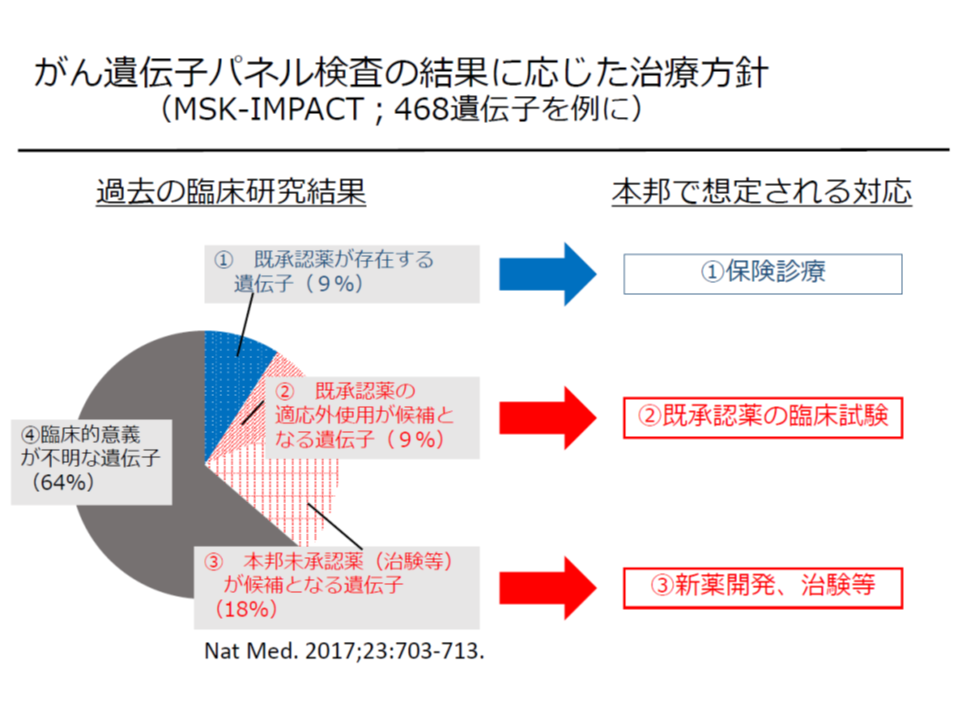
遺伝子パネル検査で治療法が見つかるケースは36%程度にとどまり、うち9%では「抗がん剤の適応外使用」が必要となる。我が国では、適応外使用を行うには、先進医療や治験、患者申出療養などの枠組みを活用することになる(さもなくば全額自己負担)
こうした場合、「私は大腸がんに罹患しておりx遺伝子の変異が分かった。保険診療では大腸がんにX1抗がん剤は使えないので、患者申出療養によってX1抗がん剤を使用したい」と希望する患者が出てくるでしょう。しかし、患者申出療養の申請をするためには、▼かかりつけ医との相談▼臨床研究中核病院への相談▼臨床研究中核病院における診療計画(プロトコル)作成―などが必要で、これらの手続きに少なくとも数か月が必要となるのです。
いまのところ、遺伝子パネル検査の対象は「標準治療を終えた患者」(再発や難治のがん患者)とされ、一刻も早く、効果の可能性の高い治療法にアクセスできる環境を整備することが必要です。そこで評価会議では、次のような「迅速に患者申出療養を申請できる仕組み」も整えました(2018年11月22日の評価会議で了承、関連記事はこちら)。
▽がん遺伝子パネル検査の結果、既承認薬(固形がん約10種類の遺伝子異常と、それに対応する約20種類の分子標的薬)の「適応外使用」を希望して患者申出療養を申請する患者を想定し、臨床研究中核病院との協議の上で、▼複数のがん腫や遺伝子異常に対応できる「研究計画書」(プロトコル)を予め作成し、臨床研究審査委員会等の審査を経ておく▼臨床研究中核病院で研究計画書を共有する▼患者の同意を得た上で「症例データを一括保存」し、活用をする―
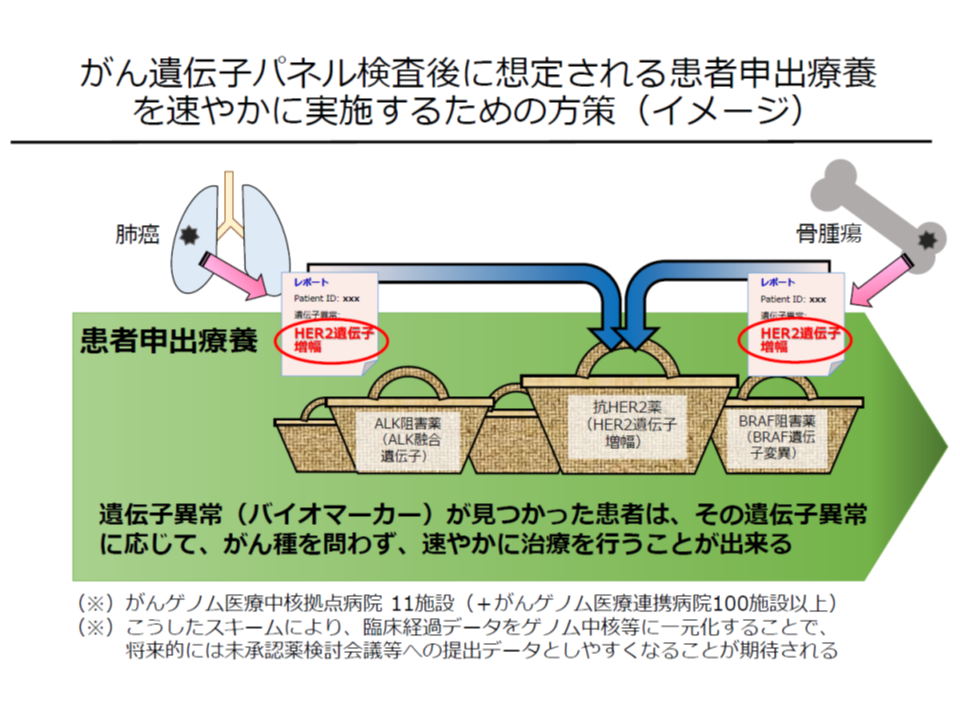
「適応外の抗がん剤」治療で効果があると判明した患者が、一刻も早く患者申出療養を申請できるよう、臨床研究中核病院で「下準備」を進めておく
この日は、「国立がん研究センターにおいて、研究計画書(プロトコル)の作成が進められており、完了次第、評価会議に報告される」ことが厚労省から報告されました。
上記の仕組みで、迅速に「抗がん剤の適応外使用」が患者申出療養として認められた場合、がんゲノム医療中核拠点病院で当該治療を実施し、その結果を踏まえて「効能効果の拡大」(=保険診療として使用可能となる)などにつなげることになります。
なお、遺伝子解析結果を解釈できる専門家等が限られていることから、当面、遺伝子パネル検査は「がんゲノム医療中核拠点病院(11か所が指定済)」と、2019年度に指定される「がんゲノム医療拠点病院(30か所予定)で、「標準治療を終えた患者」(再発・難治)に限定される見込みです(例えば、「初期の胃がんで、効果的な標準治療の適用となる患者」などは、当面は遺伝子パネル検査の対象とならない)。
患者申出療養において死亡事象も発生、対象患者を適切に選択する基準設定が必要
さらに3月14日の評価会議では、上記(2)心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」と(3)難治性天疱瘡患者への「リツキシマブ静脈内投与療法」の2種類の患者申出療養について、実施計画の見直しが検討されました。
前者(2)の心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」については、これまでに3例の患者に実施されましたが、「3例すべてで重篤な有害事象が生じている(うち2例で患者が死亡)」ことが分かりました。評価会議では「当該技術に問題があるというよりも、手術等に耐えられない全身状態の悪化した患者に当該技術を実施してしまったことが問題である」と判断し、実施計画、とくに「患者選択」基準の見直しを要請していました(関連記事はこちら)。
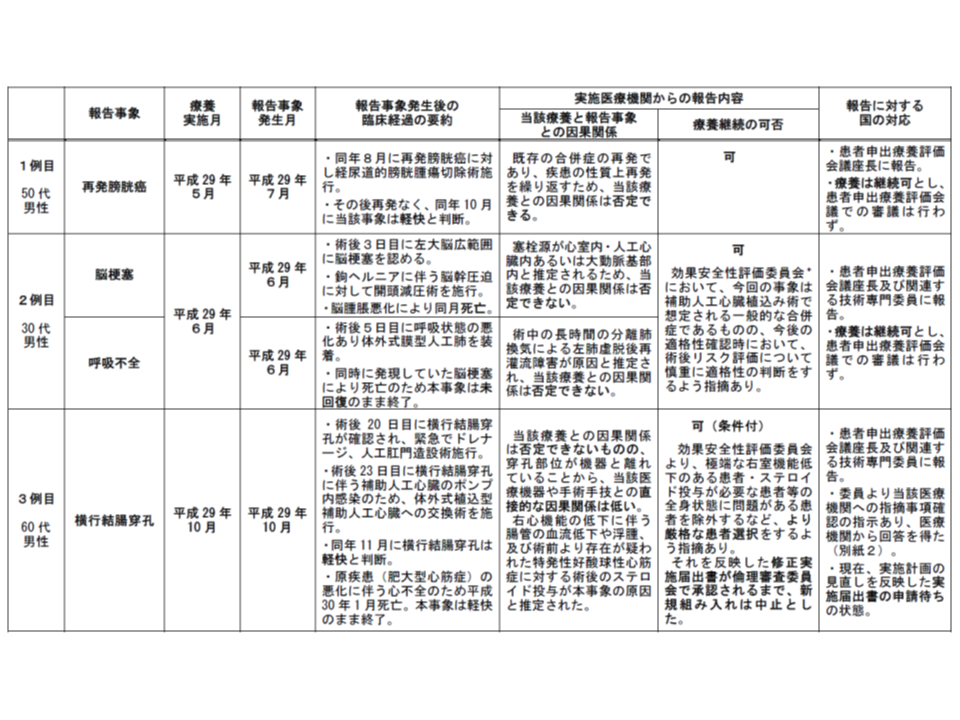
これを受け、当該技術を実施している大阪大学医学部附属病院から、▼心臓機能(右心機能)が低下し、術後右心不全で退院困難になると予想される患者▼1年以内にステロイドを1か月以上内服した既往、またはステロイド内服中の患者―を当該技術の対象から除外する考え(実施計画の見直し案)が示されたものです。
しかし、循環器内科の専門家である磯部光章技術専門委員長(日本心臓血圧研究振興会附属榊原記念病院院長)は、「評価会議が問題視したのは『全身状態の悪化した患者に、当該技術を実施した』点である。ステロイド内服をしておらずとも全身状態が悪化することはある」と指摘。評価会議として「阪大病院に再考を促す」ことを決めました。実施計画の見直し内容が了承されるまで、当該患者申出療養の実施はストップされます。
なお、(2)(3)いずれの技術とも「臨床研究法」に対応するための実施計画見直しが行われます。
また、3月14日の評価会議では、4種類目の患者申出療養である「髄芽腫、原始神経外胚葉性腫瘍または非定型奇形腫様ラブドイド腫瘍患者への『チオテパ静脈内投与、カルボプラチン静脈内投与およびエトポシド静脈内投与ならびに自家末梢血幹細胞移植術の併用療法』」の終了に伴う評価も行われました(関連記事はこちら)。
1例のみの患者に実施され、▼重篤な有害事象なし▼貧血などの非重篤な有害事象はあったが、回復・軽快▼末梢血幹細胞移植後172日目のMRIで「現病の再発」を確認―という結果が出ました。しかし、「1例のみ」の実施に過ぎず、「本治療法の安全性・有効性を論じることは早計」と評価されています。
【関連記事】
早期乳がんのラジオ波熱焼灼治療を患者申出療養に導入、再発リスク説明等が必要―患者申出療養評価会議
遺伝子パネル検査で「適応外の抗がん剤治療」の可能性ある場合、迅速に治療開始できる準備進める―患者申出療養評価会議
「非代償性肝硬変へのハーボニー投与」、5種類目の患者申出療養に―患者申出療養評価会議
阪大病院での患者申出療養すべてで死亡含む重篤事象が発生、適切な患者選択を―患者申出療養評価会議
有効性・安全性の確立していない患者申出療養、必要最低限の患者に実施を—患者申出療養評価会議
心移植不適応患者への植込み型人工心臓DT療法、2例目の患者申出療養に―患者申出療養評価会議
2018年度改定に向けて、入院患者に対する「医師による診察(処置、判断含む)の頻度」などを調査―中医協総会
患者申出療養、座長が審議の場を判断するが、事例が一定程度集積されるまでは本会議で審議―患者申出療養評価会議
患者申出療養評価会議が初会合、厚労省「まずは既存の先進医療や治験の活用を」
患者申出療養の詳細固まる、原則「臨床研究」として実施し、保険収載を目指す―中医協
患者申出療養の提案受けた臨床研究中核病院、「人道的見地からの治験」の有無をまず確認―中医協総会
大病院受診、紹介状なしの定額負担など16年度から-医療保険部会で改革案まとまる
がんゲノム医療、自分に最適な抗がん剤見つかる可能性は10-20%にとどまることなど説明を―がんゲノム医療推進コンソーシアム運営会議
がんゲノム医療の推進に向け、遺伝子パネル検査を先進医療で導入―中医協総会(1)
オプジーボの用量見直しや適応拡大などを踏まえ、最適使用推進ガイドラインを新設・改訂―中医協総会
2019年10月の消費税率引き上げ、薬価等の見直しは同時に行うべきか―中医協総会
がんゲノム医療を牽引する「中核拠点病院」として11病院を選定―がんゲノム医療中核拠点病院等指定検討会
がんゲノム医療を提供できる中核病院を、本年度(2017年度)中に7-10施設指定—がんゲノム医療懇談会
がんゲノム医療、当面は新設する「がんゲノム医療中核拠点病院」で提供―がんゲノム医療懇談会
がんとの闘いに終止符打つため、広く関係者が集い世界水準の「ゲノム医療」推進―厚労省





