阪大病院での患者申出療養すべてで死亡含む重篤事象が発生、適切な患者選択を―患者申出療養評価会議
2018.4.12.(木)
大阪大学医学部附属病院で実施された3件の患者申出療養「心移植不適応な重症心不全患者への『耳介後部コネクターを用いた植込み型補助人工心臓による療法』」すべてで患者死亡を含む重篤な有害事象が生じている。病院では当該療法の実施を中止しており、今後、実施計画の見直しが検討される―。
4月12日に開催された患者申出療養評価会議(以下、評価会議)で、こういった報告がなされました。構成員からは「技術そのものの問題というよりも、患者選択に問題があるのではないか」といった指摘がなされました。

4月12日に開催された、「第9回 患者申出療養評価会議」
適切な患者選択基準などを含め、阪大病院で実施計画見直しを検討中
患者申出療養は、一昨年(2016年)4月1日からスタートした新たな保険外併用療養制度(保険診療と、未承認の抗がん剤などの保険外診療との併用を認める仕組み)です。「海外で開発された未承認(保険外)の医薬品や医療機器を使用したい」などの患者からの申し出を起点として、安全性・有効性を評価会議で確認した上で、保険診療との併用を認めるものです。
これまでに、次の4種類の患者申出療法が認められています。
(1)腹膜播種・進行性胃がん患者への「パクリタキセル腹腔内投与及び静脈内投与並びにS-1内服併用療法」(2016年10月14日告示、東京大学医学部附属病院ほか18の協力医療機関で、121名に実施予定)
(2)心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」(2017年3月3日告示、大阪大学医学部附属病院で6名に実施予定)
(3)難治性天疱瘡患者への「リツキシマブ静脈内投与療法」(2017年5月2日告示、慶應義塾大学病院で10名に実施予定)
(4)髄芽腫、原始神経外胚葉性腫瘍または非定型奇形腫様ラブドイド腫瘍患者への「チオテパ静脈内投与、カルボプラチン静脈内投与及びエトポシド静脈内投与並びに自家末梢血幹細胞移植術の併用療法」(2017年5月2日告示、名古屋大学医学部附属病院で5名に実施予定)
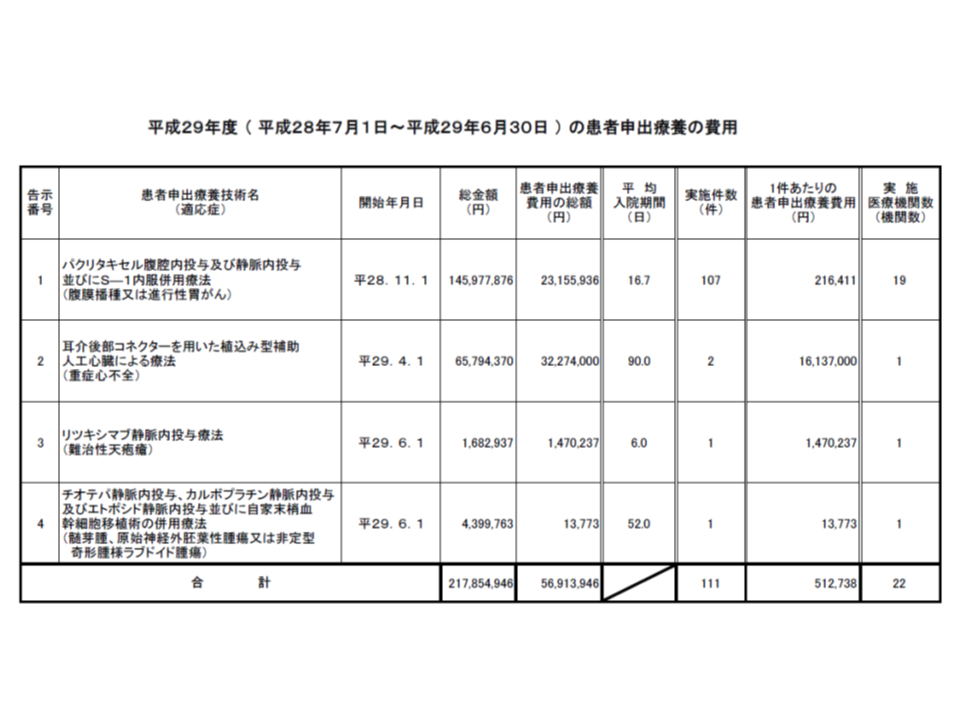
昨年6月(2017年6月まで)の患者申出療養の状況(7月移行に実施されている症例もあるが、この中には含まれていない)
このうち(2)の心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」は、これまでに3件実施されていますが、そのすべてで死亡を含む重篤な有害事象が生じていることが阪大病院から報告されました。具体的には、▼膀胱がんの再発(後に軽快。当該患者申出療養との因果関係は否定できる)▼脳梗塞・呼吸不全(患者は死亡。当該患者申出療養との因果関係は否定できないが、人工心臓植込み術で一般的に想定される合併症である)▼横行結腸穿孔(患者は死亡。当該患者申出療養との因果関係は低いと推測される)—の3件です(関連記事はこちら)。
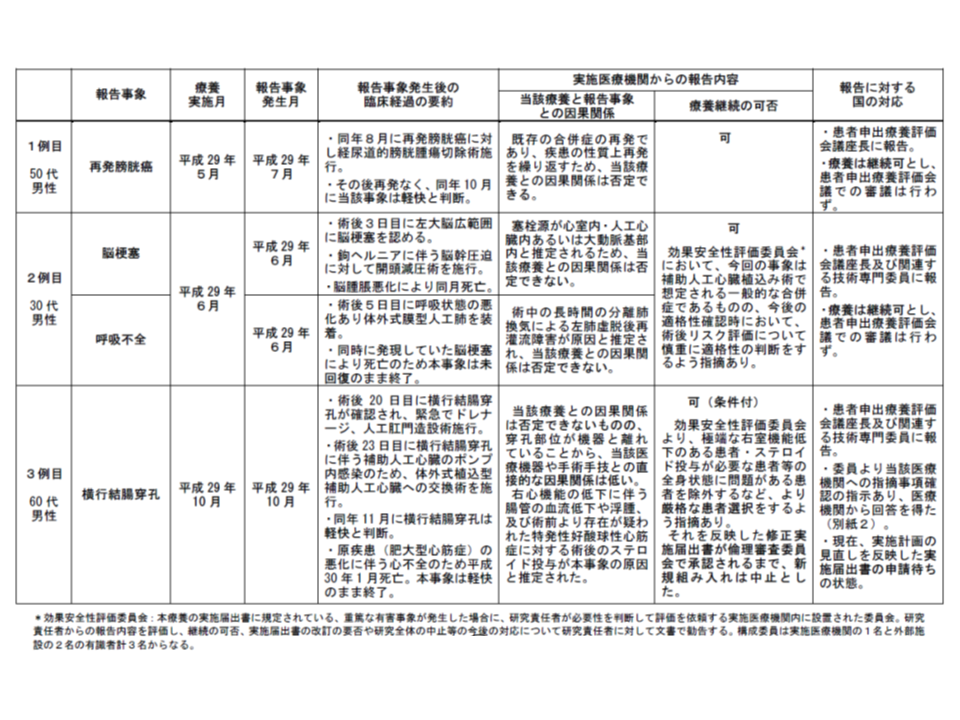
阪大病院で行われた、心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」は3件あり、すべてで重篤な有害事象が生じた(2件は患者が死亡)
評価会議および技術評価委員は、とくに3件目の「横行結腸穿孔による患者死亡」に注目。検証を行った磯部光明技術専門委員(日本心臓血圧研究振興会附属榊原記念病院院長)は、▼人工心臓植込み術で特に予測される合併症ではない▼しばしば腸管にダメージを与える「好酸球」が異常に増加しており、その治療の直後に人工心臓植込みを実施している―ことなどを説明し、「人工心臓植込みの手術が直接の原因となって穿孔を生じさせたとは考えにくいが、あまりに重篤な患者に当該手術を実施したことが死亡の引き金になった可能性は否定できない」旨をコメント。また直江知樹構成員(名古屋医療センター院長)は、「阪大病院で、当該患者における好酸球増加症などを把握していたのか」という点を重視しています(現在、厚生労働省から阪大病院へ照会中)。
阪大病院からのより詳細な報告が待たれますが、評価会議では「当該患者申出療養の技術というよりも、『患者選択に問題があった』のではないか」との見方を強めています。
なお、阪大病院でも事態を重くみており、当該患者申出療養を一時中止し、現在、「患者の選択基準を含めて実施計画の見直し」を検討していると言います。見直し後の実施計画を評価会議で議論する際に、より「安全性の確保」に向けた議論が行われる見込みです。
臨床研究法施行を踏まえ、未承認薬等使用する患者申出療養は必要な事前審査を受ける
患者申出療養は「疾病と闘う患者の希望・申し出」が起点になりますが、将来的な保険収載を目指す保険外併用療養であるため、「臨床試験」「臨床研究」として実施されます。したがって、厚労省・評価会議に申請する前に、臨床研究中核病院で「倫理審査委員会による審査」を受け、「詳細な実施計画」を作成することなどが求められます(関連記事はこちらとこちら)。
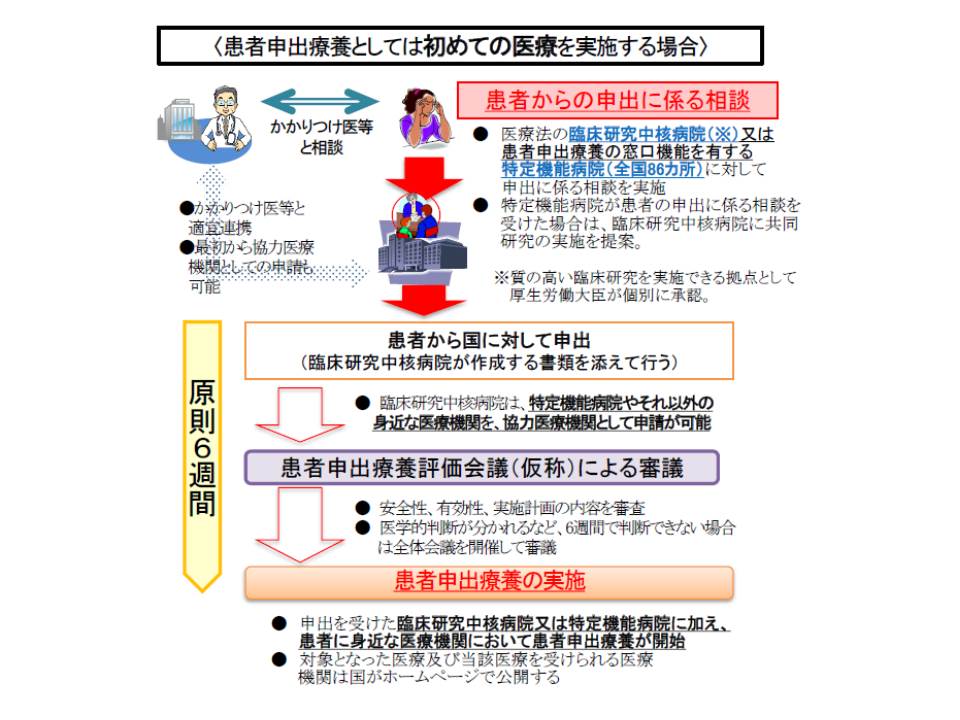
患者申出療養を初めて実施する場合、患者は国に対して申し出を行う(臨床研究中核病院が協力、支援)
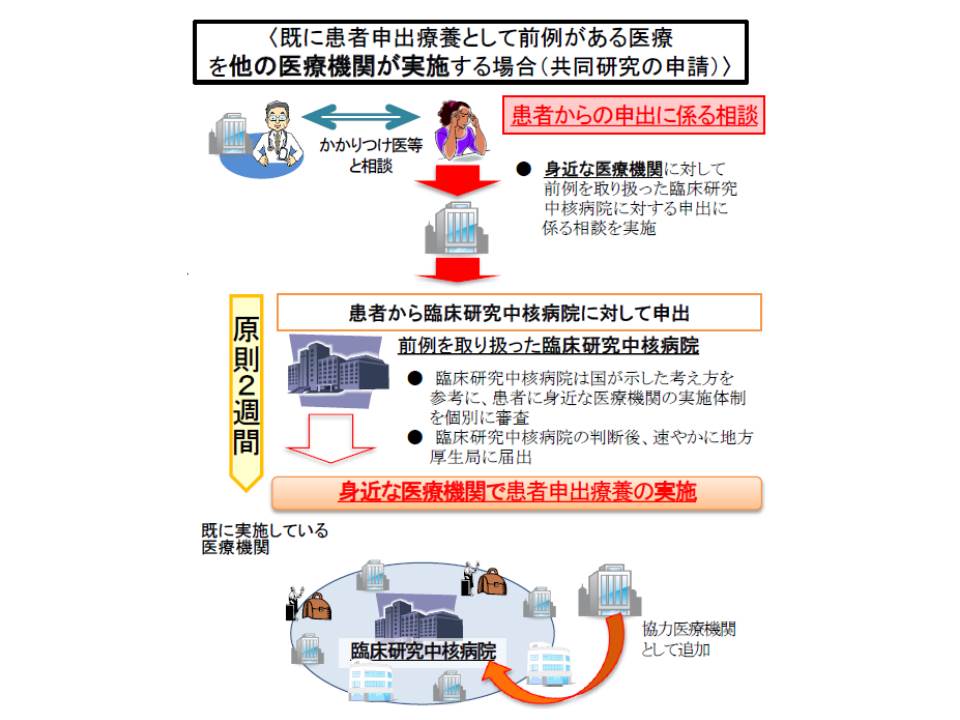
前例のある患者申出療養を実施する場合、患者は臨床研究中核病院に対して「実施を希望する医療機関」で当該医療を行いたいと申し出る
ところで、「臨床研究の不正事案」(高血圧症治療薬での臨床試験データ操作や、製薬メーカーによる臨床試験への極めて深い関与など)への反省を踏まえ、この4月(2018年4月)から臨床研究法が施行されました。この法律では、「特定臨床研究」(▼未承認・適応外の医薬品等に関する臨床研究▼製薬メーカー等から資金提供を受けた医薬品等に関する臨床研究)を行う場合には、研究実施者が「厚生労働大臣の認定を受けた認定臨床研究審査委員会」に実施計画を提出し、適正性の審査を受ける、ことなどが規定されています。

臨床研究法の概要、公正・中立な立場で適正な臨床研究が実施されることを目指す
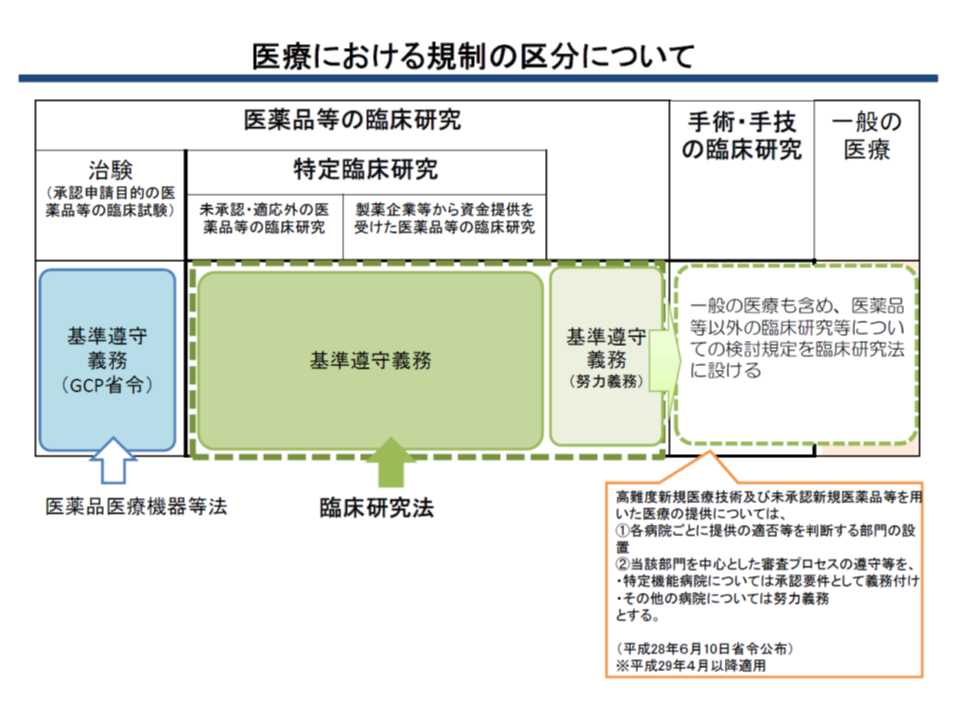
未承認薬・適応外薬を用いる臨床研究など(特定臨床研究)が、臨床研究法の対象となる(緑色の部分)
翻って患者申出療養の中には、「未承認・適応外医薬品を用いた療法」が含まれるケースもあります。そこで厚労省は、臨床研究法に則り、「患者申出療養について厚労省・評価会議に申請する前に、これまでの『倫理審査委員会での審査』に代えて、『認定臨床研究審査委員会での審査』を受けることを義務付ける」との運用見直しを提案。評価会議で了承されました。ただし、「未承認・適応外の医薬品等を使用しない治療法」など、特定臨床研究に該当しない患者申出療養の技術については、これまで通り「倫理審査委員会での審査」を受けることになります。
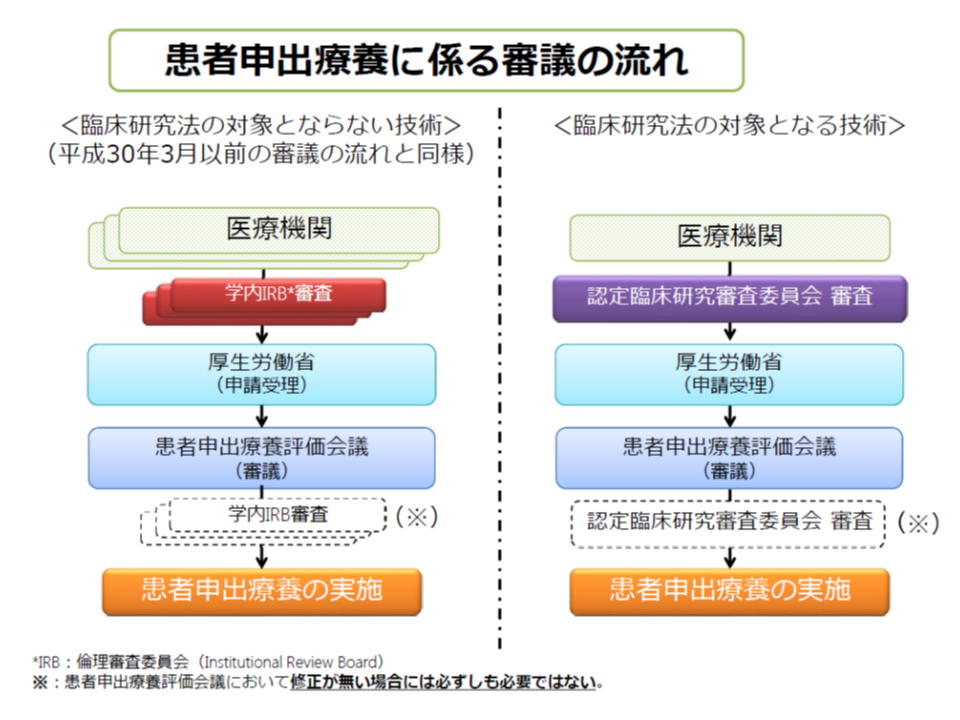
臨床研究法の対象となる患者申出療養(例えば未承認薬を使用し、その評価を行うなど)については、凛凛審査委員会ではなく、認定臨床研究審査委員会での審査を受けることが必要となる
患者申出療養の実施計画等を作成する臨床研究中核病院には、すべて認定臨床研究審査委員会が設置される見込みです(2018年3月に北海道大学病院が臨床研究中核病院となり、12施設となっている)。
なお、この運用見直しに関連し、松井健志構成員(国立循環器病研究センター研究開発基盤センター医学倫理研究部長)は「患者申出療養の審査は『急ぐ』必要がある。認定臨床研究審査委員会において、患者申出療養は優先的に審査するなどの工夫をすべき」と要望。
これに対し、厚労省医政局研究開発振興課の森光敬子課長は、「公平・中立性の確保が臨床研究法制定の趣旨であり、当初から『患者申出療養の審査を優先する』といった仕組みを設けることは好ましくないのではないか。もっとも、臨床研究中核病院の臨床研究審査委員会の状況(どれだけ審査待ちの件数があり、うち患者申出療養はどの程度なのか、など)を把握し、必要があれば対応を検討したい」と説明しています。
松井構成員は、「患者申出療養は、もともとコンパッショネートユース(患者を救うために例外的に未承認薬の使用などを認める)的発想で議論されたが、保険収載を目指す仕組みとなり、今般、多重的な審査を受けることになってしまった」とも述べ、より根本的な制度の趣旨・設計に遡った議論の必要性も示唆しており、今後の議論にも注目が集まります(関連記事はこちらとこちら)。
【関連記事】
有効性・安全性の確立していない患者申出療養、必要最低限の患者に実施を—患者申出療養評価会議
心移植不適応患者への植込み型人工心臓DT療法、2例目の患者申出療養に―患者申出療養評価会議
2018年度改定に向けて、入院患者に対する「医師による診察(処置、判断含む)の頻度」などを調査―中医協総会
患者申出療養、座長が審議の場を判断するが、事例が一定程度集積されるまでは本会議で審議―患者申出療養評価会議
患者申出療養評価会議が初会合、厚労省「まずは既存の先進医療や治験の活用を」
患者申出療養の詳細固まる、原則「臨床研究」として実施し、保険収載を目指す―中医協
患者申出療養の提案受けた臨床研究中核病院、「人道的見地からの治験」の有無をまず確認―中医協総会
大病院受診、紹介状なしの定額負担など16年度から-医療保険部会で改革案まとまる





