進行性胃がんへのパクリタキセル・S-1併用療法、乳房外パジェットへのカドサイラ投与など実施計画見直し―患者申出療養評価会議
2022.9.26.(月)
1番目の患者申出療養である「腹膜播種・進行性胃がん患者へのパクリタキセル腹腔内投与および静脈内投与ならびにS-1内服併用療法」について、「自由診療」での実施が継続されるが、「学会として当該技術をどう考えるのか」を明確にしてもらうべきではないか—。
9番目の患者申出療養である「乳房外パジェット病患者に対するトラスツズマブ エムタンシン(カドサイラ点滴静注用)静脈内投与療法」について、患者の治療機会が奪われないように、実施期間を延長する—。
9月22日に開催された患者申出療養評価会議で、こういった議論が行われました。

9月22日に開催された「第34回 患者申出療養評価会議」
目次
S-1+パクリタキセル併用療法、最終報告待たずに「学会での検証」をしてもらうか・・・
患者申出療養は、傷病と闘う患者の「海外で開発された未承認(保険外)等の医薬品や医療機器を使用してみたい」という希望・申し出を起点に、当該医療技術(未承認の医薬品等)に一定の安全性・有効性があることを評価会議で確認した上で、保険診療との併用を許可する仕組みです(2016年4月スタート)。
これまでに、次の12種類の患者申出療養が認められています(ただし「2」「3」「4」「5」「10」の技術はすでに終了)。
(1)腹膜播種・進行性胃がん患者への「パクリタキセル腹腔内投与および静脈内投与ならびにS-1内服併用療法」
(2)心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」(関連記事はこちら)
(3)難治性天疱瘡患者への「リツキシマブ静脈内投与療法」(関連記事はこちら)
(4)髄芽腫、原始神経外胚葉性腫瘍または非定型奇形腫様ラブドイド腫瘍患者への「チオテパ静脈内投与、カルボプラチン静脈内投与およびエトポシド静脈内投与ならびに自家末梢血幹細胞移植術の併用療法」(関連記事はこちら)
(5)ジェノタイプ1型C型肝炎ウイルス感染に伴う非代償性肝硬変患者への「レジパスビル・ソホスブビル経口投与療法」(関連記事はこちら)
(6)進行固形がん(線維芽細胞増殖因子受容体に変化を認め、従来治療法が無効、かつインフィグラチニブによる治療を行っているものに限る)患者への「インフィグラチニブ経口投与療法」(関連記事はこちら)
(7)早期乳がん患者への「ラジオ波熱焼灼療法」(関連記事はこちら)
(8)遺伝子パネル検査でactionableな遺伝子異常を有すると判断された固形腫瘍に対する「マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」(関連記事はこちらとこちら)
(9)HER2陽性の手術不能または再発の乳房外パジェット病患者に対する「トラスツズマブ エムタンシン(カドサイラ点滴静注用)静脈内投与療法」(関連記事はこちら)
(10)ROS1融合遺伝子陽性の進行性小児脳腫瘍患者に対する「エヌトレクチニブ(販売名:ロズリートレクカプセル)の経口投与療法」(関連記事はこちら)
(11)免疫グロブリンGサブクラス4自己抗体陽性難治性慢性炎症性脱髄性多発神経炎患者に対する「リツキシマブ追加投与療法」(関連記事はこちら)
(12)BRAFV600変異陽性の進行性神経膠腫を有する小児を対象とした「ダブラフェニブ・トラメチニブ併用療法」(関連記事はこちら)
9月22日の会合では、このうち▼(1)腹膜播種・進行性胃がん患者への「パクリタキセル腹腔内投与および静脈内投与ならびにS-1内服併用療法」▼(8)遺伝子パネル検査でactionableな遺伝子異常を有すると判断された固形腫瘍に対する「マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」▼HER2陽性の手術不能または再発の乳房外パジェット病患者に対する「トラスツズマブ エムタンシン(カドサイラ点滴静注用)静脈内投与療法」—の3つの技術について、実施計画の見直しなどを了承しました。
「1」の技術は、腹膜播種陽性または腹腔細胞診陽性の胃がん患者に対し▼S-1(テガフール、ギメラシル、 オテラシルカリウムを配合した抗がん剤、胃がんや大腸がんへの効能・効果が認められている)の内服▼パクリタキセル(胃がんや乳がんへの効能・効果が認められている)の経静脈・ 腹腔内投与―を併用する技術です。有害事象発現状況や全生存期間、奏効割合、腹腔洗浄細胞診陰性化割合を評価項目として本技術の「有効性」や「安全性」の確認を行い、将来的な保険適用を目指しています。
しかし、「腫瘍の進行が確認されるか、有害事象により継続困難となるまで反復(継続)する」こととされているため、「技術の有効性・安全性の最終的な評価をいつ行えるのかが不明」な、いわば「宙ぶらりん」な状況が続いています(全111症例中、本年(2022年)6月23日時点で「3症例」で継続中)。
このため、患者申出療養評価会議では、実施医療機関でもある東大病院に「中間評価」を行うよう要請。東大病院もこの要請に応えて「中間評価報告書」を提示しています(関連記事はこちら)。
しかし、患者申出療養評価会議では、本技術について次の2つの問題点があるとの指摘がなされました(関連記事はこちら)。
(a)「高齢者、PS不良例や既治療例等が含まれていたにもかかわらず先行研究(先進医療B、すでに終了)と遜色ない結果が得られ、本療法の有効性が示唆されている」と結論づけているが、誤解を招く。全体として「思い入れ」が強く不適切な表現がいくつかある
(b)東大病院で本技術が自由診療として行われている
9月22日の会合には、こうした指摘への返答(東大病院より)が示されました。まず(a)の指摘に関しては「誤解を招くような記述は修正・削除する」旨の返答がなされ、構成員間で了承されました。
また(b)の指摘に対しては、▼当院または研究グループの他施設主導で更なる臨床研究の実施が実現するまでは「自由診療」を継続する▼ただし臨床研究について、計画はあるが、企業からの協力が得られず、実施が困難な状況である—との返答がなされました。「藁にも縋る思いの患者に対し、安全性・有効性が確認されていない技術が自由診療の中で実施されることは好ましくない」との指摘が従前よりありますが、患者申出療養評価会議にも厚生労働省にも「自由診療としての実施をストップ」させる権限はないため、報告を受けるにとどまっています。
なお、本技術について「3例の治療継続患者がいる」点を踏まえて、実施期間の延長が認められています。上述のように、本技術については「腫瘍の進行が確認されるか、有害事象により継続困難となるまで反復(継続)する」(1年ごとに延長の可否を判断する)こととなっているためです。
ただし、構成員の間からは▼学会(日本胃癌学会など)に対し、「本技術の安全性・有効性をどうとらえているのか」を現時点から検討し始めてもらってはどうか(山口俊晴構成員:がん研究会有明病院名誉院長)▼最終報告を待ってから学会に「安全性・有効性についての検証」を求めるのでは、いつになるのか分からない(上述参照)。中間評価で検証が行えないか、学会に相談してはどうか(直江知樹構成員:名古屋医療センター名誉院長)—との意見も出ており、今後、厚労省と福井次矢座長(東京医科大学茨城医療センター病院長)との間で対応について調整を行うことになりました。
小児がん患者への「最適な分子標的薬」投与、より容易に行えるようにならないか
また「8」の技術は、遺伝子パネル検査の結果「未承認の分子標的薬(抗がん剤)が奏功する可能性がある」と判明したがん患者について、迅速に当該分子標的薬を用いた治療が可能となるように、予め国立がん研究センターで「患者申出療養の計画」を準備しておき、患者から希望があった場合に、すみやかに当該抗がん剤治療ん実施を可能とするものです(関連記事はこちらとこちら)。
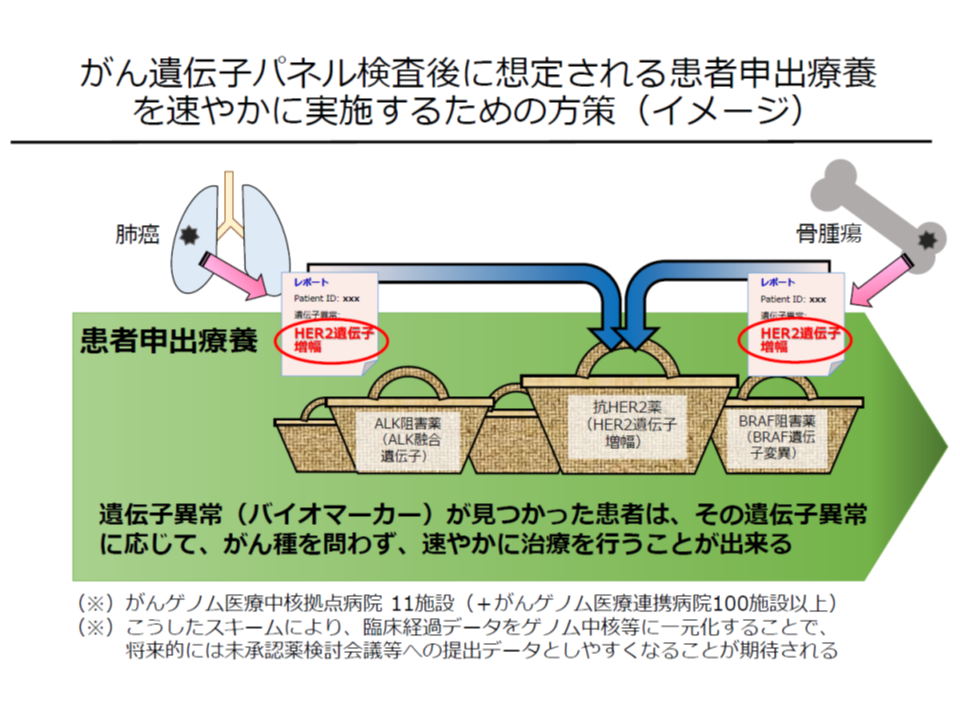
「適応外の抗がん剤」治療で効果があると判明した患者が、一刻も早く患者申出療養を申請できるよう、臨床研究中核病院で「下準備」を進めておく
9月22日の患者申出療養評価会議では、実施計画について「個人情報保護法の改正に伴う説明同意文書の改訂」などの見直しが了承されました(技術の内容を見直すものではない)。
関連して天野慎介構成員(全国がん患者団体連合会理事長)から、「小児がん患者で、患者申出療養評価会議が使いにくいとの声がある。現場からヒアリング等を行い、改善策を検討してほしい」との要請がなされています。
本技術については、小児がん患者も迅速に「適応外の分子標的薬」にアクセスできる環境を整備するために、例えば「『小児に対する用法・用量が存在しない薬剤』についても、海外のデータ等をもとに『小児に対する用法・用量を定めて、本技術の対象とする』ことについて製薬メーカーとの合意が得られる場合には対象に含める」などの実施計画改善が図られてきています(関連記事はこちら)。
「具体的にどういった課題があり、どういった改善策が考えられるのか」、厚労省は必要に応じて現場ヒアリングを行うなどして検討していく考えです。
乳房外パジェットへのカドサイラ投与、患者の治療機会を奪わないよう実施期間延長
一方、「9」の技術は、皮膚がんの1種である「乳房外パジェット病」患者に対して、効果が期待される抗がん剤「トラスツズマブ エムタンシン」(販売名:カドサイラ点滴静注用)を投与し、安全性・有効性を確認したうえで、保険適用(適応拡大)を目指すものです(関連記事はこちら)。
9月22日の患者申出療養評価会議では「実施期間の延長」が了承されています。
ある患者では「本技術を希望し患者申出療養の実施が認められた」ものの、次のような経緯で「トラスツズマブ エムタンシン」(販売名:カドサイラ点滴静注用)の投与がまだ行われていません。
▼本技術の実施を希望し、実施計画の申請を行う
↓
▼患者申出療養評価会議で実施計画が了承され、実際に技術実施ができる(カドサイラの投与が行える)までには一定の時間がかかる
↓
▼その間、「無治療で放置する」わけにはいかないため、別の抗がん剤を試験的に実施
↓
▼当該「別の抗がん剤」が一定の効果を示したことから継続投与しており、患者申出療養である「カドサイラ投与」を見合わせている
この点、「別の抗がん剤」の効果が薄れた後に、患者申出療養である「カドサイラ投与」を行うことが考えられますが、その時点で「実施計画の期間が終了」してしまってはカドサイラ投与が行えないため、今回の「実施期間の延長」が認められたものです(再度の延長は予定されていない)。
【関連記事】
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、ニラパリブを対象薬剤に追加―患者申出療養評価会議
耳介後部コネクター用いるDT療法の有効性に期待、遺伝子パネル検査による抗がん剤治療で対象薬剤追加―患者申出療養評価会議
患者申出療養から「初の薬事承認・保険適用」技術登場、抗がん剤「適応拡大」にも期待集まる―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、リキッドバイオプシーも検査対象に追加―患者申出療養評価会議
12番目の患者申出療養、「BRAF V600変異陽性の小児神経膠腫」への抗がん剤併用療法を承認―患者申出療養評価会議
11番目の患者申出療養として、難病CIDPへのリツキシマブ追加投与療法を認める―患者申出療養評価会議
患者申出療養で実施される保険外の医療技術、しかるべき時期に安全性・有効性の評価が必要—患者申出療養評価会議
患者申出療養の計画変更を了承、ただし「野放図な期間延長」などは好ましくない―患者申出療養評価会議
10番目の患者申出療養として、小児脳腫瘍へのエヌトレクチニブ投与療法を認める―患者申出療養評価会議
小児がん患者も迅速に「適応外の分子標的薬」にアクセスできる環境を整備―患者申出療養評価会議(2)
乳房外パジェットへのカドサイラ投与、9番目の患者申出療養として導入―患者申出療養評価会議(1)
小児がん患者が「最適な抗がん剤にアクセスしやすい環境」の整備に向け、患者申出療養を拡充―患者申出療養評価会議
遺伝子パネル検査に基づく「適応外抗がん剤」使用、患者申出療養での実施を承認―患者申出療養評価会議
遺伝子パネル検査に基づく抗がん剤の適応外使用想定した事前準備、国がんで進む―患者申出療養評価会議
患者申出療養評価会議からメーカーに「薬剤等供給」協力を要請する仕組み設ける―患者申出療養評価会議
早期乳がんのラジオ波熱焼灼治療を患者申出療養に導入、再発リスク説明等が必要―患者申出療養評価会議
遺伝子パネル検査で「適応外の抗がん剤治療」の可能性ある場合、迅速に治療開始できる準備進める―患者申出療養評価会議
「非代償性肝硬変へのハーボニー投与」、5種類目の患者申出療養に―患者申出療養評価会議
阪大病院での患者申出療養すべてで死亡含む重篤事象が発生、適切な患者選択を―患者申出療養評価会議
有効性・安全性の確立していない患者申出療養、必要最低限の患者に実施を—患者申出療養評価会議
心移植不適応患者への植込み型人工心臓DT療法、2例目の患者申出療養に―患者申出療養評価会議
2018年度改定に向けて、入院患者に対する「医師による診察(処置、判断含む)の頻度」などを調査―中医協総会
患者申出療養、座長が審議の場を判断するが、事例が一定程度集積されるまでは本会議で審議―患者申出療養評価会議
患者申出療養評価会議が初会合、厚労省「まずは既存の先進医療や治験の活用を」
患者申出療養の詳細固まる、原則「臨床研究」として実施し、保険収載を目指す―中医協
患者申出療養の提案受けた臨床研究中核病院、「人道的見地からの治験」の有無をまず確認―中医協総会
大病院受診、紹介状なしの定額負担など16年度から-医療保険部会で改革案まとまる





