耳介後部コネクター用いるDT療法の有効性に期待、遺伝子パネル検査による抗がん剤治療で対象薬剤追加―患者申出療養評価会議
2022.3.22.(火)
2番目の患者申出療養である「心移植不適応な重症心不全患者への『耳介後部コネクターを用いた植込み型補助人工心臓による療法』」については、3例に実施され▼1例では心身状態が改善▼1例では患者が死亡▼1例では研究中止(終了後に死亡)―となった。わずか1例で安全性・有効性を科学的に評価することは困難だが、当該事例では「有効性が期待できる」結果も得られている―。
3月18日に開催された患者申出療養評価会議で、こういった総括報告書が取りまとめられました。
3例のうち2例が死亡に至っており安全性に問題がある技術とも思われますが、「極めて全身状態の悪い患者を対象にしたために、合併症発生や死亡などが目立ったとも考えられる。対象患者をより広く設定することで、安全性・有効性に関するエビデンスが得られる可能性もあるのではないか」との意見が構成員から出ています。こうした声を踏まえて、今後、実施医療機関である大阪大学医学部附属病院がどう考えていくのかに注目が集まります。
なお、「遺伝子パネル検査でactionableな遺伝子異常を有すると判断された固形腫瘍に対する『マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療』」において、日本イーライリリー社の協力で「アベマシクリブ」(ベージニオ錠)が対象薬剤に追加されることとなっています。

3月18日に開催された「第31回 患者申出療養評価会議」
耳介後部コネクター用いたDT療法、症例数少ないが「有効性」に期待
患者申出療養は、傷病と闘う患者が「保険適用されている現在の技術では病状が改善しない。海外で開発された未承認(保険外)等の医薬品や医療機器を使用してみたい」という希望・申し出を行った場合、これを起点に、当該医療技術(未承認の医薬品等)に一定の安全性・有効性があることを評価会議で確認した上で、保険診療との併用を許可するものです(2016年4月スタート)。
これまでに、次の12種類の患者申出療養が認められています(ただし「2」「4」「5」の技術は終了しており、現在、動いている患者申出療養は9種類)。
(1)腹膜播種・進行性胃がん患者への「パクリタキセル腹腔内投与および静脈内投与ならびにS-1内服併用療法」
(2)心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」(関連記事はこちら)
(3)難治性天疱瘡患者への「リツキシマブ静脈内投与療法」(関連記事はこちら)
(4)髄芽腫、原始神経外胚葉性腫瘍または非定型奇形腫様ラブドイド腫瘍患者への「チオテパ静脈内投与、カルボプラチン静脈内投与およびエトポシド静脈内投与ならびに自家末梢血幹細胞移植術の併用療法」(関連記事はこちら)
(5)ジェノタイプ1型C型肝炎ウイルス感染に伴う非代償性肝硬変患者への「レジパスビル・ソホスブビル経口投与療法」(関連記事はこちら)
(6)進行固形がん(線維芽細胞増殖因子受容体に変化を認め、従来治療法が無効、かつインフィグラチニブによる治療を行っているものに限る)患者への「インフィグラチニブ経口投与療法」(関連記事はこちら)
(7)早期乳がん患者への「ラジオ波熱焼灼療法」(関連記事はこちら)
(8)遺伝子パネル検査でactionableな遺伝子異常を有すると判断された固形腫瘍に対する「マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」(関連記事はこちらとこちら)
(9)HER2陽性の手術不能または再発の乳房外パジェット病患者に対する「トラスツズマブ エムタンシン(カドサイラ点滴静注用)静脈内投与療法」(関連記事はこちら)
(10)ROS1融合遺伝子陽性の進行性小児脳腫瘍患者に対する「エヌトレクチニブ(販売名:ロズリートレクカプセル)の経口投与療法」(関連記事はこちら)
(11)免疫グロブリンGサブクラス4自己抗体陽性難治性慢性炎症性脱髄性多発神経炎患者に対する「リツキシマブ追加投与療法」(関連記事はこちら)
(12)BRAFV600変異陽性の進行性神経膠腫を有する小児を対象とした「ダブラフェニブ・トラメチニブ併用療法」(関連記事はこちら)
3月18日の会合では、このうち「2」の技術について、総括評価報告書をとりまとめました。
重篤な心不全患者では「植込み型補助人工心臓」(LVAD)による生命維持(DT療法)が行われます(院移植の待機期間はもちろん、長期間のLVAD設置も増えてきている)。多くの機器では、「人工心臓」を体内に埋め込み、体外の「人工心臓を駆動させるためのバッテリー」とコード(ドライブライン、DL)でつなぐことになりますが、コードが患者の腹部(左脇)から出るため患者のQOLに問題がある(例えば入浴の際に、手間のかかる特段の配慮をしなければならないなど)と指摘されています。
この点、コードを耳の後ろ側(耳介後部)から出す機器(耳介後部コネクターを用いたJarvik2000植込み型補助人工心臓システム」(耳介後部モデル))が開発され、患者のQOLが大きく向上すると期待されていますが、薬事承認を得られていません(このため本機器を用いた治療を保険診療の中で行うことができない)。
このため、重症心不全患者サイドから耳介後部モデルを使用したいとの申し出があり、2017年2月に「2番目の患者申出療養」として「保険診療」と「保険外診療」とを併用することが認められました。この併用の中で、「ドライブライン感染の有無」「脳合併症」「全生存率」「QOL」といった項目から技術の有効性・安全性を評価するものです。

心臓移植(つなぎ期間のBTTも)やDT療法(永久に植込み型人工心臓を用いる)治験の対象とならなら重症心不全患者について、一部DT療法を患者申出療養として認め、保険収載を目指す
本技術については「3例への実施」(当初計画では6例の患者に実施予定)がなされ、例えば次のような状況が明らかになっています。
(1)3例に実施され、▼1例では心身状態が改善▼1例では患者が死亡▼1例では研究中止(終了後に死亡)―
→評価可能な症例は「1例」のみ
(2)評価可能症例(1例)のうち、ドライブライン感染発生はゼロ%であった
・全3症例において有害事象は18件確認され、転帰死亡が1件、未回復が4件、重篤4件、重症度高が5件。主な内容は「感染」「神経機能障害」「不整脈」「呼吸不全」。
・植え込みから6か月の題に装置不具合は認められなかった
(3)評価可能症例(1例)のうち中等度以上の障害を伴う脳卒中(modified Rankin Scale3以上)の発生はゼロ%であった
(4)評価可能症例(1例)について、次のような心機能の改善が見られた
・NYHA新機能分類:クラスⅣ→IIIA→IIIA→II
・身体活動レベル値:1未満→1-2→2-4→2-4
・6分間歩行試験(歩行距離):0m→184m-416m→475m
(5)評価可能症例(1例)について、次のようなQOL改善が見られた
・EuroQOL(EQ-5D-5L、高いほど良好):20→30→70→85
・MLHFQスコア(低いほど良好):88→87→72→48
(6)評価可能症例(1例)について、心理状態が改善した
まず症例数が少ないこと(評価可能症例に至っては1例、全症例でも3例)から、統計的に安全性や有効性に関する結論を導くことはできません。
ただし、例えば(3)から(6)の結果からは、「有効性が伺えそうだ」との推測ができそうです。磯部光章技術専門委員(日本心臓血圧研究振興会附属榊原記念病院院長)は「既存の保険適用されている技術である『腹部からドライブラインを出す』技術に比べ、患者のQOLは上がり、一般的な感染リスクも小さくなる。安全性について既存技術と同等であれば、耳介後部からドライブラインを出す本技術のほうが優れていると言える」とコメントしています。
安全性について(1)(2)の結果から「問題がありそうだ」とも思えますが、▼既存の「腹部からドライブラインを出す」技術でも、術後2年の間に患者の8割で合併症(感染や脳梗塞、機器故障など)が生じる▼本技術の対象症例が極めて重篤であった(重症心不全のほかにも重篤な状態を抱えていた)―ことなどを勘案する必要もありそうです。
こうした点を踏まえ、松井健志構成員(国立がん研究センターがん対策研究所生命倫理・医事法研究部長)や磯部技術専門委員は「重症度が低い患者を含めた多様な症例を対象にすることで、異なる結果(安全性や有用性が確認できる結果)が導かれた可能性がある。本技術が既存技術と異なる『耳介後部からドライブラインが出ている』という点に着目した項目によって評価を行うべきであった」と指摘しています。
会議として総括評価報告書を取りまとめられるとともに、福井次矢座長(東京医科大学茨城医療センター病院長)や山口俊晴構成員(がん研究会有明病院名誉院長)は「実施医療機関である阪大病院に対し、評価会議の意見などを伝え、今後、本技術をどのように進めるのかなどを考えてもらいたい」とコメントしました。例えば松井構成員らの指摘するような「重症度の低い患者を含めた対象症例を確保する」「評価項目を見直す」などの新計画を作成し、臨床研究や治験を進めていくことなどが選択肢と考えられそうです。また別の患者からの要望を踏まえて「新たな患者申出療養」として申請を行うことも選択肢の1つとなります。患者のQOL向上が期待される技術であり、前向きな研究に期待が集まります。
遺伝子パネル検査に基づく患者申出療養での抗がん剤投与、対象薬剤に「アベマシクリブ」追加
また3月18日の会合では、「8」の「遺伝子パネル検査でactionableな遺伝子異常を有すると判断された固形腫瘍に対する『マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療』」について、次のような実施計画の変更が了承されました。
▽対象薬剤に「アベマシクリブ」(販売名:ベージニオ錠50mg、同錠100mg、同錠150mg、日本イーライリリー社)を追加する
▽遺伝子パネル検査として、先進医療Bとして実施中のがん遺伝子パネル検査(マルチプレックス遺伝子パネル検査(Foundation One CDx がんゲノムプロファイル)を追加する
▽症例登録から薬剤投与まで時間が空く場合には、「治療開始前7日以内に画像診断などの検査を行い、再確認を行う方が望ましい」旨を明示する
▽患者への説明同意文書について、より分かりやすく改訂する
この技術は、遺伝子パネル検査(複数の遺伝子変異を一括して検査できる)の結果「未承認・適応外の分子標的薬(抗がん剤)が奏功する可能性がある」と判明したがん患者について、迅速に当該分子標的薬を用いた治療が可能となるように、予め国立がん研究センターで「患者申出療養の計画」を準備しておき、患者から希望があった場合に、すみやかに当該抗がん剤治療ん実施を可能とするものです(関連記事はこちらとこちらとこちら)。
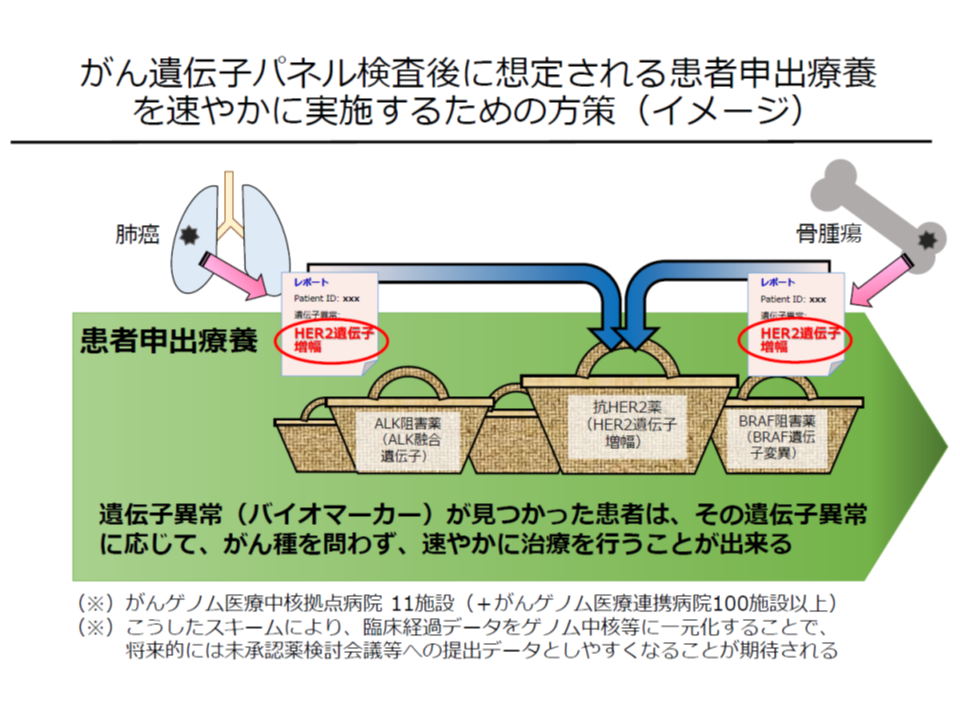
患者申出療養の当初の姿からすれば、▼遺伝子パネル検査を行う→▼検査結果に基づいて病院の専門家会議(エキスパートパネル)で抗がん剤候補を明確化する→▼当該候補抗がん剤が未承認・適応外の場合、患者の希望を踏まえて「患者申出療養の計画」を作成する→▼患者申出療養評価会議に申請し、許可を待つ→▼許可を得て初めて当該抗がん剤投与が可能になる―という流れを踏まなければなりません。この場合、パネル検査・エキスパートパネル・計画作成に一定の期間がかかるため、「間に合わない」(抗がん剤投与前にがんが進行し、患者が不幸にもなくなってしまう)ケースが少なからず出ると想定されます(遺伝子パネル検査は、標準治療を終えた患者、標準治療がない患者が対象となり、相当程度がんが進行していることが多い)。
そこで、患者の切なる希望に迅速に応えられるよう、「事前に『患者申出療養の計画』の雛形作成までを準備しておき、患者から『未承認・適応外の抗がん剤を使用したい』と要望があった場合に、速やかに抗がん剤投与が行える」仕組みが2018年11月の患者申出療養評価会議で創設されたのです。
この仕組みをより優れたものにしていくためには、「本技術の中で使用できる抗がん剤が広がる」ことが重要です。
パネル検査を終え、抗がん剤候補が見つかったが「当該薬剤は患者申出療養の対象とならない」のであれば、完全自費で一連のがん治療・薬剤投与を受けなければなりません。またパネル検査・エキスパートパネルの結果を踏まえてから「この抗がん剤を患者申出療養の中で使用できるようにしてはどうか」と検討するよりも、事前に「多くの抗がん剤が患者申出療養の中で使用できる」とリスト化されていれば、より迅速に抗がん剤投与が可能になります。
こうした点を踏まえれば、今般、日本イーライリリー社の協力により「アベマシクリブ」が患者申出療養の中で使用可能となったことは、がんと闘う患者にとって大きな朗報と言えます。山口構成員も「より多くの抗がん剤を、患者申出療養のリストに加えていくべき」とコメントし、拡大の方向を高く評価しています。同剤は▼ホルモン受容体陽性かつHER2陰性の手術不能または再発の乳がん▼ホルモン受容体陽性かつHER2陰性で再発高リスクの乳がんにおける術後薬物療法―への効能効果が認められていますが、患者申出療養を通じて適応が広がる可能性もあります。適応が広がれば、患者にとって治療選択肢が広まるとともに、製薬メーカーにとって「市場が広がる」ことにもつながるでしょう。より多くの製薬メーカーのさらなる協力に期待が集まります。
なお、患者代表として参画する天野慎介構成員(全国がん患者団体連合会理事長)は「薬剤種類別に、患者申出療養として実施されている症例数などを公表してほしい」と要望しています。
「8」の患者申出療養として使用できる抗がん剤は、今般のアベマシクリブを含めて20種類あります(下表参照、ここに今般の「アベマシクリブ」が追加される)。このうち▼タフィンラーカプセル/メキニスト錠(併用療法)▼オプジーボ点滴静注―については予定症例数(50症例)が確保され、データ解析段階に入っています(関連記事はこちらとこちら)。結果如何によっては「薬事承認(対象となるがん種の拡大)→保険適用」が期待され、これが実現すれば「多くのがん患者にとって、治療の選択肢がさらに広がる」ことを意味します。こうした進捗状況が明らかになることで「患者のがんと闘う意欲が高まる」ことも期待され、天野構成員は「薬剤種類別の症例数公表」を要望しているものと思われます。こうした意見は、厚労省から国立がん研究センターへ、さらに製薬メーカーへと伝達されます。
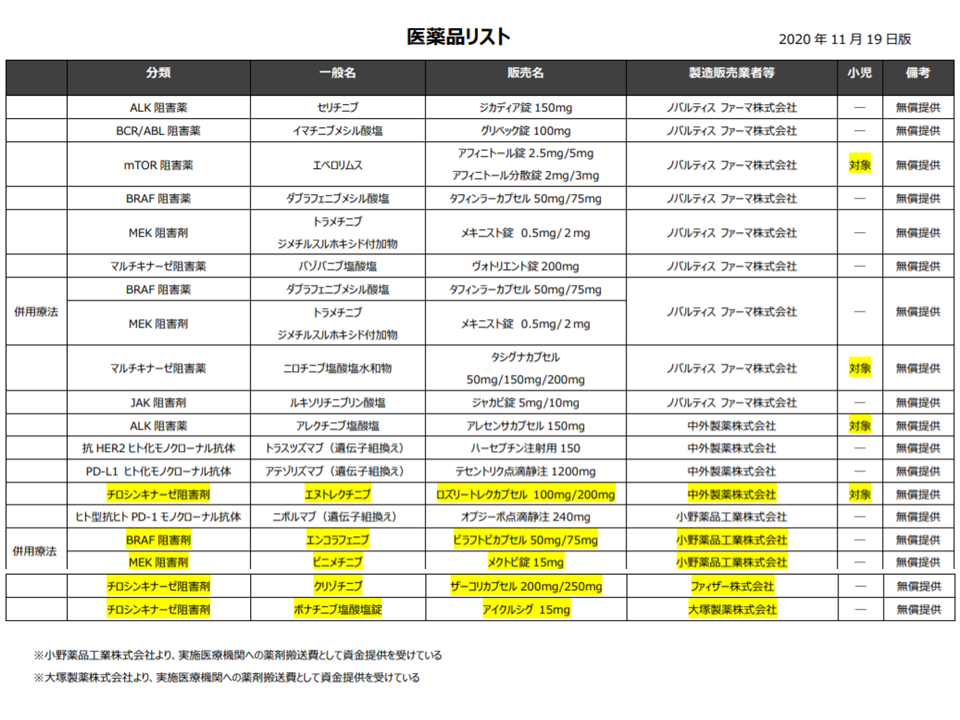 (8)の技術において、ノバルティスファーマ・中外製薬・小野薬品・ファイザー・大塚製薬から抗がん剤が無償提供されている(黄色部分が新規の無償提供)(患者申出療養評価会議2 210121)
(8)の技術において、ノバルティスファーマ・中外製薬・小野薬品・ファイザー・大塚製薬から抗がん剤が無償提供されている(黄色部分が新規の無償提供)(患者申出療養評価会議2 210121)
ところで、本技術の協力医療機関の1つである阪大病院では、「本技術に基づいて抗がん剤を投与していた患者が、不幸にも治療途中に自宅で亡くなった。その際、訪問診療を行っていた医師が、当該患者が『本技術を受けている患者』であることを知らず、阪大病院への報告に10日程度の時間がかかってしまった」ことから、一時「症例の新規登録」を停止していました(2021年6月23日に停止、関連記事はこちら)。
その後、阪大での情報連携体制強化が行われたことから、今年(2022年)2月28日に「症例の新規登録」が再開されています(3か月後に連携強化体制のフォローアップが行われる)。
なお、「10」の「ROS1融合遺伝子陽性の進行性小児脳腫瘍患者に対する『エヌトレクチニブ(販売名:ロズリートレクカプセル)の経口投与療法』」については、患者サイドの意向で投与が終了しました(関連記事はこちら)。このため実施医療機関である名古屋大学医学部附属病院は患者申出療養を取り下げ、総括報告書の準備に入っています(近く、上述「2」技術と同様に総括報告書の審議を本会議で行うことになる)。
【関連記事】
患者申出療養から「初の薬事承認・保険適用」技術登場、抗がん剤「適応拡大」にも期待集まる―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、リキッドバイオプシーも検査対象に追加―患者申出療養評価会議
12番目の患者申出療養、「BRAF V600変異陽性の小児神経膠腫」への抗がん剤併用療法を承認―患者申出療養評価会議
11番目の患者申出療養として、難病CIDPへのリツキシマブ追加投与療法を認める―患者申出療養評価会議
患者申出療養で実施される保険外の医療技術、しかるべき時期に安全性・有効性の評価が必要—患者申出療養評価会議
患者申出療養の計画変更を了承、ただし「野放図な期間延長」などは好ましくない―患者申出療養評価会議
10番目の患者申出療養として、小児脳腫瘍へのエヌトレクチニブ投与療法を認める―患者申出療養評価会議
小児がん患者も迅速に「適応外の分子標的薬」にアクセスできる環境を整備―患者申出療養評価会議(2)
乳房外パジェットへのカドサイラ投与、9番目の患者申出療養として導入―患者申出療養評価会議(1)
小児がん患者が「最適な抗がん剤にアクセスしやすい環境」の整備に向け、患者申出療養を拡充―患者申出療養評価会議
遺伝子パネル検査に基づく「適応外抗がん剤」使用、患者申出療養での実施を承認―患者申出療養評価会議
遺伝子パネル検査に基づく抗がん剤の適応外使用想定した事前準備、国がんで進む―患者申出療養評価会議
患者申出療養評価会議からメーカーに「薬剤等供給」協力を要請する仕組み設ける―患者申出療養評価会議
早期乳がんのラジオ波熱焼灼治療を患者申出療養に導入、再発リスク説明等が必要―患者申出療養評価会議
遺伝子パネル検査で「適応外の抗がん剤治療」の可能性ある場合、迅速に治療開始できる準備進める―患者申出療養評価会議
「非代償性肝硬変へのハーボニー投与」、5種類目の患者申出療養に―患者申出療養評価会議
阪大病院での患者申出療養すべてで死亡含む重篤事象が発生、適切な患者選択を―患者申出療養評価会議
有効性・安全性の確立していない患者申出療養、必要最低限の患者に実施を—患者申出療養評価会議
心移植不適応患者への植込み型人工心臓DT療法、2例目の患者申出療養に―患者申出療養評価会議
2018年度改定に向けて、入院患者に対する「医師による診察(処置、判断含む)の頻度」などを調査―中医協総会
患者申出療養、座長が審議の場を判断するが、事例が一定程度集積されるまでは本会議で審議―患者申出療養評価会議
患者申出療養評価会議が初会合、厚労省「まずは既存の先進医療や治験の活用を」
患者申出療養の詳細固まる、原則「臨床研究」として実施し、保険収載を目指す―中医協
患者申出療養の提案受けた臨床研究中核病院、「人道的見地からの治験」の有無をまず確認―中医協総会
大病院受診、紹介状なしの定額負担など16年度から-医療保険部会で改革案まとまる





