11番目の患者申出療養として、難病CIDPへのリツキシマブ追加投与療法を認める―患者申出療養評価会議
2021.7.26.(月)
11番目の患者申出療養として「免疫グロブリンGサブクラス4自己抗体陽性難治性慢性炎症性脱髄性多発神経炎患者に対するリツキシマブ追加投与療法」を認め、保険診療との併用を可能とする―。
7月21に開催された患者申出療養評価会議で、こういった点が了承されました。

7月21日に開催された「第26回 患者申出療養評価会議」
医師主導治験が終了し、「追加投与」を求める患者の希望に患者申出療養で応える
我が国では、安全性・有効性の確立された医療技術は原則として保険適用され、患者は医療費の1-3割を負担するのみで優れた医療を受けることができます(年齢、収入によって負担割合は異なり、さらに高額療養費制度により1か月の自己負担は一定額に抑えられる)【保険診療】。
一方、安全性・有効性の確立されていない医療技術を受ける場合には、原則として医療保険は使えず、全額自己負担となります【保険外診療、自由診療】。
ただし、「保険適用を目指す高度な先端的医療の実施を推進する」ことや「保険診療を受けながら特別の療養環境向上を可能とする」ために、保険診療と保険外診療を組み合わせる仕組みも用意されています【保険外併用療養制度】。
患者申出療養は、2016年4月1日からスタートした新たな保険外併用療養制度で、傷病と闘う患者の「海外で開発された未承認(保険外)等の医薬品や医療機器を使用した治療を受けたい」といった希望・申し出を起点として、当該医療技術(未承認の医薬品等)に一定の安全性・有効性があることを評価会議で確認した上で、保険診療との併用を可能とするものです。
これまでに、次の10種類の患者申出療養が認められています。
(1)腹膜播種・進行性胃がん患者への「パクリタキセル腹腔内投与および静脈内投与ならびにS-1内服併用療法」
(2)心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」(関連記事はこちら)
(3)難治性天疱瘡患者への「リツキシマブ静脈内投与療法」(関連記事はこちら)
(4)髄芽腫、原始神経外胚葉性腫瘍または非定型奇形腫様ラブドイド腫瘍患者への「チオテパ静脈内投与、カルボプラチン静脈内投与およびエトポシド静脈内投与ならびに自家末梢血幹細胞移植術の併用療法」(関連記事はこちら)
(5)ジェノタイプ1型C型肝炎ウイルス感染に伴う非代償性肝硬変患者への「レジパスビル・ソホスブビル経口投与療法」(関連記事はこちら)
(6)進行固形がん(線維芽細胞増殖因子受容体に変化を認め、従来治療法が無効、かつインフィグラチニブによる治療を行っているものに限る)患者への「インフィグラチニブ経口投与療法」(関連記事はこちら)
(7)早期乳がん患者への「ラジオ波熱焼灼療法」(関連記事はこちら)
(8)遺伝子パネル検査でactionableな遺伝子異常を有すると判断された固形腫瘍に対する「マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」(関連記事はこちらとこちら)
(9)HER2陽性の手術不能または再発の乳房外パジェット病患者に対する「トラスツズマブ エムタンシン(カドサイラ点滴静注用)静脈内投与療法」(関連記事はこちら)
(10)ROS1融合遺伝子陽性の進行性小児脳腫瘍患者に対する「エヌトレクチニブ(販売名:ロズリートレクカプセル)の経口投与療法」(関連記事はこちら)
7月21日の会合では、11番目の患者申出療養として「免疫グロブリンGサブクラス4自己抗体陽性難治性慢性炎症性脱髄性多発神経炎患者に対するリツキシマブ追加投与療法」を認められました。
慢性炎症性脱髄性多発神経炎(chronic inflammatory demyelinating polyneuropathy:CIDP)は、四肢の筋力低下やしびれ感をきたす末梢神経性疾患(神経炎)で、一定の重症基準を満たした場合には医療費助成が受けられる「指定難病」に指定されています(告示番号14)。
治療法としては副腎皮質ホルモン投与や免疫グロブリン投与などがありますが、免疫グロブリンの1つであるIgG4による自己抗体陽性CIDPに対しては、分子標的薬「リツキシマブ(遺伝子組換え)」(リツキサン点滴静注、ほか後発品あり)の投与が医学的・薬学的に効果的であると考えられています。
この点、名古屋大学医学部附属病院が中心となった「IgG4自己抗体陽性の難治性CIDP患者に対するリツキシマブ(遺伝子組換え)の有効性・安全性を検討する探索的臨床試験(RECIPE試験)」(医師主導治験)が実施され、現在、当該技術の保険適用に向けて結果の解析が進行中です。
今般、過去にリツキシマブを投与されたCIDP患者において症状の再発が起きました。上記の医師主導治験は終了(昨年(2020年6月)で患者登録が終了)しており、また現在、他の治験・臨床試験も走っていないことから、当該患者がリツキシマブ投与を受けるためには、上述した自由診療(すべての治療が自己負担となる)とならざるを得ません。
このため当該患者は「患者申出療養として、リツキシマブ投与(保険外)と保険診療との併用を認めてほしい」と希望。これを起点として名古屋大学医学部附属病院が実施計画を作成し、患者申出療養評価会議で「適」と認められました(患者申出療養は、新規技術の保険診療を目指し、臨床試験の一環として行われるために厳密な実施計画を作成し、専門家が参画する評価会議で審査を受けなければならない)。
対象患者は、IgG4サブクラス自己抗体の中でも最も高頻度に見られるneurofascin-155(NF-155)抗体陽性のCIDP患者のうち、「過去にCIDP治療を目的にリツキシマブを静脈内投与した」、あるいは「上述の医師主導治験に参加し、リツキシマブまたはプラセボを静脈内投与した患者」で、名古屋大学医学部附属病院は「5例」(この8月(2021年8月)から2023年12月)を想定しています。この5例のCIDP患者にリツキシマブを投与し、安全性や有効性を評価して、保険適用を目指します。
なお、繰り返し述べているとおり、本技術についてはすでに医師主導治験が行われ、現在、データ等の解析が進められています。これをもとに安全性・有効性が確認されれば「当該技術が保険適用される」可能性も高くなるため、本件患者申出療養は「当該技術が保険適用されるまでのつなぎ措置」と考えることも可能です。

11番目の患者申出療養である「CIDP患者へのリツキシマブ追加投与」の概要(患者申出療養評価会議 210721)
構成員から反対意見は出ていませんが、世界医師会で採択されたヘルシンキ宣言34条では「臨床試験の前に、スポンサー、研究者および主催国政府は、試験の中で有益であると証明された治療を未だ必要とするあらゆる研究参加者のために試験終了後のアクセスに関する条項を策定すべきである。また、この情報はインフォームド・コンセントの手続きの間に研究参加者に開示されなければならない」とされていることを踏まえ、「治験の枠組みの一環として、治験後患者への薬剤再投与(post trial access)も検討すべきであった」旨の指摘が出ています(松井健志構成員:国立がん研究センター生命倫理部長、生命倫理・医事法研究部長)。今後の制度改善を考える上で、重要論点の1つとなってくるかもしれません(制度上は、患者申出療養の前に、人道的治験など「他の選択肢」を探すこととなっている)。
本技術の平均的な費用としては、保険給付されない「患者申出療養に係る費用」は79万6000円、保険給付される費用は55万4000円となります。
「患者申出療養の実績報告」と「臨床研究の実績報告」との重複負担軽減を検討へ
また7月21日の患者申出療養評価会議では、次のような点について了承し、また報告を受けています。
(A)患者申出療養の実績報告は、従前どおり「前年7月1日から当該年6月30日までの間に行った患者申出療養の実績を、地方厚生(支)局に報告する」こととする
(B)8番目の患者申出療養である、遺伝子パネル検査でactionableな遺伝子異常を有すると判断された固形腫瘍に対する「マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」において、対象薬剤に「カプマチニブ」(販売名:タブレクタ錠150mg・同錠200mg)の追加などを行う
(C)7番目の患者申出療養である、早期乳がん患者への「ラジオ波熱焼灼療法」について、実施から2年経過し59症例・60乳房に当該技術が実施されており、これまでに重篤な有害事象が認められないことから継続を認める
まず(A)については、▼特定臨床研究では、実施計画を厚生労働大臣に提出した日から起算して1年ごとに厚生労働大臣へ定期報告を行う▼再生医療等安全性確保法が適用される研究では、再生医療等提供計画を提出した日から起算して1年ごとに再生医療等の提供の状況について報告を行う―こととの整合性が検討されましたが、患者申出療養では「他技術を含めて、同じ期間で費用等も可視化する」ことなどの特性があり、従来どおりの実績報告を求めることになりました。
ただし、医療機関サイドにしてみれば、「患者申出療養としての実績報告」と「特定臨床研究としての実績報告」等とを行わなければならず、大きな負担が生じています。このため、今後、報告内容の見直しなど負担軽減を図れないかを検討していきます。
また(B)は、一般的な患者申出療養とやや異なり、「予め『遺伝子パネル検査で、保険適応外の抗がん剤が効果的であると判明した患者には、当該保険外抗がん剤を保険診療と併用することを認める』という患者申出療養の枠組みを用意しておく」というものです。遺伝子パネル検査後に「●●抗がん剤の保険外使用を、患者申出療養として認めるべきか」との信義を1つ1つ行ったのでは、「間に合わない」可能性がある点を考慮した優れた患者申出療養です(関連記事はこちらとこちら)。
これまでにノバルティスファーマ社や中外製薬社、小野薬品社、ファイザー社、大塚製薬社から抗がん剤の無償提供が行われ(関連記事はこちら)、「遺伝子パネル検査で、当該医薬品が効果的である」と判明した場合には、速やかに当該薬剤による化学療法が実施されます。製薬メーカーサイドの協力により、無償提供される薬剤は順次、増えてきており、今般、ノバルティスファーマ社から、「MET遺伝子エクソン14スキッピング変異陽性の切除不能な進行・再発の非小細胞肺がん」への効能効果が認められている「カプマチニブ」(販売名:タブレクタ錠150mg・同錠200mg)の無償提供が行われることとなったものです(遺伝子パネル検査で、「上述の非小細胞肺がん」以外のがんへの効果がある可能性が判明した際に、(8)の患者申出療養の出番がやってくる)。
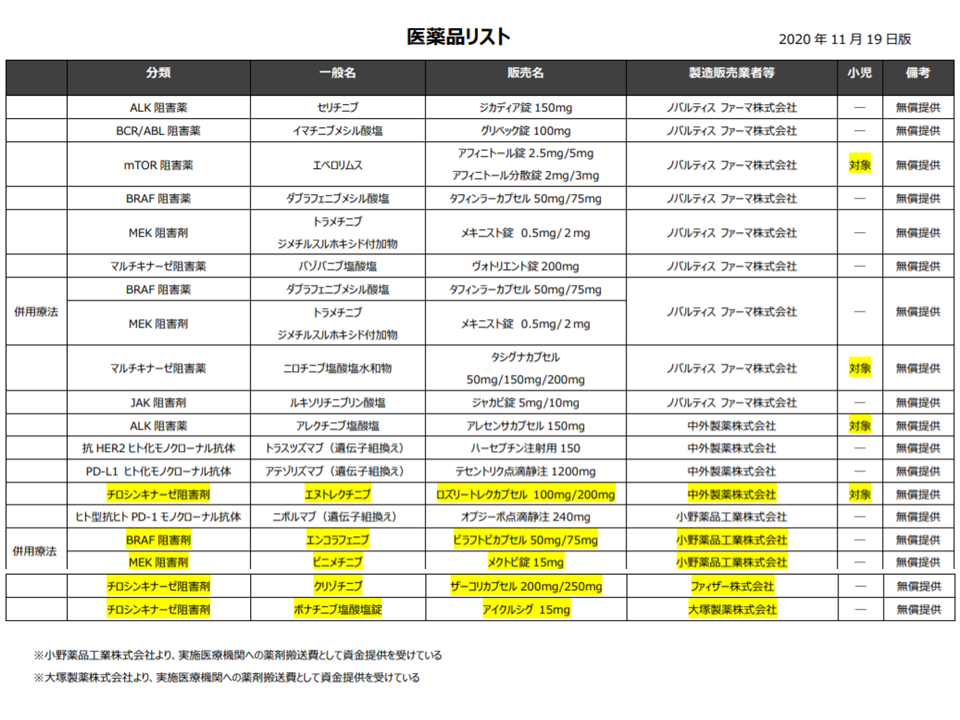
(8)の技術において、ノバルティスファーマ・中外製薬・小野薬品・ファイザー・大塚製薬から抗がん剤が無償提供されている(黄色部分が新規の無償提供)(患者申出療養評価会議2 210121)
併せて、本技術の実施医療機関に「静岡県立静岡がんセンター」も追加されています。
さらに、(C)は、ニードル電極針を経皮的に乳房内腫瘍に刺し、がん細胞を加熱・死滅させる技術で、「侵襲が少なく、整容面で大きなメリットがある」ものの、「手術療法に比べ再発リスクが高い可能性がある」と指摘されたことから、「定期的に状況報告を受け、技術の継続実施を認めるか否かを判断する」こととされています(関連記事はこちら)。
今般、技術実施から2年間の状況が報告され、「59症例・60乳房に実施。重篤な有害事象が認められない」ことが判明。患者申出療養では本技術の患者申出療養としての継続実施を認めています(当初計画では2024年まで)。
なお、本技術の実施医療機関に「国立がん研究センター東病院」も追加されています。
【関連記事】
患者申出療養で実施される保険外の医療技術、しかるべき時期に安全性・有効性の評価が必要—患者申出療養評価会議
患者申出療養の計画変更を了承、ただし「野放図な期間延長」などは好ましくない―患者申出療養評価会議
10番目の患者申出療養として、小児脳腫瘍へのエヌトレクチニブ投与療法を認める―患者申出療養評価会議
小児がん患者も迅速に「適応外の分子標的薬」にアクセスできる環境を整備―患者申出療養評価会議(2)
乳房外パジェットへのカドサイラ投与、9番目の患者申出療養として導入―患者申出療養評価会議(1)
小児がん患者が「最適な抗がん剤にアクセスしやすい環境」の整備に向け、患者申出療養を拡充―患者申出療養評価会議
遺伝子パネル検査に基づく「適応外抗がん剤」使用、患者申出療養での実施を承認―患者申出療養評価会議
遺伝子パネル検査に基づく抗がん剤の適応外使用想定した事前準備、国がんで進む―患者申出療養評価会議
患者申出療養評価会議からメーカーに「薬剤等供給」協力を要請する仕組み設ける―患者申出療養評価会議
早期乳がんのラジオ波熱焼灼治療を患者申出療養に導入、再発リスク説明等が必要―患者申出療養評価会議
遺伝子パネル検査で「適応外の抗がん剤治療」の可能性ある場合、迅速に治療開始できる準備進める―患者申出療養評価会議
「非代償性肝硬変へのハーボニー投与」、5種類目の患者申出療養に―患者申出療養評価会議
阪大病院での患者申出療養すべてで死亡含む重篤事象が発生、適切な患者選択を―患者申出療養評価会議
有効性・安全性の確立していない患者申出療養、必要最低限の患者に実施を—患者申出療養評価会議
心移植不適応患者への植込み型人工心臓DT療法、2例目の患者申出療養に―患者申出療養評価会議
2018年度改定に向けて、入院患者に対する「医師による診察(処置、判断含む)の頻度」などを調査―中医協総会
患者申出療養、座長が審議の場を判断するが、事例が一定程度集積されるまでは本会議で審議―患者申出療養評価会議
患者申出療養評価会議が初会合、厚労省「まずは既存の先進医療や治験の活用を」
患者申出療養の詳細固まる、原則「臨床研究」として実施し、保険収載を目指す―中医協
患者申出療養の提案受けた臨床研究中核病院、「人道的見地からの治験」の有無をまず確認―中医協総会
大病院受診、紹介状なしの定額負担など16年度から-医療保険部会で改革案まとまる
がん遺伝子パネル検査、「主治医が標準治療終了見込み」と判断した患者にも保険で実施可能―疑義解釈16【2018年度診療報酬改定】
がん遺伝子パネル検査、米国病理医協会(CAP)の第三者認定を受けた病院・検査機関で実施を―疑義解釈15【2018年度診療報酬改定】
がん遺伝子パネル検査等、保険診療上の留意事項を整理―厚労省
がんゲノム医療の推進に向け、遺伝子パネル検査を6月から保険収載―中医協総会(1)
遺伝子パネル検査の保険収載に向けた検討進む、C-CATへのデータ提出等を検査料の算定要件に―中医協総会(1)
新設される【がんゲノム医療拠点病院】要件固まる、3年で100人以上の治験等実績が「望ましい」―がんゲノム医療拠点病院等指定要件ワーキング
新設される「がんゲノム医療拠点病院」、中核病院なみの診療体制を敷きゲノム医療を自院で完結―がんゲノム医療拠点病院等指定要件ワーキング
がんゲノム医療、自分に最適な抗がん剤見つかる可能性は10-20%にとどまることなど説明を―がんゲノム医療推進コンソーシアム運営会議
がんゲノム医療を牽引する「中核拠点病院」として11病院を選定―がんゲノム医療中核拠点病院等指定検討会
がんゲノム医療を提供できる中核病院を、本年度(2017年度)中に7-10施設指定—がんゲノム医療懇談会
がんゲノム医療、当面は新設する「がんゲノム医療中核拠点病院」で提供―がんゲノム医療懇談会
がんとの闘いに終止符打つため、広く関係者が集い世界水準の「ゲノム医療」推進―厚労省





