17番目の患者申出療養「進行固形がん患者に対するペミガチニブ経口投与療法」を認める—患者申出療養評価会議
2023.10.23.(月)
17番目の患者申出療養として、「線維芽細胞増殖因子受容体阻害薬投与歴のある進行固形がん患者に対するペミガチニブ経口投与療法」を認める—。
10月19日に開催された患者申出療養評価会議で、こういった点が了承されました。

10月19日に開催された「第44回 患者申出療養評価会議」
治療中の薬剤が開発中止となり、同効のペミガチニブを患者申出療養を活用して使用へ
患者申出療養は、傷病と闘う患者の「海外で開発された未承認(保険外)等の医薬品や医療機器を使用してみたい」という希望・申し出を起点に、当該医療技術(未承認の医薬品等)に一定の安全性・有効性があることを評価会議で確認した上で、保険診療との併用を許可する仕組みです(2016年4月スタート)。
これまでに、次の16種類の患者申出療養が認められています(ただし「2」「3」「4」「5」「10」の技術はすでに新規患者の登録を終了、さらに後述するように「11」の技術も終了する)。
(1)腹膜播種・進行性胃がん患者への「パクリタキセル腹腔内投与および静脈内投与ならびにS-1内服併用療法」
(2)心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」(関連記事はこちら)
(3)難治性天疱瘡患者への「リツキシマブ静脈内投与療法」(関連記事はこちら)
(4)髄芽腫、原始神経外胚葉性腫瘍または非定型奇形腫様ラブドイド腫瘍患者への「チオテパ静脈内投与、カルボプラチン静脈内投与およびエトポシド静脈内投与ならびに自家末梢血幹細胞移植術の併用療法」(関連記事はこちら)
(5)ジェノタイプ1型C型肝炎ウイルス感染に伴う非代償性肝硬変患者への「レジパスビル・ソホスブビル経口投与療法」(関連記事はこちら)
(6)進行固形がん(線維芽細胞増殖因子受容体に変化を認め、従来治療法が無効、かつインフィグラチニブによる治療を行っているものに限る)患者への「インフィグラチニブ経口投与療法」(関連記事はこちら)
(7)早期乳がん患者への「ラジオ波熱焼灼療法」(関連記事はこちら)
(8)遺伝子パネル検査でactionableな遺伝子異常を有すると判断された固形腫瘍に対する「マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」(関連記事はこちらとこちら)
(9)HER2陽性の手術不能または再発の乳房外パジェット病患者に対する「トラスツズマブ エムタンシン(カドサイラ点滴静注用)静脈内投与療法」(関連記事はこちら)
(10)ROS1融合遺伝子陽性の進行性小児脳腫瘍患者に対する「エヌトレクチニブ(販売名:ロズリートレクカプセル)の経口投与療法」(関連記事はこちら)
(11)免疫グロブリンGサブクラス4自己抗体陽性難治性慢性炎症性脱髄性多発神経炎患者に対する「リツキシマブ追加投与療法」(関連記事はこちら)
(12)BRAFV600変異陽性の進行性神経膠腫を有する小児を対象とした「ダブラフェニブ・トラメチニブ併用療法」(関連記事はこちら)
(13)BRAF V600変異陽性の局所進行・転移性小児固形腫瘍に対する「ダブラフェニブ・トラメチニブの第II相試験」(関連記事はこちら)
(14)EZH2阻害薬の有効性が期待される標準治療がない、または治療抵抗性の小児・AYA悪性固形腫瘍に対する「タゼメトスタット療法」(関連記事はこちら)
(15)胸部悪性腫瘍に対する「経皮的凍結融解壊死療法」(関連記事はこちらとこちら)
(16)筋萎縮性側索硬化症(ALS)に対する「EPI-589再投与」の安全性に関する研究こちら)
10月19日の会合では、17番目の患者申出療養として「線維芽細胞増殖因子受容体阻害薬投与歴のある進行固形がん患者に対するペミガチニブ経口投与療法」が認められました。
2018年に6番目の患者申出療養である「進行固形がん(線維芽細胞増殖因子受容体に変化を認め、従来治療法が無効、かつインフィグラチニブによる治療を行っているものに限る)患者へのインフィグラチニブ経口投与療法」が認められ(関連記事はこちら)、治療が継続されてきました。この患者申出療養の結果も踏まえて、国内外で未承認であったFGF-R阻害剤「インフィグラチニブ」の薬事承認が目指されていました。
しかし、製薬企業が「インフィグラチニブ」の薬事承認を断念。このままでは治療継続が不可能になるため、当該患者が「同じ薬効(FGF-R阻害剤)である【ペミガチニブ】(販売名:ペマジール錠4.5mg)による治療継続」を希望。ただし、ペマジール錠の効能・効果は▼がん化学療法後に増悪したFGFR2融合遺伝子陽性の治癒切除不能な胆道がん▼FGFR1融合遺伝子陽性の骨髄性またはリンパ性腫瘍—であり、当該患者に使用する場合には「適応外使用」で医療費は全額自己負担となるのが原則です。
このため、「患者申出療養」制度を活用し、「保険診療」と「保険外診療」(ここではペマジール錠の適応外使用)との併用を患者が希望し、今般、名古屋大学医学部附属病院が申請を行ったものです。ペマジール錠の適応拡大に向けた治験・拡大治験は予定されておらず、仮に治験が行われたとしても、「すでにFGF-R阻害剤投与を受けたことがある患者」は治験対象から除外されると強く予想されることから、患者申出療養が選択されています。
名大病院では、次のような実施計画書を提出しています。
▽対象患者:FGF-Rに変化を認めた「FGF-R阻害薬」投与歴のある進行固形がん患者
▽「ペミガチニブ経口投与療法」の有効性・安全性を評価する(評価結果をもとに適応拡大を目指す)
▽主要評価項目:治療開始後16週までの最良総合効果
▽登録期間:6か月、▽追跡期間:登録終了後5年、解析期間:1年

線維芽細胞増殖因子受容体阻害薬投与歴のある進行固形がん患者に対するペミガチニブ経口投与療法(患者申出療養評価会議1 231019)

薬事承認までのロードマップ(患者申出療養評価会議2 231019)
患者の「治療薬の開発がストップし、このままでは治療継続できなくなる。同効のFGF-R阻害剤『ペミガチニブ』(販売名:ペマジール錠4.5mg)を患者申出療養で使用した治療を受けたい」という切なる思いに応えるもので、10月19日の患者申出療養評価会議では「適」と判断されています。
なお、当該薬剤(ペマジール錠4.5mg)は製薬メーカー(インサイト・バイオサイエンシズ・ジャパン社)から無償提供されます。
多発神経炎患者に対するリツキシマブ追加投与療法、全症例治療を終え「結果の分析」へ
また、10月19日の患者申出療養評価会議では、次のような点も了承されました。
▽(7)の「早期乳がん患者へのラジオ波熱焼灼療法」(関連記事はこちら)について半年毎の定期報告を受けており、今般、4年6月目の定期報告が行われ「128症例・130乳房に当該技術を実施し、重篤な有害事象が生じている」ことを確認。今後も患者申出療養として継続する

早期乳がん患者へのラジオ波熱焼灼療法(患者申出療養評価会議3 231019)
▽(8)の「遺伝子パネル検査でactionableな遺伝子異常を有すると判断された固形腫瘍に対するマルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」(関連記事はこちらとこちら)について、▼新たな遺伝子パネル検査「Guardant360 CDx がん遺伝子パネル」「GenMineTOP がんゲノムプロファイリングシステム」が保険適用された▼対象抗がん剤の1つ「ロズリートレクカプセル」の安全性に関する添付文書改訂(「肝機能障害患者への投与では、減量を考慮するとともに、患者の状態をより慎重に観察し副作用の発現に十分注意する」など)が行われた—ことに伴って、実施計画の一部を見直す
▽(11)の「免疫グロブリンGサブクラス4自己抗体陽性難治性慢性炎症性脱髄性多発神経炎患者に対するリツキシマブ追加投与療法」(関連記事はこちら)について、全ての症例について登録・プロトコル治療が終了し、データ固定が完了したため、患者申出療養を取り下げる(今後「総括報告書」が提出される)
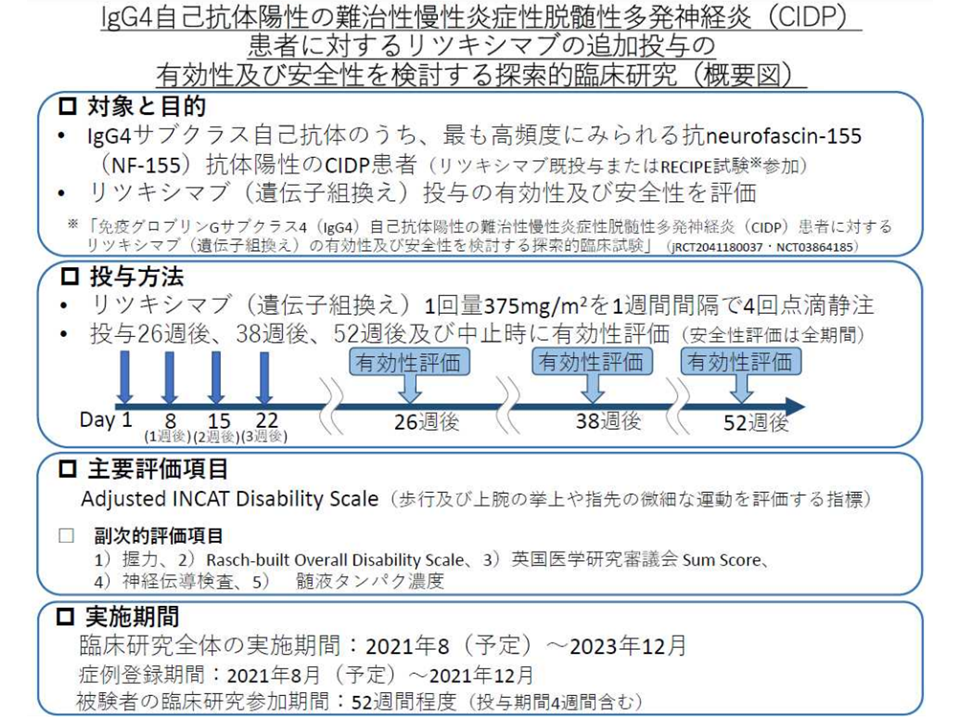
免疫グロブリンGサブクラス4自己抗体陽性難治性慢性炎症性脱髄性多発神経炎患者に対するリツキシマブ追加投与療法(患者申出療養評価会議4 231019)
なお、(7)の「早期乳がん患者へのラジオ波熱焼灼療法」は、近く保険適用される可能性が高く、その場合には患者申出療養の役割は終了することになります。患者申出療養の実施状況も踏まえて、安全性・有効性が確認された技術が保険診療に組み込まれ、より多くの患者が受けられるようになることは非常に喜ばしいと言えます。
ところで、10月19日の患者申出療養評価会議では、がん患者代表として参画する天野慎介構成員(全国がん患者団体連合会理事長)から「治験・拡大治験として行われるべき技術が行われず、患者申出療養を選択せざるを得ないケースが少なくないと聞く。治験・拡大治験の適切な実施を、国からも企業・研究者に促してほしい」との要請がなされました。
患者申出療養は、「臨床研究中核病院の申請」から「患者申出療養としての実施」まで6週間(既存技術であれば2週間)とする優れた仕組みですが、患者から「我が国では保険診療の中で実施できない●●技術を受けたい」との申し出があり、▼かかりつけ医との相談▼臨床研究中核病院への相談▼臨床研究中核病院における診療計画(プロトコル)作成―などを経て、国への申請が行われるまでには、少なくとも「数か月」かかってしまうのが実際です(このため(8)の技術では、事前に計画書の雛形を用意するといった工夫がなされている、関連記事はこちらとこちら)。
このため天野委員は「患者申出療養を選択せざるを得ない状況に患者が陥る前に、企業・研究者サイドが治験・拡大治験を適切に実施してほしい」と要請しています。
【関連記事】
小児・AYAがん患者へ「効果が期待される未承認・適応外の分子標的薬」を迅速投与可能な仕組みを整備―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、新たに「ペマジール錠4.5mg」を対象薬剤に追加―患者申出療養評価会議
16番目の患者申出療養「ALSの新規治療薬開発研究」を承認、パクリタキセル腹腔内投与療法の有用性臨床研究進めよ―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、メキニスト錠の安全性・有用性分析ステージに入る―患者申出療養評価会議
15番目の患者申出療養、標準治療を実施できない胸部悪性腫瘍に対する「経皮的凍結融解壊死療法」を承認―患者申出療養評価会議
小児がん患者、遺伝子パネル検査後に「効果が期待される未承認・適応外の分子標的薬」へ迅速投与できる仕組み検討―患者申出療養評価会議
14番目の患者申出療養、「EZH2阻害薬の有効性が期待される小児・AYAがん患者」へのタゼメトスタット療法を承認―患者申出療養評価会議
13番目の患者申出療養、「BRAF V600変異陽性の小児固形がん」への抗がん剤併用療法を条件付きで承認―患者申出療養評価会議
進行性胃がんへのパクリタキセル・S-1併用療法、乳房外パジェットへのカドサイラ投与など実施計画見直し―患者申出療養評価会議
「進行性胃がんへのパクリタキセル・S-1併用」療法、エビデンスないまま自由診療を継続することが適切か―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、ニラパリブを対象薬剤に追加―患者申出療養評価会議
耳介後部コネクター用いるDT療法の有効性に期待、遺伝子パネル検査による抗がん剤治療で対象薬剤追加―患者申出療養評価会議
患者申出療養から「初の薬事承認・保険適用」技術登場、抗がん剤「適応拡大」にも期待集まる―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、リキッドバイオプシーも検査対象に追加―患者申出療養評価会議
12番目の患者申出療養、「BRAF V600変異陽性の小児神経膠腫」への抗がん剤併用療法を承認―患者申出療養評価会議
11番目の患者申出療養として、難病CIDPへのリツキシマブ追加投与療法を認める―患者申出療養評価会議
患者申出療養で実施される保険外の医療技術、しかるべき時期に安全性・有効性の評価が必要—患者申出療養評価会議
患者申出療養の計画変更を了承、ただし「野放図な期間延長」などは好ましくない―患者申出療養評価会議
10番目の患者申出療養として、小児脳腫瘍へのエヌトレクチニブ投与療法を認める―患者申出療養評価会議
小児がん患者も迅速に「適応外の分子標的薬」にアクセスできる環境を整備―患者申出療養評価会議(2)
乳房外パジェットへのカドサイラ投与、9番目の患者申出療養として導入―患者申出療養評価会議(1)
小児がん患者が「最適な抗がん剤にアクセスしやすい環境」の整備に向け、患者申出療養を拡充―患者申出療養評価会議
遺伝子パネル検査に基づく「適応外抗がん剤」使用、患者申出療養での実施を承認―患者申出療養評価会議
遺伝子パネル検査に基づく抗がん剤の適応外使用想定した事前準備、国がんで進む―患者申出療養評価会議
患者申出療養評価会議からメーカーに「薬剤等供給」協力を要請する仕組み設ける―患者申出療養評価会議
早期乳がんのラジオ波熱焼灼治療を患者申出療養に導入、再発リスク説明等が必要―患者申出療養評価会議
遺伝子パネル検査で「適応外の抗がん剤治療」の可能性ある場合、迅速に治療開始できる準備進める―患者申出療養評価会議
「非代償性肝硬変へのハーボニー投与」、5種類目の患者申出療養に―患者申出療養評価会議
阪大病院での患者申出療養すべてで死亡含む重篤事象が発生、適切な患者選択を―患者申出療養評価会議
有効性・安全性の確立していない患者申出療養、必要最低限の患者に実施を—患者申出療養評価会議
心移植不適応患者への植込み型人工心臓DT療法、2例目の患者申出療養に―患者申出療養評価会議
2018年度改定に向けて、入院患者に対する「医師による診察(処置、判断含む)の頻度」などを調査―中医協総会
患者申出療養、座長が審議の場を判断するが、事例が一定程度集積されるまでは本会議で審議―患者申出療養評価会議
患者申出療養評価会議が初会合、厚労省「まずは既存の先進医療や治験の活用を」
患者申出療養の詳細固まる、原則「臨床研究」として実施し、保険収載を目指す―中医協
患者申出療養の提案受けた臨床研究中核病院、「人道的見地からの治験」の有無をまず確認―中医協総会
大病院受診、紹介状なしの定額負担など16年度から-医療保険部会で改革案まとまる





