小児・AYAがん患者へ「効果が期待される未承認・適応外の分子標的薬」を迅速投与可能な仕組みを整備―患者申出療養評価会議
2023.9.22.(金)
小児がん患者、AYA世代のがん患者に対し「効果が期待される未承認・適応外の分子標的薬」を投与できる仕組みを事前に準備しておき、患者・家族の要望があったに際に迅速に応えられる環境を整える—。
9月21日に開催された患者申出療養評価会議で、こういった点が了承されました。年内(2023年内)にも「患者・家族からの要望」がなされると見込まれ、年明け早々(2024年1月頃)から実際に小児・AYA世代がん患者に最適な分子標的薬が提供される仕組みが稼働すると予想されます(関連記事はこちら)。

9月21日に開催された「第43回 患者申出療養評価会議」
がんゲノム医療で「適応外の抗がん剤が最適」とされた際に、患者申出療養を活用
患者申出療養は、傷病と闘う患者の「海外で開発された未承認(保険外)等の医薬品や医療機器を使用してみたい」という希望・申し出を起点に、当該医療技術(未承認の医薬品等)に一定の安全性・有効性があることを評価会議で確認した上で、保険診療との併用を許可する仕組みです(2016年4月スタート)。
これまでに、次の16種類の患者申出療養が認められています(ただし「2」「3」「4」「5」「10」の技術はすでに新規患者の登録を終了)。
(1)腹膜播種・進行性胃がん患者への「パクリタキセル腹腔内投与および静脈内投与ならびにS-1内服併用療法」
(2)心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」(関連記事はこちら)
(3)難治性天疱瘡患者への「リツキシマブ静脈内投与療法」(関連記事はこちら)
(4)髄芽腫、原始神経外胚葉性腫瘍または非定型奇形腫様ラブドイド腫瘍患者への「チオテパ静脈内投与、カルボプラチン静脈内投与およびエトポシド静脈内投与ならびに自家末梢血幹細胞移植術の併用療法」(関連記事はこちら)
(5)ジェノタイプ1型C型肝炎ウイルス感染に伴う非代償性肝硬変患者への「レジパスビル・ソホスブビル経口投与療法」(関連記事はこちら)
(6)進行固形がん(線維芽細胞増殖因子受容体に変化を認め、従来治療法が無効、かつインフィグラチニブによる治療を行っているものに限る)患者への「インフィグラチニブ経口投与療法」(関連記事はこちら)
(7)早期乳がん患者への「ラジオ波熱焼灼療法」(関連記事はこちら)
(8)遺伝子パネル検査でactionableな遺伝子異常を有すると判断された固形腫瘍に対する「マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」(関連記事はこちらとこちら)
(9)HER2陽性の手術不能または再発の乳房外パジェット病患者に対する「トラスツズマブ エムタンシン(カドサイラ点滴静注用)静脈内投与療法」(関連記事はこちら)
(10)ROS1融合遺伝子陽性の進行性小児脳腫瘍患者に対する「エヌトレクチニブ(販売名:ロズリートレクカプセル)の経口投与療法」(関連記事はこちら)
(11)免疫グロブリンGサブクラス4自己抗体陽性難治性慢性炎症性脱髄性多発神経炎患者に対する「リツキシマブ追加投与療法」(関連記事はこちら)
(12)BRAFV600変異陽性の進行性神経膠腫を有する小児を対象とした「ダブラフェニブ・トラメチニブ併用療法」(関連記事はこちら)
(13)BRAF V600変異陽性の局所進行・転移性小児固形腫瘍に対する「ダブラフェニブ・トラメチニブの第II相試験」(関連記事はこちら)
(14)EZH2阻害薬の有効性が期待される標準治療がない、または治療抵抗性の小児・AYA悪性固形腫瘍に対する「タゼメトスタット療法」(関連記事はこちら)
(15)胸部悪性腫瘍に対する「経皮的凍結融解壊死療法」(関連記事はこちらとこちら)
(16)筋萎縮性側索硬化症(ALS)に対する「EPI-589再投与」の安全性に関する研究こちら)
9月21日の会合では、(12)の技術と(14)の技術について計画の見直しのほか、新たな「小児・AYAがん患者が、迅速に最適な分子標的薬へアクセス可能な仕組み」の事前審議を行いました。後者から見てみましょう。
まず、がんゲノム医療と患者申出療養との関係をおさらいしておきます。
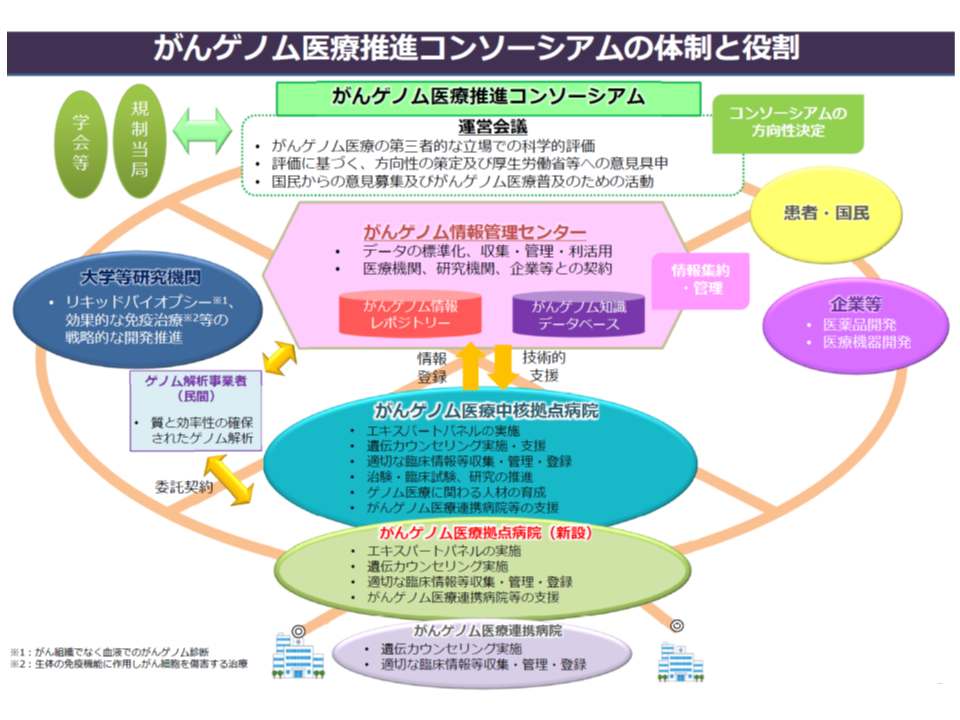
Gem Medでも繰り返し報じているとおり、我が国でも「がんゲノム医療」が実施・推進されてきています。がんゲノム医療は次のような流れで進められます。
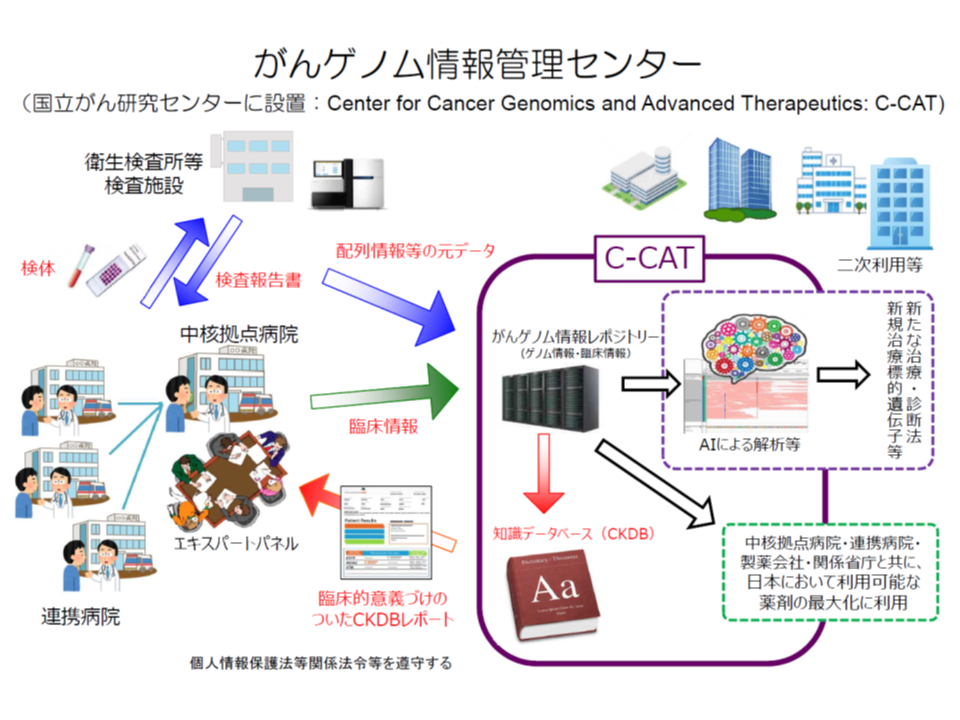
(1)患者の同意を得た上で、患者の遺伝子情報・臨床情報を「がんゲノム情報管理センター」(C-CAT、国立がん研究センターに設置)に送付する
↓
(2)C-CATで、送付されたデータを「がんゲノム情報のデータベース」(がんゲノム情報レポジトリー・がん知識データベース)に照らし、当該患者のがん治療に有効と考えられる抗がん剤候補や臨床試験・治験などの情報を整理する
↓
(3)がんゲノム医療中核拠点病院・がんゲノム医療拠点病院の専門家会議(エキスパートパネル)において、C-CATからの情報を踏まえて当該患者に最適な治療法を選択し、これに基づいた医療を提供する
ただし、遺伝子パネル検査により有効な抗がん剤が見つかる可能性は現時点では1割弱にとどまっており(関連記事はこちら)、また「有効な抗がん剤が見つかったものの、保険適応外(当該がん種への効能効果が薬事承認されていない)・未承認(本邦での使用が薬事承認されていない)であった」というケースも少なくありません。
適応外・未承認の抗がん剤を使用する場合には、原則として「一連の治療すべてが自己負担」となり(混合診療の禁止)、患者の経済的負担が非常に重くなります。
そこで、患者の経済的負担を軽減し、より円滑に「未承認・適応外の抗がん剤にアクセス」可能とするために「患者申出療養」制度が設けられています。2019年秋には(8)番目の患者申出療養として「遺伝子パネル検査でactionableな遺伝子異常を有すると判断された固形腫瘍に対する『マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療』」が設けられました(関連記事はこちら)。
ところで本技術については、他の患者申出療養とは少し違った枠組みが設けられています。通常であれば「患者から適応外の●●抗がん剤を使用したい」などの申し出を受けてから計画を作成し、患者申出療養評価会議で実施の可否を審議するという流れになりますが、▼かかりつけ医との相談▼臨床研究中核病院への相談▼臨床研究中核病院における診療計画(プロトコル)作成―などを経て、患者申出療養評価会議での申請が行われるまでには、少なくとも「数か月」かかってしまうのが実際です。
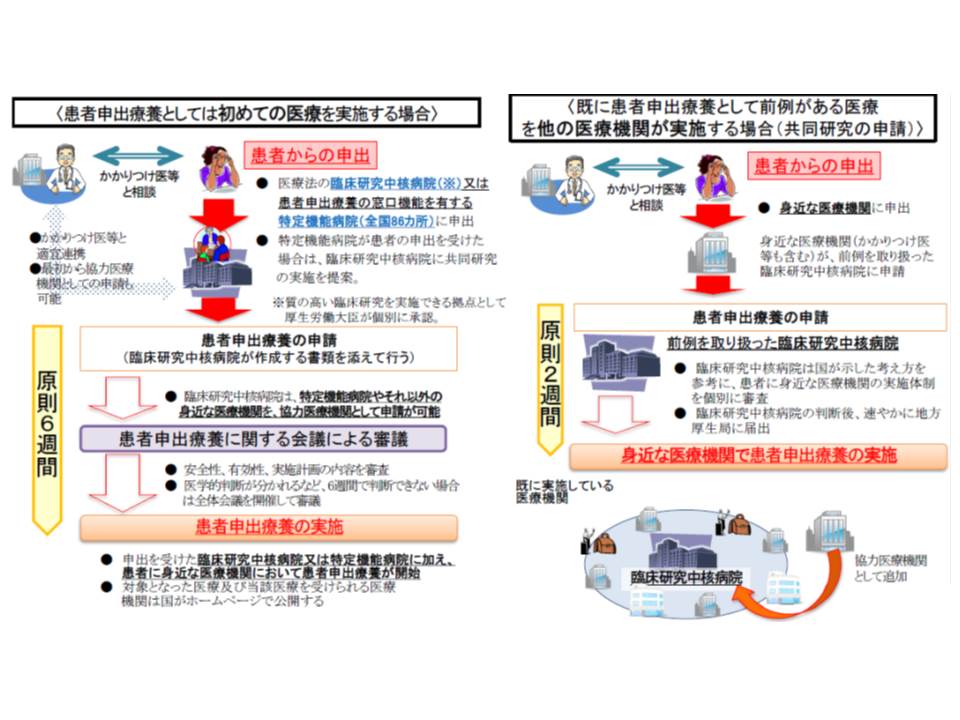
前例のない医療技術については原則6週間で保険外併用の可否を判断し、前例のある医療技術については原則2週間で「身近な医療機関での実施」の可否を判断する
遺伝子パネル検査の対象は、現在「標準治療を終えた患者」とされ、こうした数か月の手続き期間に容体が急変し、最悪の場合亡くなってしまう可能性もあります。
このため「より迅速に最適な分子標的薬にアクセスできる仕組み」が求められ、▼事前に国立がん研究センターで、いわば『患者申出療養の計画』の雛形作成までを準備しておく▼多くの抗がん剤(分子標的薬)を使用可能とする手続きを踏んでおく—こととし、実際に患者から「未承認・適応外の抗がん剤を使用したい」と要望があった際、速やかにこの仕組みに沿って「未承認・適応外の医薬品を患者申出療養の中で使用できる」ような体制が整えられたのです(通常診療部分は医療保険を使って1-3割負担、未承認・適応外の医薬品費などは保険外の自己負担)。
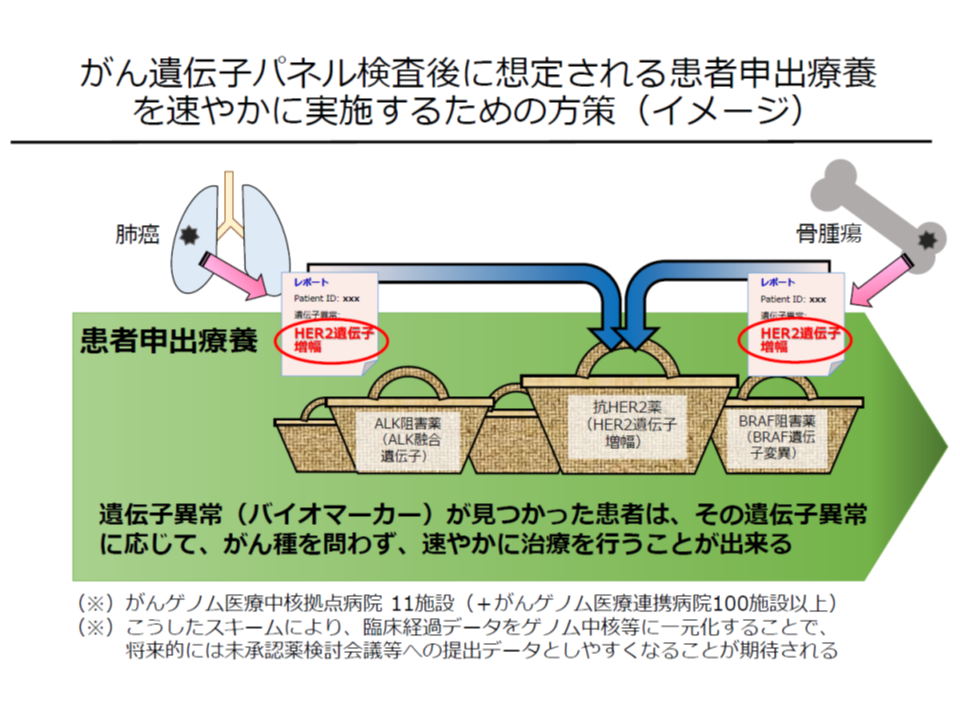
「適応外の抗がん剤」治療で効果があると判明した患者が、一刻も早く患者申出療養を申請できるよう、臨床研究中核病院で「下準備」を進めておく
すでに多くの患者が未承認・適応外薬にアクセスし、また対象薬剤の範囲もメーカーの協力で進んでいます(関連記事はこちらとこちらとこちら)。
小児がん患者等でも、患者申出療養を活用し、迅速な「最適な抗がん剤」治療を可能に
このように、がん患者の切なる思いに応える仕組みが設けられていますが、小児がん患者・家族からは「小児を適応とした抗がん剤は限られており、小児がん患者では、患者申出療養評価会議が使いにくい」といった声が出ています。
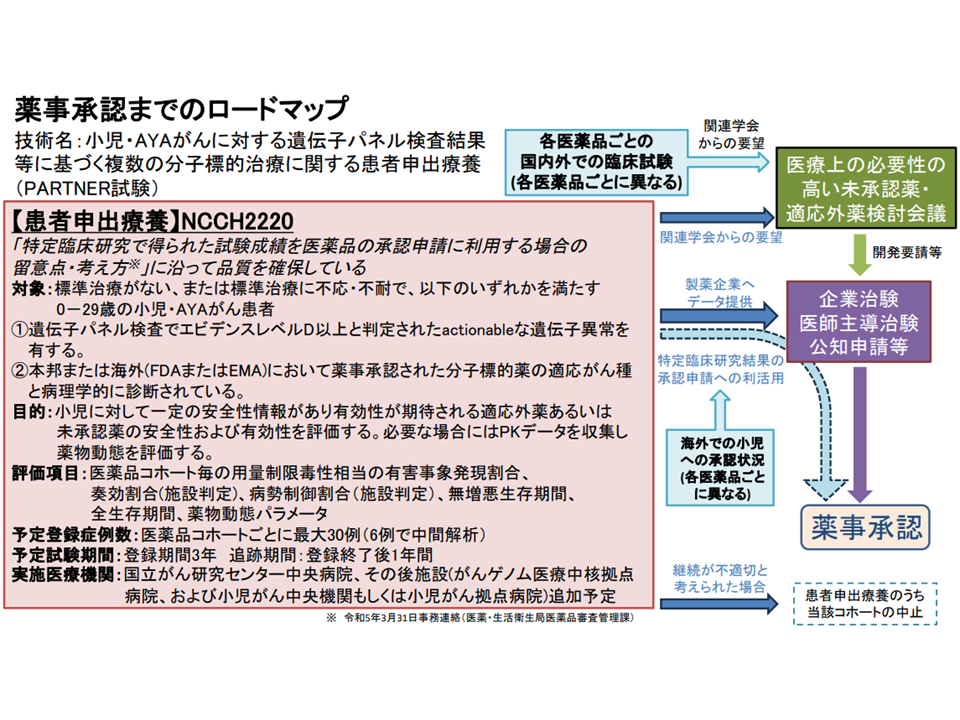
こうした声を受け、国立がん研究センター中央病院小児腫瘍科の小川千登世科長が「小児に特化した、未承認・適応外の抗がん剤を患者申出療養を活用して円滑に使用可能とする」仕組みを検討。今般、患者申出療養評価会議で「事前の審議」が行われました。通常であれば、上述のように「実際に患者からの申し出があってから計画を審議する」ことになりますが、「患者・家族の思いに迅速に対応できるよう、事前に仕組みの大枠を整えておくことが重要である」「計画修正が必要となった場合には相応の時間がかかるため、構成員の意見を早期に聞いておくことが重要である」との判断に基づく事前審議と言えます。
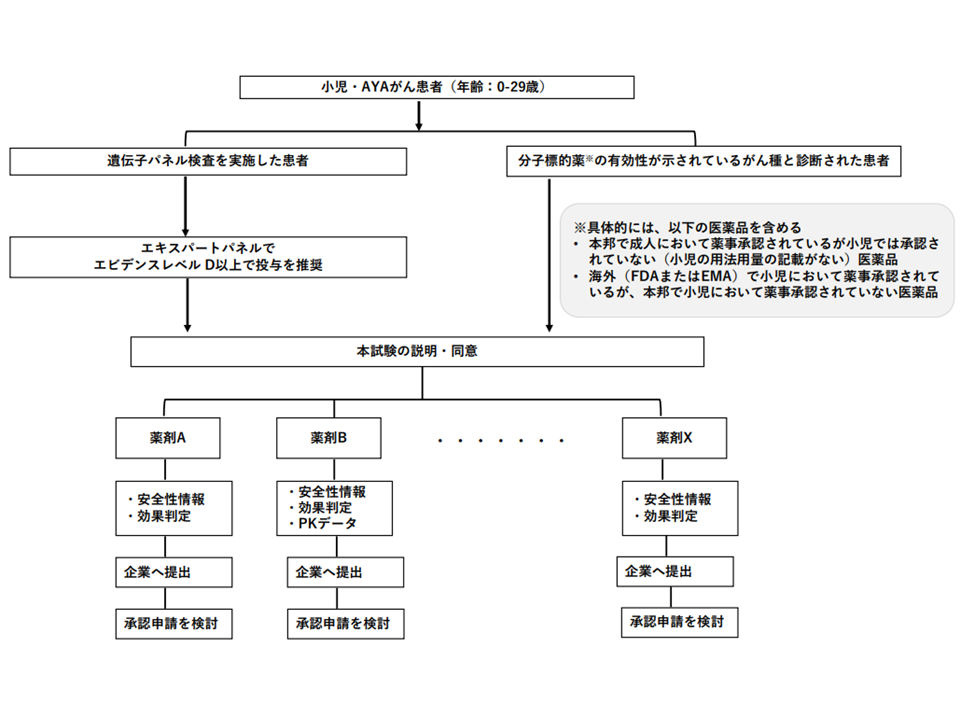
対象患者は、「標準治療がない、または標準治療に不応・不耐であり、次の(a)(b)いずれかに該当するゼロ歳から29歳のがん患者」とされます。
(a)遺伝子パネル検査(我が国で保険適用済み・評価療養として実施)を受け、actionableな遺伝子異常を有することが判明している。かつ、エビデンスレべルD以上と判定されたactionableな遺伝子異常と、それに基づく治療選択肢を提示したエキスパートパネル報告書、およびその根拠となった遺伝子パネル報告書がある
(b)我が国または海外(FDA(アメリカ食品医薬品局)またはEMA(欧州医薬品庁))で薬事承認された分子標的薬(▼我が国で成人には薬事承認されているが小児では承認されていない(小児の用法用量の記載がない)医薬品▼海外(FDAまたはEMA)で小児に薬事承認されているが、我が国で小児に薬事承認されていない医薬品—)の適応がん種と病理学的に診断されている
このうち(a)は成人の仕組み((8)の技術)と同様ですが、小児では(b)のケースも患者申出療養の対象となる点が特徴的です。

小児がん等に最適な分子標的薬使用を可能とする新たな仕組み1(患者申出療養評価会議1 230921)
小児がん等に最適な分子標的薬使用を可能とする新たな仕組み2(患者申出療養評価会議2 230921)
対象となる抗がん剤(分子標的薬)は、現在、ノバルティスファーマ社の▼グリベック錠▼ヴォトリエント錠▼ジャカビ錠▼メキニスト錠—の4種類がメーカーから無償提供されることが決まっていますが、早々に拡大していくと見込まれます。
こうした要件を満たす患者・家族から「効果があると予測される抗がん剤(分子標的薬)を使用したい」との要望があった場合に、医師からの十分な説明と患者サイドの同意(安全性が十分に確認されていないことなど)を経て、適応外の抗がん剤(分子標的薬)投与がなされます。事前に1つ1つの抗がん剤について「当該薬剤を使用する場合の患者申出療養計画」を作成しておき、ここにマッチする患者が現れた場合には、この計画に沿って迅速に当該薬剤を用いた治療が開始されるイメージです。
各薬剤について「30症例」(6症例で中間解析を実施)を対象とし、投与後(追跡期間1年間)のデータ(用量制限毒性(Dose Limiting Toxicity, DLT)相当の有害事象発現割合、有害事象発生割合、奏効割合、病勢制御割合、無増悪生存期間、全生存期間、薬物動態パラメータなど)を収集し、将来の適応拡大(小児の用法用量追加→保険適用の拡大)を目指します。ただし症例数が限定されていることから「このデータだけで適応拡大に向けた議論は進むと考えにくい」「直ちに追加試験などが進むことも考えにくい」という問題点もあります。山口俊晴構成員(がん研究会有明病院名誉院長)や上村尚人構成員(大分大学医学部臨床薬理学講座教授)は「早期の適応拡大(=保険診療として最適な抗がん剤使用が可能になる)に向けた工夫等を厚生労働省でも考えてほしい」と強く要望しています。
小児がん等に最適な分子標的薬使用を可能とする新たな仕組み3(患者申出療養評価会議3 230921)
なお、15歳以上の患者については、今回の新たな計画と、すでに成人で進んでいる(8)の技術との双方で対象となる可能性があります。この点については、次のような役割分担の考え方が示されました。
【要件(a)を満たす場合】
▽15歳以上で、(8)技術の要件を満たす場合には、(8)技術で対応する
▽ゼロから14歳の患者は本技術(新技術)で対応する
【要件(b)のうち「我が国で成人には薬事承認されているが小児では承認されていない医薬品の適応がん種と病理学的に診断されている」を満たす場合】
▽15歳以上の患者は「保険診療」で当該医薬品投与が可能である
▽ゼロから14歳の患者は本技術(新技術)で対応する((8)技術の対象とならない)
【要件(b)のうち「海外(FDAまたはEMA)で小児に薬事承認されているが、我が国で小児に薬事承認されていない医薬品の適応がん種と病理学的に診断されている」を満たす場合】
▽(8)技術の対象とならないため本技術(新技術)で対応するが、対象れ年齢は「該当薬剤の海外での薬事承認範囲」を踏まえて、それぞれに設定する
この仕組みで「抗がん剤(分子標的薬)の小児等への適応拡大」などが進めば、がん対策の中で大きな問題となっている「小児におけるドラッグラグ・ロス」について解消の糸口が見えてくるとともに、何よりも「現在、闘病中の小児がん患者やその家族」が最適な治療法へアクセスできる環境が整います。こうした点を重視し、患者申出療養評価会議は、本技術(新技術)を「患者申出療養として実施することが適当である」と判断しました。年内(2023年内)にも「患者・家族からの要望」がなされる(その際には改めて患者申出療養評価会議で審議を行う)と見込まれ、年明け早々(2024年1月頃)から実際に小児・AYA世代がん患者に最適な分子標的薬が提供される仕組みが稼働すると予想されます。
なお、本技術(新技術)については「AMEDから研究費(臨床研究マネジメントなどのセントラルラル業務や症例登録等のコストを賄う)が支給されており、また特定臨床研究として実施される。患者起点と言いにくく、患者申出療養としての実施は好ましくないのではないか」(松井健志構成員:国立がん研究センターがん対策研究所生命倫理・医事法研究部長)との指摘もありました。しかし、多くの構成員や厚労省は、▼研究費助成・特定臨床研究がなされていることが、ただちに患者申出療養での実施を否定するものではない▼研究費助成により、患者の追加負担は非常に少なくなり好ましい面が大きい(通常の保険診療でのがん治療と同程度に収まる)▼小児がん患者・家族等からの「最適な抗がん剤を、医師管理の下で使用したい」との声は大きく、「患者起点での技術」と捉えることができる—との考えを示しています。
繰り返しになりますが、未承認・適応外の医薬品を使用する診療は、原則として「全額、自己負担」となってしまい(混合診療の禁止)、「保険診療と、未承認・適応外の医薬品使用とを併用する」道は、大きく▼治験▼先進医療▼患者申出療養—の3つしかありません。しかし、症例数の少ない「小児がん治療薬」などは治験や先進医療に馴染みにくく、「現在、闘病中の小児患者」の思いに迅速に応えるためには「患者申出療養が最も馴染みやすい」(実質的にこの手法しかとりえない)という点に最大限の留意が必要です。
また9月21日の会合では、(12)技術、(14)技術について計画の一部見直しが承認されています。
(12)BRAFV600変異陽性の進行性神経膠腫を有する小児を対象とした「ダブラフェニブ・トラメチニブ併用療法」(関連記事はこちら)
↓
計画の中に、「FDAで、ダブラフェニブとトラメチニブの併用療法について、2022年6月に「6歳以上の切除不能BRAFV600E変異陽性の全ての固形腫瘍」に対する使用が、2023年3月に「1歳以上の切除不能BRAFV600E 変異陽性の低悪性度神経膠腫」に対する使用が薬事承認された」旨を記載するなどの変更を行う
(14)EZH2阻害薬の有効性が期待される標準治療がない、または治療抵抗性の小児・AYA悪性固形腫瘍に対する「タゼメトスタット療法」(関連記事はこちら)
↓
計画において「併用禁止薬の変更」を行う
なお、(12)技術については、これまでに「患者アクセスを考慮し多施設共同研究としたほうがよいではないか」などの指摘がなされています。この指摘を受け、実施施設である北海道大学病院から、「国立がん研究センター中央病院」と「京都大学医学部付属病院」との共同研究に向けた交渉を進めている旨が報告されました。準備が整った暁には、上述のように「実施計画の見直し」が行われます。
【関連記事】
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、新たに「ペマジール錠4.5mg」を対象薬剤に追加―患者申出療養評価会議
16番目の患者申出療養「ALSの新規治療薬開発研究」を承認、パクリタキセル腹腔内投与療法の有用性臨床研究進めよ―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、メキニスト錠の安全性・有用性分析ステージに入る―患者申出療養評価会議
15番目の患者申出療養、標準治療を実施できない胸部悪性腫瘍に対する「経皮的凍結融解壊死療法」を承認―患者申出療養評価会議
小児がん患者、遺伝子パネル検査後に「効果が期待される未承認・適応外の分子標的薬」へ迅速投与できる仕組み検討―患者申出療養評価会議
14番目の患者申出療養、「EZH2阻害薬の有効性が期待される小児・AYAがん患者」へのタゼメトスタット療法を承認―患者申出療養評価会議
13番目の患者申出療養、「BRAF V600変異陽性の小児固形がん」への抗がん剤併用療法を条件付きで承認―患者申出療養評価会議
進行性胃がんへのパクリタキセル・S-1併用療法、乳房外パジェットへのカドサイラ投与など実施計画見直し―患者申出療養評価会議
「進行性胃がんへのパクリタキセル・S-1併用」療法、エビデンスないまま自由診療を継続することが適切か―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、ニラパリブを対象薬剤に追加―患者申出療養評価会議
耳介後部コネクター用いるDT療法の有効性に期待、遺伝子パネル検査による抗がん剤治療で対象薬剤追加―患者申出療養評価会議
患者申出療養から「初の薬事承認・保険適用」技術登場、抗がん剤「適応拡大」にも期待集まる―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、リキッドバイオプシーも検査対象に追加―患者申出療養評価会議
12番目の患者申出療養、「BRAF V600変異陽性の小児神経膠腫」への抗がん剤併用療法を承認―患者申出療養評価会議
11番目の患者申出療養として、難病CIDPへのリツキシマブ追加投与療法を認める―患者申出療養評価会議
患者申出療養で実施される保険外の医療技術、しかるべき時期に安全性・有効性の評価が必要—患者申出療養評価会議
患者申出療養の計画変更を了承、ただし「野放図な期間延長」などは好ましくない―患者申出療養評価会議
10番目の患者申出療養として、小児脳腫瘍へのエヌトレクチニブ投与療法を認める―患者申出療養評価会議
小児がん患者も迅速に「適応外の分子標的薬」にアクセスできる環境を整備―患者申出療養評価会議(2)
乳房外パジェットへのカドサイラ投与、9番目の患者申出療養として導入―患者申出療養評価会議(1)
小児がん患者が「最適な抗がん剤にアクセスしやすい環境」の整備に向け、患者申出療養を拡充―患者申出療養評価会議
遺伝子パネル検査に基づく「適応外抗がん剤」使用、患者申出療養での実施を承認―患者申出療養評価会議
遺伝子パネル検査に基づく抗がん剤の適応外使用想定した事前準備、国がんで進む―患者申出療養評価会議
患者申出療養評価会議からメーカーに「薬剤等供給」協力を要請する仕組み設ける―患者申出療養評価会議
早期乳がんのラジオ波熱焼灼治療を患者申出療養に導入、再発リスク説明等が必要―患者申出療養評価会議
遺伝子パネル検査で「適応外の抗がん剤治療」の可能性ある場合、迅速に治療開始できる準備進める―患者申出療養評価会議
「非代償性肝硬変へのハーボニー投与」、5種類目の患者申出療養に―患者申出療養評価会議
阪大病院での患者申出療養すべてで死亡含む重篤事象が発生、適切な患者選択を―患者申出療養評価会議
有効性・安全性の確立していない患者申出療養、必要最低限の患者に実施を—患者申出療養評価会議
心移植不適応患者への植込み型人工心臓DT療法、2例目の患者申出療養に―患者申出療養評価会議
2018年度改定に向けて、入院患者に対する「医師による診察(処置、判断含む)の頻度」などを調査―中医協総会
患者申出療養、座長が審議の場を判断するが、事例が一定程度集積されるまでは本会議で審議―患者申出療養評価会議
患者申出療養評価会議が初会合、厚労省「まずは既存の先進医療や治験の活用を」
患者申出療養の詳細固まる、原則「臨床研究」として実施し、保険収載を目指す―中医協
患者申出療養の提案受けた臨床研究中核病院、「人道的見地からの治験」の有無をまず確認―中医協総会
大病院受診、紹介状なしの定額負担など16年度から-医療保険部会で改革案まとまる





