14番目の患者申出療養、「EZH2阻害薬の有効性が期待される小児・AYAがん患者」へのタゼメトスタット療法を承認―患者申出療養評価会議
2023.1.23.(月)
14番目の患者申出療養として「EZH2阻害薬の有効性が期待される標準治療がない、または治療抵抗性の小児・AYA悪性固形腫瘍に対するタゼメトスタット療法」を認め、保険診療との併用を可能とする―。—。
1月20日に開催された患者申出療養評価会議で、こういった点が了承されました。

1月20日に開催された「第第37回 患者申出療養評価会議」
抗がん剤「タゼメトスタット」の、小児患者等への適応拡大を目指す
患者申出療養は、傷病と闘う患者の「海外で開発された未承認(保険外)等の医薬品や医療機器を使用してみたい」という希望・申し出を起点に、当該医療技術(未承認の医薬品等)に一定の安全性・有効性があることを評価会議で確認した上で、保険診療との併用を許可する仕組みです(2016年4月スタート)。
これまでに、次の13種類の患者申出療養が認められています(ただし「2」「3」「4」「5」「10」の技術はすでに新規患者の登録を終了)。
(1)腹膜播種・進行性胃がん患者への「パクリタキセル腹腔内投与および静脈内投与ならびにS-1内服併用療法」
(2)心移植不適応な重症心不全患者への「耳介後部コネクターを用いた植込み型補助人工心臓による療法」(関連記事はこちら)
(3)難治性天疱瘡患者への「リツキシマブ静脈内投与療法」(関連記事はこちら)
(4)髄芽腫、原始神経外胚葉性腫瘍または非定型奇形腫様ラブドイド腫瘍患者への「チオテパ静脈内投与、カルボプラチン静脈内投与およびエトポシド静脈内投与ならびに自家末梢血幹細胞移植術の併用療法」(関連記事はこちら)
(5)ジェノタイプ1型C型肝炎ウイルス感染に伴う非代償性肝硬変患者への「レジパスビル・ソホスブビル経口投与療法」(関連記事はこちら)
(6)進行固形がん(線維芽細胞増殖因子受容体に変化を認め、従来治療法が無効、かつインフィグラチニブによる治療を行っているものに限る)患者への「インフィグラチニブ経口投与療法」(関連記事はこちら)
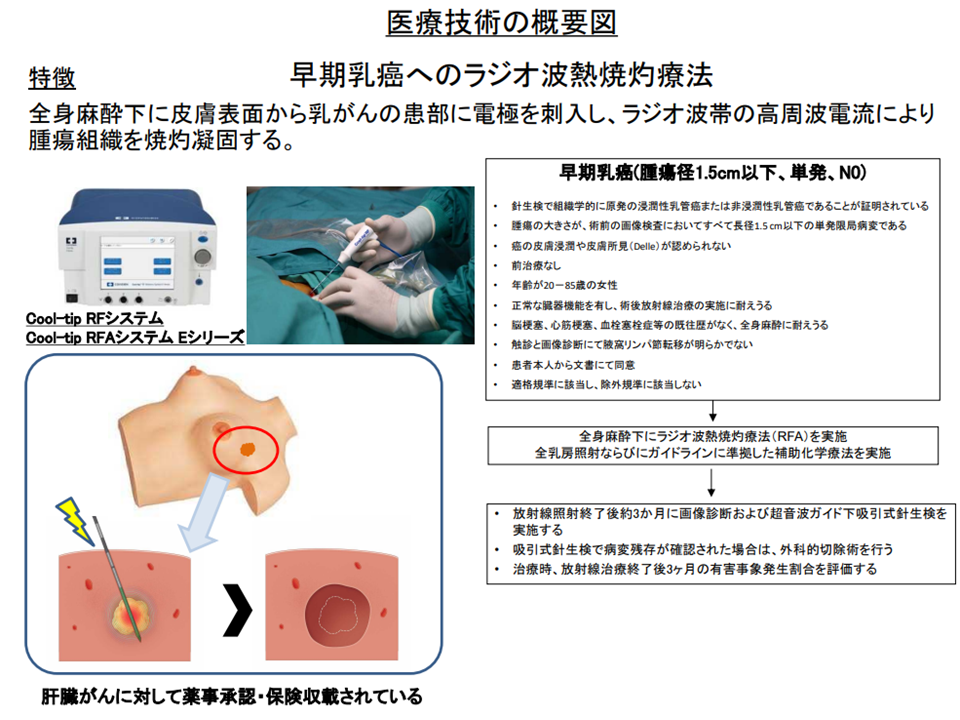
(7)早期乳がん患者への「ラジオ波熱焼灼療法」(関連記事はこちら)
(8)遺伝子パネル検査でactionableな遺伝子異常を有すると判断された固形腫瘍に対する「マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」(関連記事はこちらとこちら)
(9)HER2陽性の手術不能または再発の乳房外パジェット病患者に対する「トラスツズマブ エムタンシン(カドサイラ点滴静注用)静脈内投与療法」(関連記事はこちら)
(10)ROS1融合遺伝子陽性の進行性小児脳腫瘍患者に対する「エヌトレクチニブ(販売名:ロズリートレクカプセル)の経口投与療法」(関連記事はこちら)
(11)免疫グロブリンGサブクラス4自己抗体陽性難治性慢性炎症性脱髄性多発神経炎患者に対する「リツキシマブ追加投与療法」(関連記事はこちら)
(12)BRAFV600変異陽性の進行性神経膠腫を有する小児を対象とした「ダブラフェニブ・トラメチニブ併用療法」(関連記事はこちら)
(13)BRAF V600変異陽性の局所進行・転移性小児固形腫瘍に対する「ダブラフェニブ・トラメチニブの第II相試験」(関連記事はこちら)
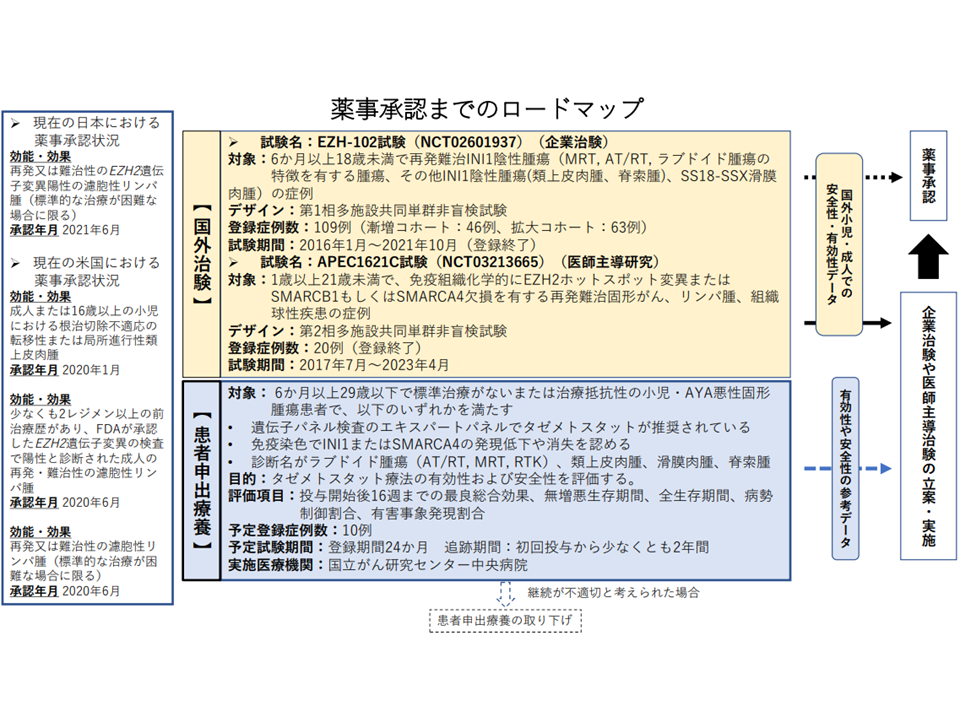
1月20日の会合では、14番目の患者申出療養として「EZH2阻害薬の有効性が期待される標準治療がない、または治療抵抗性の小児・AYA悪性固形腫瘍に対するタゼメトスタット療法」が認められました。
一部遺伝子に異常のある場合、EZH2というタンパク質が過剰発現し、がんになりやすいことが分かっています。
この点、EZH2を阻害する薬剤「タゼメトスタット臭化水素酸塩製剤」(販売名:タズベリク錠200mg)が開発され、2021年8月に保険適用されていますが、適応症が「濾胞性リンパ腫」に限られ、また「小児への有効性」は確認されていません。
今般、EZH2阻害薬の有効性が期待される小児固形がん患者(2歳)サイドから、「『タゼメトスタット臭化水素酸塩製剤』(販売名:タズベリク錠200mg)を用いた治療を、患者申出療養として実施したい」との要望があり、国立がん研究センター中央病院が次のような実施計画書を提出しました。患者申出療養を選択した(治験などのを選択できなかった・しなかった)背景には▼治験・先進治療に対する薬剤提供については「数量や提供期間により提供可否の判断に時間がかかる」場合がある▼拡大治験の対象となる主たる治験の実施中(登録終了)または実施後の状況でない▼医師主導治験や先進医療の実施に必要となる研究費を現時点で獲得できていない—ことなどがあります。
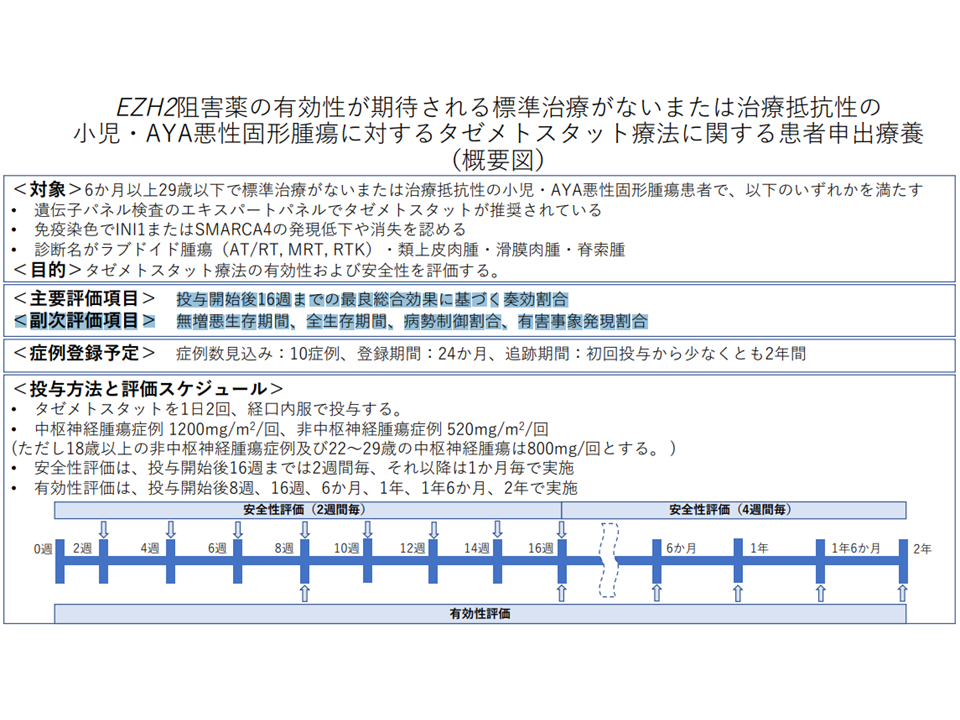
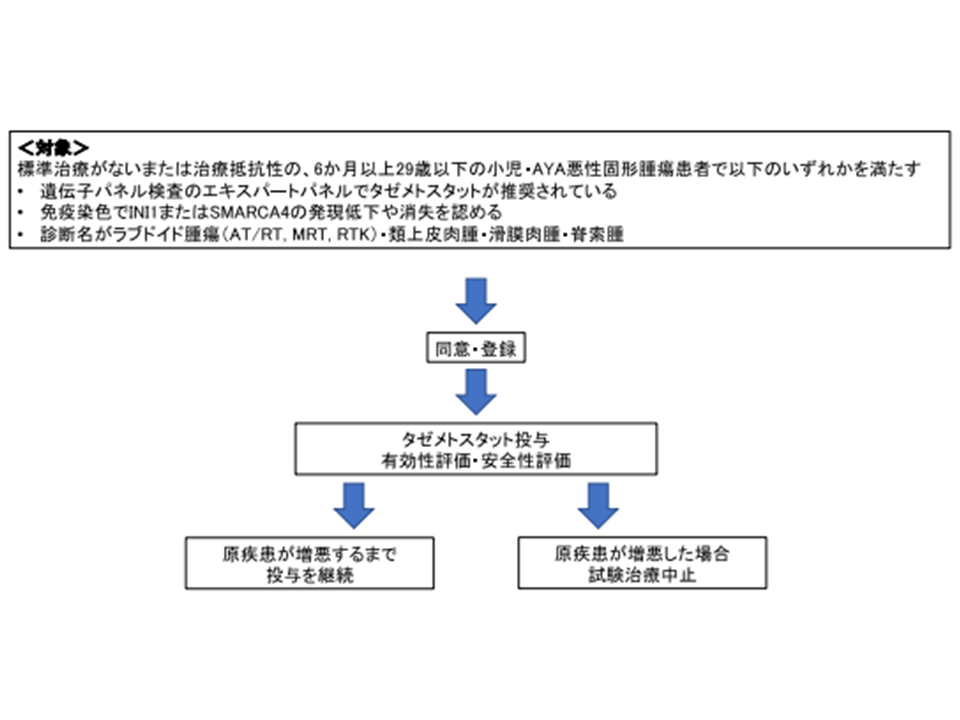
▽対象患者:次のいずれをも満たす患者
▼年齢が6か月以上29歳以下(小児患者が成長し、AYA世代(一般的に15-39歳)に到達することも踏まえた年齢設定となっている)
▼「標準治療がない」または「治療抵抗性」である小児・AYA悪性固形腫瘍患者
▼次のいずれかに該当する
・遺伝子パネル検査のエキスパートパネル(専門家会議)で「タゼメトスタット」が推奨されている
・免疫染色で「INI1」または「SMARCA4」の発現低下や消失を認める
・診断名が「ラブドイド腫瘍(AT/RT、MRT、RTK)」「類上皮肉腫」「滑膜肉腫」「脊索腫」のいずれかである
▽目的:タゼメトスタット療法の有効性および安全性を評価する
▽評価項目:主要項目は「投与開始後16週までの最良総合効果に基づく奏効割合」、副次項目は「無増悪生存期間」「全生存期間」「病勢制御割合」「有害事象発現割合」
▽症例数見込み:10症例
▽予定期間:登録期間24か月
▽追跡期間:初回投与から少なくとも2年間
14番目の患者申出療養である「EZH2阻害薬の有効性が期待される標準治療がない、または治療抵抗性の小児・AYA悪性固形腫瘍に対するタゼメトスタット療法」の概要(1)(患者申出療養評価会議1 230120)
14番目の患者申出療養である「EZH2阻害薬の有効性が期待される標準治療がない、または治療抵抗性の小児・AYA悪性固形腫瘍に対するタゼメトスタット療法」の概要(2)(患者申出療養評価会議2 230120)
14番目の患者申出療養である「EZH2阻害薬の有効性が期待される標準治療がない、または治療抵抗性の小児・AYA悪性固形腫瘍に対するタゼメトスタット療法」の概要(3)(患者申出療養評価会議3 230120)
小児に対する薬剤の適応拡大も見据えた実施計画書となっており、本技術の内容に異論は出ておらず、「適」と判断されました。1か月程度で告示改正が行われ、保険診療と保険外診療との併用が可能となります。
ただし、構成員からは▼患者が同意可能な年齢に到達した場合には、改めての同意取得を得るようにすべき(井上悠輔構成員:東京大学医学研究所公共政策研究分野准教授)▼有効性が確認できない・安全性に問題がある場合などに「計画全体を中止する」ルール・基準を設けるべき(新谷歩構成員:大阪公立大学大学院医学研究科医療統計学教授)▼患者が過度の期待を持たないように「有効性等の推定」に関する説明内容などは詳しくすべき(山口俊晴構成員:がん研究会有明病院名誉院長)—などの注文がついています。
これら患者申出療養の結果が「抗がん剤の小児適応など、適応拡大(対象患者の拡大)につながっていく」ことに期待が集まります。もっとも、患者申出療養は、「患者数が限られている」など、有効性・安全性に関するエビデンスにはダイレクトに結びつかないケースも少なくなく、過度な期待を寄せてはいけないことにも留意が必要です。
また、(7)の「早期乳がん患者へのラジオ波熱焼灼療法」について、有害事象などが生じていないことから継続が認められています(半年ごとに状況をチェックし、継続の可否を患者申出療養評価会議で決定する)。
早期乳がんへのラジオ波熱焼灼療法の概要(患者申出療養評価会議5 230120)
2022年1年間、特定機能病院への患者申出療養の相談等は8件
また1月20日の患者申出療養評価会議には、これまでに患者から特定機能病院等になされた全ての「相談」の状況が厚生労働省から報告されました。
2016年4月から昨年(2022年)12月末までに166件(昨年(2022年)の1年間で8件)の「患者からの相談等」があり、うち13件(同1件)で「患者申出療養」が実施されています。相談窓口は多くの都道府県で設置されていますが、青森県・群馬県・沖縄県には未設置であり、傷病と闘う患者に対する相談窓口設置が急がれます(厚労省サイトはこちら(相談窓口リスト))。
患者申出療養としての実施が行われなかった153(同7件)の状況を見ると、▼拡大治験(日本版コンパッショネートユース)等の治験、先進医療等、他の臨床試験へ参加:24件(同ゼロ件)▼既承認の患者申出療養に参加:5件(同ゼロ件)▼相談継続中:3件(同ゼロ件)▼制度一般に関する照会など、具体的な技術に関する相談ではなかったもの:55件(同5件)▼一度相談があったが、その後、現在までに相談がないもの:31件(同2件)▼医療機関等で「患者申出療養として実施困難」と判断したもの:35件(同5件)―となっています。
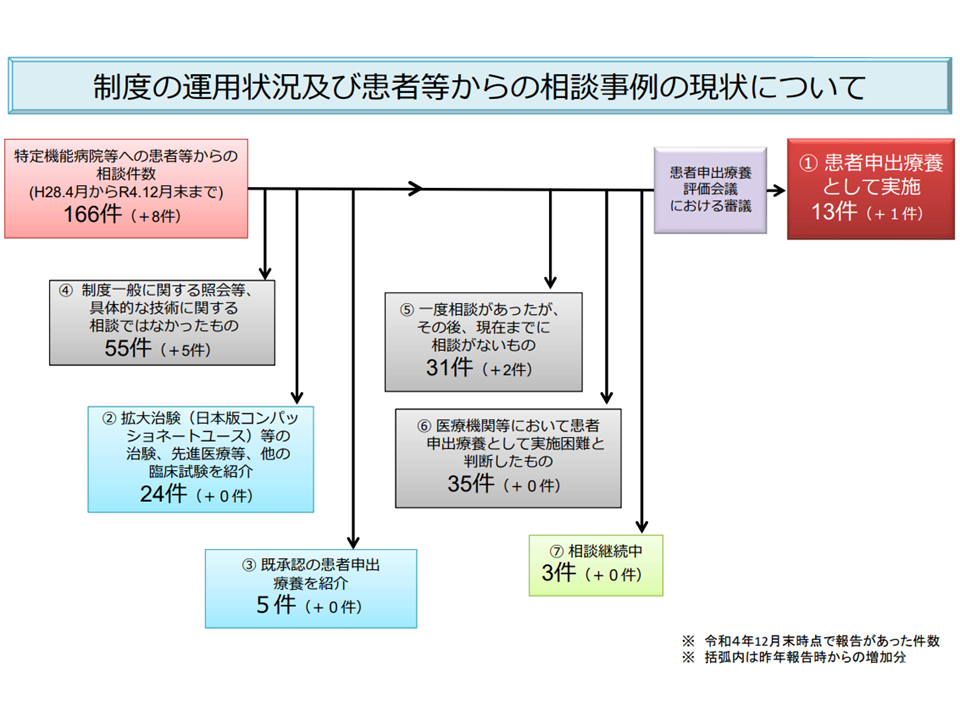
2016年4月の患者申出療養創設から、昨年(2022年)末までの患者申出療養に関する相談状況(患者申出療養評価会議4 230120)
現下の「新型コロナウイルス感染症の流行」などにより患者申出療養の相談件数などが伸び悩んでいると見ることができますが、「薬事承認・保険適用というゴールにたどり着く技術」が現れてきており(関連記事はこちら(リツキシマブについて「難治性天疱瘡」への効能・効果追加))、今後の「相談件数増」などにつながっていくと期待されます(ただし上述のように過度な期待には留意)。
なお、山口構成員は「『医療機関等で【患者申出療養として実施困難】と判断した』ケースについて、相談から断念までの時間なども分析するべきである。長い時間がかかってから『無理である』と伝えられるのでは、患者の落胆は非常に大きい」と指摘しています。調査分析が可能かも含めて、厚労省で検討されます。
【関連記事】
13番目の患者申出療養、「BRAF V600変異陽性の小児固形がん」への抗がん剤併用療法を条件付きで承認―患者申出療養評価会議
進行性胃がんへのパクリタキセル・S-1併用療法、乳房外パジェットへのカドサイラ投与など実施計画見直し―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、ニラパリブを対象薬剤に追加―患者申出療養評価会議
耳介後部コネクター用いるDT療法の有効性に期待、遺伝子パネル検査による抗がん剤治療で対象薬剤追加―患者申出療養評価会議
患者申出療養から「初の薬事承認・保険適用」技術登場、抗がん剤「適応拡大」にも期待集まる―患者申出療養評価会議
8番目の患者申出療養「遺伝子変異に対応した分子標的薬治療」、リキッドバイオプシーも検査対象に追加―患者申出療養評価会議
12番目の患者申出療養、「BRAF V600変異陽性の小児神経膠腫」への抗がん剤併用療法を承認―患者申出療養評価会議
11番目の患者申出療養として、難病CIDPへのリツキシマブ追加投与療法を認める―患者申出療養評価会議
患者申出療養で実施される保険外の医療技術、しかるべき時期に安全性・有効性の評価が必要—患者申出療養評価会議
患者申出療養の計画変更を了承、ただし「野放図な期間延長」などは好ましくない―患者申出療養評価会議
10番目の患者申出療養として、小児脳腫瘍へのエヌトレクチニブ投与療法を認める―患者申出療養評価会議
小児がん患者も迅速に「適応外の分子標的薬」にアクセスできる環境を整備―患者申出療養評価会議(2)
乳房外パジェットへのカドサイラ投与、9番目の患者申出療養として導入―患者申出療養評価会議(1)
小児がん患者が「最適な抗がん剤にアクセスしやすい環境」の整備に向け、患者申出療養を拡充―患者申出療養評価会議
遺伝子パネル検査に基づく「適応外抗がん剤」使用、患者申出療養での実施を承認―患者申出療養評価会議
遺伝子パネル検査に基づく抗がん剤の適応外使用想定した事前準備、国がんで進む―患者申出療養評価会議
患者申出療養評価会議からメーカーに「薬剤等供給」協力を要請する仕組み設ける―患者申出療養評価会議
早期乳がんのラジオ波熱焼灼治療を患者申出療養に導入、再発リスク説明等が必要―患者申出療養評価会議
遺伝子パネル検査で「適応外の抗がん剤治療」の可能性ある場合、迅速に治療開始できる準備進める―患者申出療養評価会議
「非代償性肝硬変へのハーボニー投与」、5種類目の患者申出療養に―患者申出療養評価会議
阪大病院での患者申出療養すべてで死亡含む重篤事象が発生、適切な患者選択を―患者申出療養評価会議
有効性・安全性の確立していない患者申出療養、必要最低限の患者に実施を—患者申出療養評価会議
心移植不適応患者への植込み型人工心臓DT療法、2例目の患者申出療養に―患者申出療養評価会議
2018年度改定に向けて、入院患者に対する「医師による診察(処置、判断含む)の頻度」などを調査―中医協総会
患者申出療養、座長が審議の場を判断するが、事例が一定程度集積されるまでは本会議で審議―患者申出療養評価会議
患者申出療養評価会議が初会合、厚労省「まずは既存の先進医療や治験の活用を」
患者申出療養の詳細固まる、原則「臨床研究」として実施し、保険収載を目指す―中医協
患者申出療養の提案受けた臨床研究中核病院、「人道的見地からの治験」の有無をまず確認―中医協総会
大病院受診、紹介状なしの定額負担など16年度から-医療保険部会で改革案まとまる





