画期的な白血病治療薬「キムリア」を保険収載、薬価は3349万円―中医協総会(1)
2019.5.15.(水)
中央社会保険医療協議会・総会が5月15に開かれ、画期的な白血病等治療薬「キムリア点滴静注」(成分名:チサゲンレクルユーセル)の保険収載を承認しました。
薬価は1患者当たり3349万3407円に設定されました。5月22日に薬価収載される予定です。

5月15日に開催された、「第414回 中央社会保険医療協議会 総会」
目次
費用対効果評価の対象薬剤(きわめて高額)に選定
キムリア点滴静注は、我が国初のCAR-T細胞治療に用いる再生医療等製品です。白血病等患者自身のT細胞(リンパ球の一種)を採取し、遺伝子組み換え(キメラ抗原受容体、chimeric antigen receptor:CARを発現させる)を行った上で増殖し、患者の体内に戻すというものです。米国での臨床試験では「奏効率8割」という驚異的な成績をおさめており、白血病等患者に大きな福音になると期待されます。
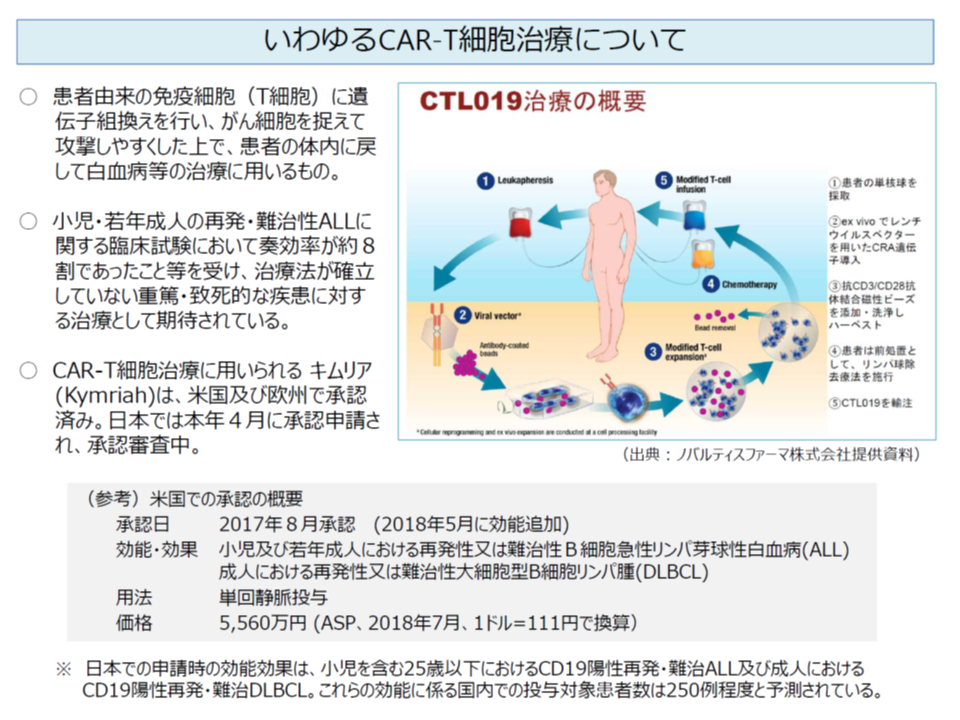
もっとも、個々の患者の細胞をもとに製造するため、極めて大きなコストがかかる(メーカーが提示した総原価は2363万2062円)ことから、原価計算方式で3349万3407円という極めて高額な薬価が設定されました(画期的な製品であり有用性加算I:35%等が上乗せされている)。米国では日本円に換算して6270万円、ドイツでは同じく4128万円の償還価格が設定されており、諸外国に比べれば低廉な薬価に抑えられたように見えます(ただし後述するように原価内訳の開示度合いが高ければドイツより高額な薬価となった可能性がある)。
なお、本製品は著しく薬価が高いと中医協で判断され(過去最高の薬価設定)、費用対効果評価の対象に選定されました(H3対象)。今後、「費用」「効果」等に関するデータをメーカーが準備し、「価格の妥当性」を検証していくことになります。評価の結果、「効果に比べて費用が高すぎる」と判断されれば価格が引き下げられる、逆に「価格以上に優れた効果がある」と判断されれば価格が引き上げられる可能性もあります(関連記事はこちら)。
最適使用推進ガイドラインを設定、CRSなどの有害事象に対応できる体制等が必要
超高額医薬品等については、保険財政に与える影響も大きなことから、医療現場で適正に使用される必要があります。このため厚生労働省医薬・生活衛生局医療機器審査管理課の中井清人課長は、▼どういった施設(医療機関)で本製品を使用できるか▼投与対象となる患者をどう考えるか▼使用に当たって留意すべき事項はないか―などを規定した「最適使用推進ガイドライン」を作成し、医療現場での遵守を求めています(厚労省のサイトはこちら(中医協資料)。
まず本製品を使用する施設には、次のような要件を「すべて」満たすことが求められます。製造(採取、遺伝子組み換え、増殖)には白血球のアフェレーシス(分離)が必要となり、また、投与に伴って起こりうる有害事象(サイトカイン放出症候群、CRS:Cytokine release syndrome)への対応体制が整っている必要があるためです。厚労省では、我が国で「170施設」程度が対象になると見込んでいます
▽「日本造血細胞移植学会が定める移植施設認定基準」の全項目を満たす診療科を有し、有害事象に対する全身管理が可能な ICU等を有し(A301【特定集中治療室管理料1】またはA301-4【小児特定集中治療室管理料】の取得)、通算2年以上かつ10件以上の細胞調製実績を有する医療スタッフ(医師、臨床検査技師、衛生検査技師、臨床工学技士、薬剤師または看護師)を配置していることなど
▽(1)6年以上の臨床経験を有し、うち3年以上血液悪性腫瘍の研修を行っている、または7年以上の臨床経験を有し、うち5年以上の小児血液悪性腫瘍の研修を行っている(2)通算1年以上の「造血細胞移植に関する内科または小児科研修による診療実績」を持ち、必要な経験と学識技術を習得している(3)同種造血細胞移植の診療実績5例以上ある―をすべて満たす医師を治療責任者として1名以上配置し、併せて(1)に該当する医師を1名以上配置していること
▽「再生医療等製品に関する情報管理」に従事する担当者を配置し、▼メーカーからの情報窓口▼有効性・安全性等の情報管理▼医師等への情報提供▼不具合・副作用が発生した場合の報告業務―などが速やかに行われる体制を整えていること
▽重篤な不具合・副作用が発生した際に、24時間診療体制の下、当該施設・連携施設で「副作用に応じて入院管理」「検査結果を当日中に取得し、直ちに対応する体制」を整えていることなど。特にCRSの緊急時に備えて「トシリズマブ(遺伝子組換え)」(販売名:アクテムラ)の在庫を本品投与前に確保していること
また投与対象患者は、次のように限定されています。メーカーは2026年度(ピーク時)の患者数を216人と予想しています。
▽CD19陽性の再発または難治性のB細胞性急性リンパ芽球性白血病(B-ALL)のうち、次のいずれかの条件を満たす患者
・2回以上の骨髄再発が認められた
・同種造血幹細胞移植後に骨髄再発し、本品投与時点で同種造血幹細胞移植から6か月以上経過している
・同種造血幹細胞移植の適応とならない(併存疾患ありなど)
・標準の化学療法レジメンを2サイクル受けた後でも完全寛解を達成しないと定義される初発難治性、または再発した白血病に対し標準の化学療法を1サイクル受けた後でも完全寛解を達成しないと定義される化学療法難治性
・フィラデルフィア染色体陽性の患者ではTKI(チロシンキナーゼ阻害薬)不耐もしくは禁忌、または2種類以上のTKIを受けても奏効が得られない
▽再発または難治性のCD19陽性のびまん性大細胞型B細胞リンパ腫(DLBCL)で、自家造血幹細胞移植の適応とならない(併存疾患ありなど)、または自家造血幹細胞移植後に再発した患者のうち、以下のいずれかの条件を満たす患者
・初発患者では化学療法を2ライン以上、再発患者では再発後に化学療法を1ライン以上施行し、化学療法により完全奏効が得られなかった(または完全奏効が得られたが再発した)
・濾胞性リンパ腫が形質転換した患者では通算2ライン以上の化学療法を施行し、形質転換後には化学療法を少なくとも1ライン施行し、化学療法により完全奏効が得られなかった(または完全奏効が得られたが再発した)
一方、▼CD19抗原陽性と確認されない患者▼26歳以上の白血病患者▼ツキシマブ(遺伝子組換え)」(販売名:リツキサン)および「アントラサイクリン系抗悪性腫瘍剤」(販売名:ドキシルなど)を含む化学療法歴のないDLBCL患者▼他の悪性腫瘍を合併している患者▼本品の投与歴のある患者―などは投与対象になりません。
投与に際しては、上述したCRSなどの有害事象への対応が非常に重要となります。中井医療機器審査管理課長は、特にCRSマネジメントの重要性を強調し、投与中・投与後に▼高熱▼悪寒▼筋肉痛▼関節痛▼悪心▼嘔吐▼下痢▼発汗▼発疹▼食欲不振▼疲労▼頭痛▼低血圧▼脳症▼呼吸困難▼頻呼吸▼低酸素症―などの「臨床症状」や、「一過性の心不全・不整脈」「腎不全」「AST増加」「ALT増加」「ビリルビン増加」などの確認・観察を十分に行うこと、CRSの徴候が認められた場合には、メーカーの提供する最新の「CRS管理アルゴリズム」などの情報に沿って適切な処置を行うよう求めています。
 190515の図表.png)
このほか有害事象としては、▼infusion reaction(発熱、悪寒、悪心等)▼神経障害▼骨髄抑制(白血球減少や好中球減少など)▼感染症▼B型・C型肝炎ウイルスキャリアにおける肝炎ウイルスの再活性化▼腫瘍崩壊症候群▼意識変容・意識低下・協調運動障害―などが知られています。
細胞採取や投与などの医療技術については、既存の診療報酬を準用して評価
前述のように、本製品を用いたCAR-T治療は、▼患者自身からの細胞の採取(医療機関で実施)→ ▼遺伝子組み換え・増殖(メーカーで実施) → ▼リンパ球除去化学療法(医療機関で実施) → ▼投与(医療機関で実施)―という流れで実施されます。
このうち医療機関で実施する行為については、当面、次のように既存の診療報酬を準用して算定することも認められています。
▼患者自身からの細胞の採取:K921【造血幹細胞採取(一連につき)】の2「末梢血幹細胞採取」のロ「自家移植の場合」(1万7440点)
▼リンパ球除去化学療法:G004【点滴注射(1日につき)】(6歳未満の乳幼児で、1日分の注射量が100mL以上であれば98点、それ以外の患者で1日分の注射量が500mL以上であれば97点)など
▼投与:K922【造血幹細胞移植】の2「末梢血幹細胞移植」のロ「自家移植の場合」(3万850点)
DPCの場合、通常であれば薬剤費やG004【点滴注射】などの費用は包括されますが、本製品は極めて高額ゆえ、既存のDPC点数では評価されていません。このため当面(まずは2020年度の次期診療報酬改定まで)、「130010急性白血病」および「130030非ホジキンリンパ腫」で本製品を使用する場合、全診療行為が出来高請求となります(本製品以外の治療行為も含めて、すべてが出来高請求となる)。
なお、保険診療においてキムリアを用いる場合には、最適使用推進ガイドラインを遵守するとともに、施設要件のうち「日本造血細胞移植学会が定める移植施設認定基準の全項目を満たす診療科を有している」ことをレセプトの摘要欄に記載することが求められます。適正使用がなされていることを審査面で担保するためです。
支払側委員、価格設定の透明性・再生医療等製品の特性踏まえた価格設定ルールなど要望
こうした超高額な薬価について、中医協では支払側委員から「価格設定は妥当なのか」という指摘が出ています。幸野庄司委員(健康保険組合連合会理事)は、「メーカーからは製造原価内訳の2割程度しか示されていないという。つまり残り8割はブラックボックスである。内訳を5割以上開示すれば、理論上4400万円と、現在より1000万円程度高い薬価が設定されるにも関わらず、あえて開示しない戦略を選択したとうがった見方をしてしまう」と指摘。
さらに幸野委員は、今後も高額な再生医療等製品が開発・保険収載される中で、「個別患者に対応する再生医療等製品は、現在の原価計算方式に則れば、必然的に高額になる。再生医療等製品の特性を踏まえた価格算定ルールを検討する時期に来ている」と強く要望しています。
なお、幸野委員をはじめとする支払側委員は、「価格算定の透明化」「妥当なルールの設定」を求めているのであって、決して「高額な薬価等が好ましくない」と指摘しているわけではない点には留意が必要です。優れた医学・医療の成果に、必要に応じて患者・国民がアクセスできている点は、診療側委員と同じく、支払側委員も高く評価しています。
【関連記事】
高齢者へのフレイル・認知症・ポリファーマシ―対策、診療報酬でどうサポートすべきか―中医協総会(3)
診療報酬で生活習慣病の重症化予防、治療と仕事の両立をどう進めていくか―中医協総会(2)
遺伝子パネル検査の保険収載に向けた検討進む、C-CATへのデータ提出等を検査料の算定要件に―中医協総会(1)
「院内助産」「外来での妊産婦対応」を診療報酬でどう支援していくべきか―中医協総会(2)
2020年度改定論議スタート、小児疾患の特性踏まえた診療報酬体系になっているか―中医協総会(1)
2020年度診療報酬改定に向け、「医師働き方改革」等のテーマ別や患者の年代別に課題を議論―中医協総会
東日本大震災を受けた診療報酬の被災地特例、福島では継続するが、宮城・岩手は最長2021年3月で終了―中医協総会(2)
要介護高齢者への維持期「疾患別リハ料」は2019年3月末で終了、介護保険への移行完了―中医協総会(1)





