先行バイオ医薬品と同一のバイオAG、苦渋の選択として「先行バイオ品の70%」とするしかない―中医協・薬価専門部会
2019.10.29.(火)
先行バイオ医薬品と有効成分、原薬、添加物、製法等が同一の「バイオ医薬品」(バイオAG)について、バイオ後続品(バイオシミラー)よりも低価格を設定した場合、バイオシミラーが選択されず(売れず)、バイオシミラーの研究・開発が阻害されてしまう。苦渋の選択として、バイオAGの価格は、バイオシミラーと同じく「先行バイオ医薬品の70%」とすべきではないか―。
10月23日に開催された中央社会保険医療協議会・薬価専門部会で、こういった議論が行われました。

10月23日に開催された、「第158回 中央社会保険医療協議会 薬価専門部会」
バイオAG、バイオシミラーと同じく「先行バイオ医薬品価格の70%」に
薬価専門部会では2020年度の薬価制度改革に向けた第2ラウンド議論が本格化しており、10月23日の会合では、(1)薬価算定方式の妥当性・正確性の向上(2)イノベーションの評価(3)後発バイオ医薬品の取扱い―の3点を議題としました。
まず(3)の後発バイオ医薬品(先行バイオ医薬品と有効成分、原薬、添加物、製法等が同一のバイオ医薬品、バイオAG(バイオ オーソライズド ジェネリック))について、薬価をどう設定するかという論点です。

バイオAGとバイオシミラー(薬価専門部会3 191023)
今春の中医協(薬価専門部会、総会)では、バイオAGについて▼別企業によるバイオ後続品(バイオシミラー)の研究・開発等を阻害するおそれがあり、暫定的にバイオAGもバイオシミラーと同じく「先行品の70%」に薬価を設定する▼2020年度の薬価制度改革に向けて「適正な競争環境の確保」のための仕組みなどを検討していく―こととされていました。
バイオシミラー(バイオ後続品)は、後続品ゆえに研究開発等のコストが小さいことから、原則として「先行バイオ医薬品の70%」に薬価が抑えらます。バイオAGについては、先行バイオ医薬品と同じラインで製造等されるため、バイオシミラーよりもコストを小さく抑えられることから、「より低い薬価を設定すべきではないか」とも考えられます。
しかし、バイオAGの価格をバイオシミラーよりも低価格とすれば、患者は「より低価格なバイオAGを選択する」ことになるでしょう。この場合、バイオシミラーがまったく売れず、研究・開発がストップしてしまうと危惧されます。バイオAGは、先行バイオ医薬品と実質的に同一の製薬メーカーが販売することもあり、「バイオシミラーのみが市場で負けてしまう」結果となりえるのです。
診療側の松本吉郎委員(日本医師会常任理事)は、「バイオAG価格をバイオシミラーより高くしても、低くしても問題が生じる。苦渋の選択として『バイオシミラーと同一にする』し、事例を踏まえて適宜薬価算定ルールを見直していくしかない」と述べ、暫定ルールである「バイオAGについても先行バイオ医薬品価格の70%とする」取り扱いを2020年度以降も継続すべきとの考えを述べています。
あわせてバイオAGが登場した先行バイオ医薬品については、後発品への置き換えを促す「G1・G2ルール」(先発品価格を段階的に後発品価格に揃えるよう引き下げていく仕組み)の対象とするべきとも提案。これに支払側の幸野庄司委員(健康保険組合連合会理事)も賛同しています。
「臨床的位置づけ」も加味して最類似薬を選定し、類似薬効比較方式を拡大しては
また(1)の薬価算定方式の妥当性・正確性については、次のような論点が厚生労働省保険局医療課の田宮憲一薬剤管理官から提示されました。
【原価計算方式】
▽原価開示度の低い品目については、すでに現行ルールにおいて補正加算や費用対効果評価での対応を行っているが、補正加算額の実績、製品原価の開示ができない理由などを踏まえた上で、その取扱いをどう考えるか
▽原価が安く、研究開発費が高額な品目への対応として、希少疾病用医薬品のほか化学合成品で開示度が高い場合等は一般管理販売比率の上限を超えることを認めているが、バイオ医薬品で研究開発費の割合が高いケースをどう考えるか
【類似薬効比較方式】
▽同様の効能効果等の類似薬がある場合に、当該類似薬との市場での公正な競争を確保するという類似薬効比較方式の考え方を踏まえた場合、現在の比較薬の判断基準を拡大することについてどう考えるか
新薬の薬価は、まず「類似薬がある場合には、その医薬品と同じ価格とする(1日薬価を同じくする)」という類似薬効比較方式を探り、類似薬がない場合に原価を積み上げて薬価を考える「原価計算方式」が採用されます。
後者の原価計算方式については、「原価の設定そのものが不透明なのではないか」との問題意識が従前よりあり、2018年度の薬価制度抜本改革において「原価の開示度に応じて加算率等に差を設ける(開示度が低ければ加算が小さくなる)」仕組みが導入されました。
しかし、2018年度以降に原価計算方式が適用された新薬の「原価開示度」を見ると、16成分中10成分が「開示度50%未満」にとどまり、「原価開示は十分に進んでいない」状況です。この背景には、やはり2018年度改革で「加算のベースが、従前の営業利益率から、薬価全体に拡大された」ためと幸野委員は指摘。低い加算率であっても、ベースが薬価全体に広がったため、加算額そのものはそれほど小さくならないのです。厚労省の試算では、開示度50%未満の成分でも、従前の加算額と比べて全体でプラス0.4%の加算額を取得できています。
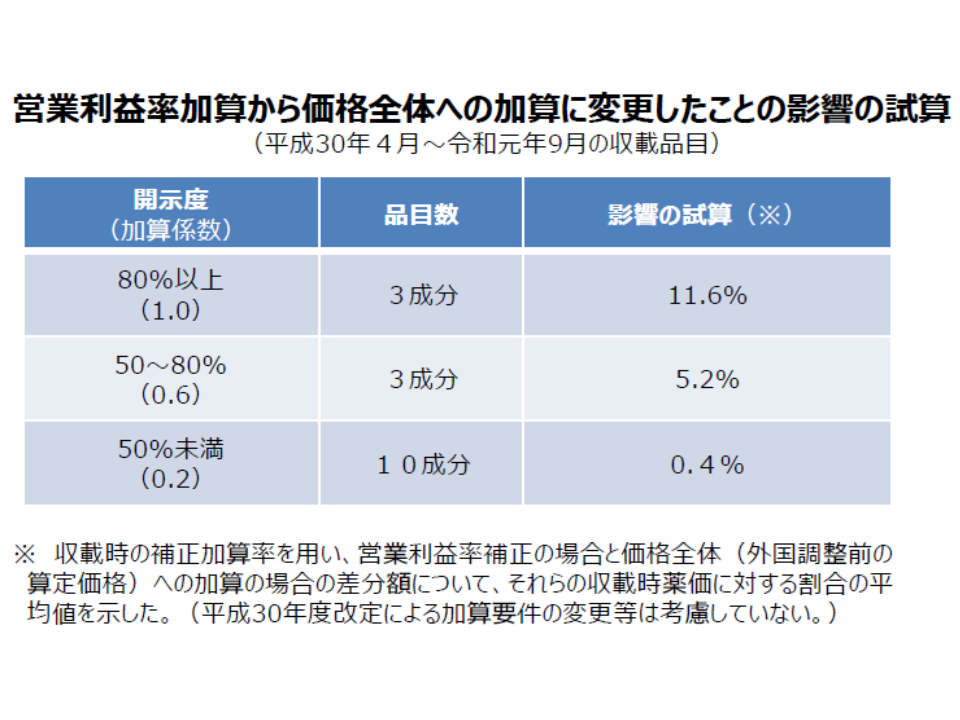
原価計算方式において、開示度50%未満の成分でも、従前と同じだけの加算額(プラス0.4%)を取得している(薬価専門部会1 191023)
ただし、医薬品のサプライチェーンを考慮すれば「原価の厳格な開示は難しい」(海外から輸入する場合などには、原価調査には限界がある)ことも分かります。
この点、「原価計算方式の適用をさらに限定し、類似薬効比較方式の適用範囲を拡大する」ことで、こうした問題を一定程度解消できるのではないか(類似薬効比較方式で薬価を算定すれば、原価開示という問題はそもそも生じない)、との考えに基づき、田宮薬剤管理官は上記の論点を提示したものです。現在、▼効能効果▼薬理作用▼組成および化学構造式▼投与形態、剤形区分、剤形および用法―から最類似薬を選定していますが、製薬メーカーサイドは「臨床的位置づけ等の医療実態」を補完的な要素として組み込んではどうかとの考えを示しています。

製薬メーカーサイドによる類似薬効比較方式の拡大提案(薬価専門部会2 191023)
こうした論点に、診療側・支払側委員ともに一定の理解を示したものの、「臨床的位置づけ等の医療実態を勘案した場合に、「どういった品目が原価計算方式から類似薬効比較方式に移るのか、事例を積み重ねていかなければ判断が難しい」(松本委員)、「個別品目の価格設定がどう変わるのかを見ていく必要がある」(支払側の吉森俊和委員:全国健康保険協会理事)など慎重意見が相次ぎました。
高齢者を対象にした治験、有用性加算等で評価すべきか
一方、(2)のイノベーションの評価に関しては、製薬メーカーサイドの提案も踏まえ、田宮薬剤管理官から次の論点が示されています。
▽現行の有用性加算(製剤工夫による高い医療上の有用性)およびキット加算において、患者・医療従事者における治療上の負担軽減等について評価していることを踏まえ、これらを統合すること、製剤工夫の有無にかかわらず治療上の負担軽減等について評価することをどう考えるか
▽高齢者を対象とした治験を行い、臨床上高い有用性を示した医薬品について、有用性加算の加算率を検討する上での要件の一つとなることを明確化することをどう考えるか
前者の論点について、製薬メーカーの立場で参画する上出厚志専門委員(アステラス製薬株式会社上席執行役員渉外部長)は、「例えば従前、血小板減少の患者に対し輸血治療を行ってきたところ、経口での医薬品投与による治療法が開発されている。これにより輸血に伴う医療従事者・患者の感染リスクが飛躍的に軽減されるなどの効果がある。こうした点を加算で評価すべきではないか」と説明。対して松本委員は、「医療従事者の負担軽減・安全確保は重要であるが、加算を設けずともに、市場で評価される(シェアが拡大し、メーカーの売り上げは伸びる)のではないか」と指摘しています。
また後者の「高齢者を対象にした治験」については、生理機能が変化し、言わば「薬剤が効き過ぎる」高齢者に対し、適切な用法・用量を見出すことができ、ポリファーマシー対策にもなる、などの点で非常に重要です。この点、松本委員は「高齢者を対象にする治験には大きな意義がある」としたものの、「小児のデータも重要であり、高齢者の治験だけを評価することには違和感を覚える」とコメントしています。
今後も、さらに議論を深めていくことになるでしょう。
【関連記事】
再製造の単回使用医療機器(RSUD)、オリジナル品と別の機能区分とし、低い償還価格を―中医協、材料専門部会・薬価専門部会
長期収載品の段階的価格引き下げルール、2020年度改定で厳格化すべきか―中医協・薬価専門部会
再生医療等製品、独自の薬価算定ルールを設けるべきか―中医協・薬価専門部会
新薬の価値そのものに着目した評価を求めるメーカーに対し、中医協委員は「新薬開発の競争促進」も重要と指摘―中医協・薬価専門部会
2020年度の薬価・材料価格制度改革に向けて、中医協で本格議論スタート―中医協、薬価・材料専門部会
2020年度薬価制度改革、新薬創出等加算や後発品使用促進策などが重要テーマ―中医協・薬価専門部会
先行バイオ医薬品とまったく同一の「バイオセイム」登場、薬価の在り方など検討―中医協総会(2)
薬価制度抜本改革案を修正、新薬創出等加算の厳格化を一部緩和―中医協薬価専門部会
新薬創出等加算の見直し、「容認できない」と製薬メーカー猛反発—中医協薬価専門部会
薬価制度抜本改革の具体案、費用対効果評価による価格引き上げも—中医協薬価専門部会
医療現場に必要不可欠な医薬品の価格下支え、対象拡大の方向―中医協・薬価専門部会
新薬の原価計算方式、診療・支払双方が改めて問題点指摘—中医協・薬価専門部会
医薬品の画期性・革新性、薬価にどう公平に反映させていくべきか—中医協・薬価専門部会
新薬創出等加算、「産業構造の転換」促すため対象企業要件を厳格化してはどうか—中医協・薬価専門部会
長期収載品から後発品への置き換え促進、新薬創出等加算などとセットで議論すべき—中医協・薬価専門部会
製薬メーカーが新薬創出等加算の継続を強く要望―中医協・薬価専門部会
後発品の薬価、現在3区分の価格帯をさらに集約していくべきか-中医協・薬価専門部会
原価計算方式における薬価算定、製薬メーカーの営業利益率などどう考えるか-中医協・薬価専門部会
薬価調査において、医療機関に対する価格調査は継続すべきか-中医協・薬価専門部会
中間年の薬価見直し、対象品目の基準(乖離率など)を事前に示しておくべきか―中医協・薬価専門部会
新薬の薬価設定で、比較対象薬(類似薬)に付加された補正加算をどう考えるべきか―中医協・薬価専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の外国平均価格調整、診療・支払両側から「米国価格は参照対象から除外すべき」との指摘―中医協・薬価専門部会
効能追加などで市場拡大した医薬品の薬価再算定、対象や引き下げ方法の議論開始―中医協薬価専門部会
薬価の毎年改定方針を決定、DPC点数表も毎年改定へ―厚労省





