2020年度薬価制度改革、新薬創出等加算や後発品使用促進策などが重要テーマ―中医協・薬価専門部会
2019.5.31.(金)
2020年度の次期薬価制度改革に向けて、新薬創出・適応外薬解消等促進加算のさらなる見直しや、長期収載品から後発医薬品への置き換え促進方策などを検討していく―。
5月29日に開催された中央社会保険医療協議会の「薬価専門部会」で、こういった点が確認されました。

5月29日に開催された、「第152回 中央社会保険医療協議会 薬価専門部会」
バイオ医薬品、その後続品(バイオシミラー)の開発促進に向けた検討も
2020年度の薬価制度改革に向けて、中医協では▼2019年6月頃から「主な課題と進め方の確認」「薬価算定組織からの意見聴取」「関係業界からの意見聴取」を始める▼今秋(2019年秋)頃から、本格的な議論を深める―という大きなスケジュールを確認しています(関連記事はこちら)。
さらに今般、厚生労働省保険局医療課の田宮憲一薬剤管理官は、主な検討課題案として次の項目を提示しました。
(1)2018年度改定における附帯意見で、指摘されている▼薬価制度抜本改革骨子で「検討すること」とされている事項▼基礎的医薬品への対応▼後発医薬品の薬価―
(2)これまでに問題提起された▼2020年度改定における実勢価の反映▼有効成分、製法等が先発品と同一のバイオ医薬品(いわゆるバイオセイム)の取扱い▼高額な再生医療等製品の価格算定―
(3)その他、▼薬価算定組織から提起された事項▼関係業界から提起された事項―のうち検討が必要と考えられるもの
2018年度には、「国民皆保険の持続性」「イノベーションの推進」を両立しながら、「国民負担の軽減」「医療の質の向上」の実現を目指した「薬価制度抜本改革」が行われました。例えば、▼新薬創出・適応外薬解消等促進加算(以下、新薬創出等加算)の見直し▼長期収載品から後発医薬品への置き換えを促進するための新ルール(G1・G2ルール)創設▼費用対効果評価に基づく価格調整ルールの導入―など、大きな制度改革が多数盛り込まれています(関連記事はこちらとこちら)。
このうち「新薬創出等加算」では、対象品目の選定基準を、従前の「薬価と市場実勢価格の乖離率が、全品目の平均以下である製品」から、▼希少疾病用医薬品▼開発公募品▼加算適用品▼革新性・有用性のある新規作用機序医薬品―に厳格化する(品目要件)とともに、製造メーカーの新薬開発実績に基づいた「加算の軽重」を設定する(企業要件)という見直しが行われました(関連記事はこちらとこちら)。
後者の企業要件は、▼新薬の収載実績▼開発要請への対応実績―などをポイント化し、ポイントの合計が「上位25%」未満のメーカーが製造する製品については、加算を「減額」するものです(最下位メーカーでは加算を80%に減額、それ以外は90%に減額)。

ただし、この企業要件は「初めて導入するものであり、『限定的』なもの」とされました。今後、新薬の開発状況などを詳しく分析し、企業要件の在り方を探っていくことになります。
また長期収載品から後発品への置き換えを進めるために、従前からある「後発品の出現から5年後に、後発品への置き換え率に応じた引き下げ(Z2ルール)」を行う仕組みを維持した上で、新たに次のような新ルールが設けられました(関連記事はこちらとこちら)。
▽後発品置き換え率80%以上の長期収載品目では、薬価を「後発品価格の2.5倍」とし、その2年後に「同2倍」、4年後に「同1.5倍」と段階的に引き下げ、6年度に「後発品と同価格」とする(G1ルール、長期収載品の市場からの「撤退」も認める)
▽後発品置き換え率80%未満の長期収載品目(いわば後発品への置き換えが難しい品目)では、薬価を「後発品価格の2.5倍」とし、その後、2年ごとに「同2.3倍」「同2.1倍」「同1.9倍」「同1.7倍」「同1.5倍」と段階的に引き下げていく(G2ルール、ただし途中で後発品置き換え率が80%以上になれば、G1ルールへ移行)
▽すでに薬価が「後発品価格の2.5倍未満」となっている長期収載品やバイオ医薬品などは、Z2と同様に「後発品置き換え率」に着目した価格引き下げを継続する(Cルール)
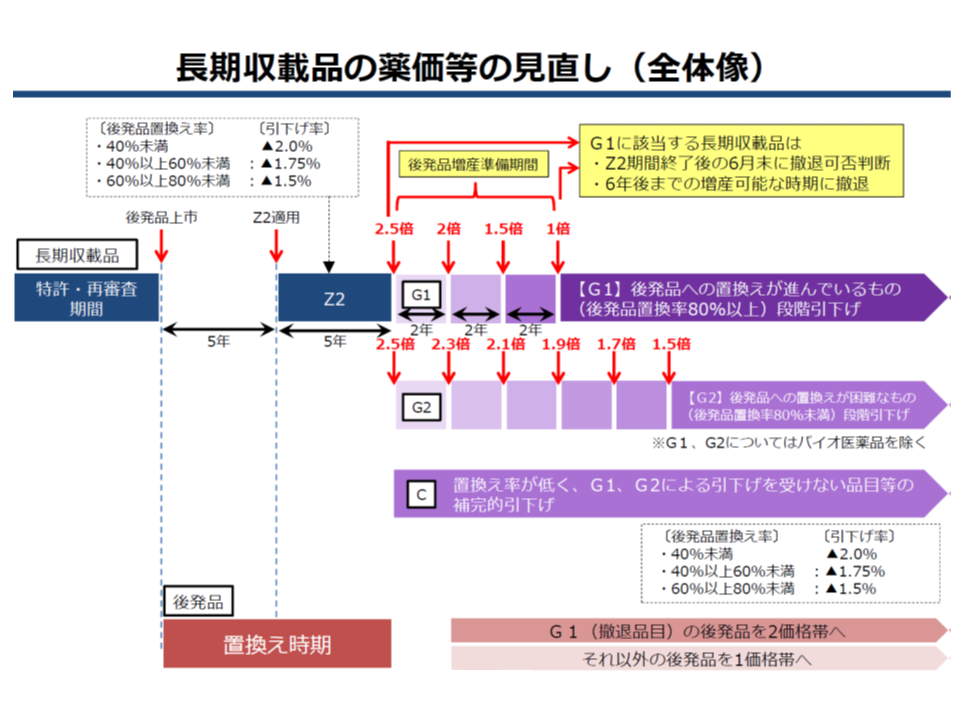
長期収載品から後発品への置き換えを強力に進める新ルール(G1、G2)を導入する
このように長期収載品の価格を段階的に引き下げることで、メーカーによる「後発品への市場の明け渡し」を狙う仕組みですが、今後、「より早期に後発品への置き換えが進む」ような期間設定を検討することになります。
一方、(2)のバイオセイムとは、先行バイオ医薬品(バイオ医薬品の先発品)とまったく同一で、包装のみ異なる製品のことです。バイオ医薬品と同等・同一の品質や有効性・安全性を有する「バイオシミラー」(バイオ後続品、バイオ医薬品の後発品)の開発促進が重要課題となる中で、先行バイオ医薬品の製造メーカー(あるいはその子会社)が「バイオセイム販売」を打ち出せば、バイオシミラー開発が阻害されてしまう可能性があります。
中医協では、暫定的に「バイオセイム価格は、バイオシミラーと同様に扱い、先行バイオ医薬品の70%とする」との取り扱いを決めていますが、今後、▼バイオシミラーの開発状況等に鑑みた「バイオセイム」の薬価算定▼バイオ医薬品の適切な競争環境を維持するための薬価算定上の措置―を検討していくことになります(関連記事はこちら)。
なお、(3)の薬価算定組織や関係団体の意見は、今後、中医協で聴取していくことになります。
こうした検討課題案に異論は出ていませんが、支払側の幸野庄司委員(健康保険組合連合会理事)は、「原価計算方式の在り方」などについても検討対象に加えるよう求めています。
【関連記事】
先行バイオ医薬品とまったく同一の「バイオセイム」登場、薬価の在り方など検討―中医協総会(2)
薬価・材料価格制度の見直し案を決定、14成分の医薬品が市場拡大算定―中医協総会 第384回(2)
薬価制度抜本改革案を修正、新薬創出等加算の厳格化を一部緩和―中医協薬価専門部会
新薬創出等加算の見直し、「容認できない」と製薬メーカー猛反発—中医協薬価専門部会
薬価制度抜本改革の具体案、費用対効果評価による価格引き上げも—中医協薬価専門部会
医療現場に必要不可欠な医薬品の価格下支え、対象拡大の方向―中医協・薬価専門部会
新薬の原価計算方式、診療・支払双方が改めて問題点指摘—中医協・薬価専門部会
医薬品の画期性・革新性、薬価にどう公平に反映させていくべきか—中医協・薬価専門部会
新薬創出等加算、「産業構造の転換」促すため対象企業要件を厳格化してはどうか—中医協・薬価専門部会
長期収載品から後発品への置き換え促進、新薬創出等加算などとセットで議論すべき—中医協・薬価専門部会
製薬メーカーが新薬創出等加算の継続を強く要望―中医協・薬価専門部会
後発品の薬価、現在3区分の価格帯をさらに集約していくべきか-中医協・薬価専門部会
原価計算方式における薬価算定、製薬メーカーの営業利益率などどう考えるか-中医協・薬価専門部会
薬価調査において、医療機関に対する価格調査は継続すべきか-中医協・薬価専門部会
中間年の薬価見直し、対象品目の基準(乖離率など)を事前に示しておくべきか―中医協・薬価専門部会
新薬の薬価設定で、比較対象薬(類似薬)に付加された補正加算をどう考えるべきか―中医協・薬価専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の外国平均価格調整、診療・支払両側から「米国価格は参照対象から除外すべき」との指摘―中医協・薬価専門部会
効能追加などで市場拡大した医薬品の薬価再算定、対象や引き下げ方法の議論開始―中医協薬価専門部会





