先行バイオ医薬品とまったく同一の「バイオセイム」登場、薬価の在り方など検討―中医協総会(2)
2019.3.28.(木)
先行バイオ医薬品とまったく同一のバイオ後続品(バイオセイム、包装のみ異なる)は、別企業によるバイオ後続品(バイオシミラー)の研究・開発等を阻害するおそれがあるのではないか。暫定的にバイオセイムも、バイオシミラーと同じく「先行品の70%」に薬価を設定し、次期改定に向けて「適正な競争環境の確保」のための仕組みなどを検討していく―。
こういった方針が、3月27日の中央社会保険医療協議会の「総会」および「薬価専門部会」で固められました(関連記事はこちら)。

3月27日に開催された、「第151回 中央社会保険医療協議会 薬価専門部会」
バイオセイム、先行バイオ医薬品と包装のみ異なるが、中身は同一
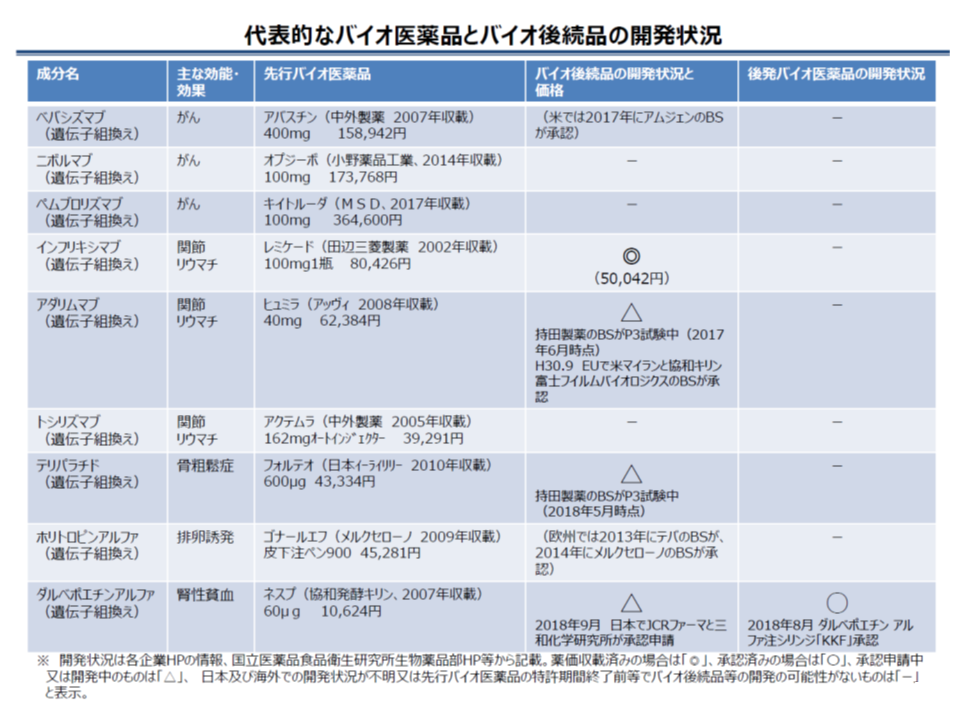
タンパク質や細胞、ウイルスやバクテリアなどの生物によって生産される物質に由来する「バイオ医薬品」の研究・開発に期待が集まっています。がんや糖尿病、希少疾病などに効果のある画期的な医薬品の開発がすでに進んでおり、例えば▼乳がん治療等に用いるハーセプチン▼関節リウマチ治療等に用いるヒュミラ▼肺がんやメラノーマ治療等に用いるオプジーボ―など、その種類は枚挙に暇がありません。
もっともバイオ医薬品の製造には、大規模な設備等が必要となることから「高価格」になりがちです。
この点、バイオ医薬品と同等・同一の品質や有効性・安全性を有する「バイオシミラー」(バイオ後続品、バイオ医薬品の後発品)が、比較的低価格となることから、骨太方針2018(経済財政運営と改革の基本方針2018)でも「有効性・安全性等への理解を得ながら、バイオシミラーの研究開発・普及を推進する」方向が示されています。
ところで、今般、先行バイオ医薬品(バイオ医薬品の先発品)とまったく同一で、包装のみ異なる「バイオセイム」が登場しました。協和発酵キリン社では腎性貧血等の治療に用いる先行バイオ医薬品「ネスプ注射液プラシリンジ」(一般名:ダルベポエチン アルファ(遺伝子組換え))を製造・販売していますが、同一ラインで製造され、包装のみ異なるバイオセイム『ダルベポエチン アルファ注シリンジ「KKF」』(協和発酵キリン社の100%子会社である協和キリンフロンティア社)が薬事承認されたのです。

このバイオセイムの価格をどう設定するかが中医協で議論されました。
バイオシミラーは、後続品ゆえに研究開発等のコストが小さいことから、原則として「先行バイオ医薬品の70%」に薬価が抑えられることになっています(一般の後発品に比べれば研究・開発コストが大きいために、50%(一般の後発品)ではなく、70%に設定されている)。
この点、バイオセイムは、先行バイオ医薬品と同じラインで製造等されるため、さらにコストを小さく抑えられることから、「より低い薬価を設定すべきではないか」とも考えられます。
しかし、バイオセイムの価格を、例えば「一般の後発品と同様に、先行バイオ医薬品の50%に抑える」こととすれば、バイオシミラーよりも低価格となり、患者は「より低価格なバイオセイムを選択する」ことになるでしょう。この場合、バイオシミラーがまったく売れず、研究・開発がストップしてしまうと危惧されます。上記のようにバイオセイムは、先行バイオ医薬品と実質的に同一の製薬メーカーが販売するため、「バイオシミラーのみが市場で負けてしまう」結果となりえるのです。
こうした状況を踏まえ、中医協では、「バイオセイムの価格は、暫定的にバイオシミラーと同様に扱う」(つまり先行バイオ医薬品の70%とする)ことを決定しました。
ところで、前述した腎性貧血等の治療に用いる先行バイオ医薬品「ネスプ注射液プラシリンジ」(一般名:ダルベポエチン アルファ(遺伝子組換え))については、別の製薬メーカー(JCRファーマ、三和化学研究所)がバイオシミラーを開発し、2018年9月に薬事承認の申請がなされています。
このため、中医協委員からは「バイオシミラーに市場を奪われることを危惧した協和発酵キリン社が、100%子会社を使ってバイオセイムを販売することで、バイオシミラーの開発を遅らせよう、阻害しようと考えているのではないか。薬価制度抜本改革では『先発品メーカーは長期収載品に依存する体質から脱却する』方針が示されたが、それに逆行するものとも思える」旨の指摘が出ています。
厚労省保険局医療課の田宮憲一薬剤管理官も、「バイオセイムは、先行バイオ医薬品の子会社やライセンスを受けた企業で開発されるが、一般に優位にある先行バイオ医薬品メーカー(親会社)がバイオセイムを早期に保険収載する理由はなく(先行品の売り上げが落ちてしまうため)、バイオセイムが薬事承認されたとしても、直ちに保険収載希望が出され、薬価収載を経て、保険診療で使えるようになるかは不明である」との考えを示しています。
例えば、先行バイオ医薬品【a】(A社)に対し、バイシミラー【a1】(B社)が登場しそうな場合、「子会社で低価格のバイオセイム【a2】を作ります」(先行品と同一製品であり、薬事承認等のハードルは極めて低い)との情報を出せば、実際に【a2】を保険収載しなくとも、B社は「市場が小さくなるので、【a1】の製造販売等を検討しなおそう」と考える可能性があります。結果として、先行品【a】の市場を維持でき、いわば「バイオセイムの存在を使って、バイオシミラーの研究・開発を阻止しよう」という企業戦略も一部にあるのではないか、との見方です。
競争が激化する製薬メーカーではさまざまな戦略をとらなければならない、という点は十分に理解されますが、公的医療保険制度の1プレイヤーである点を考えれば「こうした企業戦略には違和感を覚える」(今村聡委員:日本医師会副会長)との指摘にも納得できるものがあります。
田宮薬剤管理官は、上記の暫定措置をとることとあわせて、「適正な競争環境を確保する」ために、2020年度の次期薬価制度改革に向けて▼バイオシミラーの開発状況等に鑑みた「バイオセイム」の薬価算定▼バイオ医薬品の適切な競争環境を維持するための薬価算定上の措置―を検討していく方針も提示。中医協でも、この方針が了承されています。バイオシミラー登場の余地はまだ大きく、適切なルール設定の検討が待たれます。
2020年度の次期薬価制度改革、「薬価調査を行うのか」なども含めて検討
なお、中医協では2020年度の薬価制度改革に向けて、▼2019年6月頃から「主な課題と進め方の確認」「薬価算定組織からの意見聴取」「関係業界からの意見聴取」を始める▼今秋(2019年秋)頃から、本格的な議論を深める―という大きなスケジュールを確認しました。
2018年度には薬価制度の抜本改革が行われ、その影響等を詳しく分析し、必要な対応を検討する必要があります。
また、2020年度の薬価設定に向けては、「2019年の薬価調査を行うのか」という問題があります。通常であれば改定の前年9月取り引き分等(2018年度改定であれば2017年9月取り引き分等)を対象に医薬品の実勢価格(医療機関等による購入額)を調べ、そこで得られた乖離率(「公的の償還価格である薬価」と「医療機関等による購入額」との差)をもとに薬価の引き下げ率などを決めます。しかし、2019年10月には消費税率引き上げ(8%→10%)が予定されており、「2019年9月取り引き分の実勢価格をもとに、2020年度の薬価引き下げ率を考えてよいのか」(実勢価格把握に意味があるのか)という問題があるのです。
こうした点を踏まえて、診療側の松本吉郎委員(日本医師会常任理事)や支払側の幸野庄司委員(健康保険組合連合会理事)らは、「検討テーマは多岐にわたっており、可能な限り前倒しで議論できるようにしてほしい」と田宮薬剤管理官に要望しています。
【関連記事】
2020年度診療報酬改定に向け、「医師働き方改革」等のテーマ別や患者の年代別に課題を議論―中医協総会
薬価・材料価格制度の見直し案を決定、14成分の医薬品が市場拡大算定―中医協総会 第384回(2)
薬価制度抜本改革案を修正、新薬創出等加算の厳格化を一部緩和―中医協薬価専門部会
新薬創出等加算の見直し、「容認できない」と製薬メーカー猛反発—中医協薬価専門部会
薬価制度抜本改革の具体案、費用対効果評価による価格引き上げも—中医協薬価専門部会
医療現場に必要不可欠な医薬品の価格下支え、対象拡大の方向―中医協・薬価専門部会
新薬の原価計算方式、診療・支払双方が改めて問題点指摘—中医協・薬価専門部会
医薬品の画期性・革新性、薬価にどう公平に反映させていくべきか—中医協・薬価専門部会
新薬創出等加算、「産業構造の転換」促すため対象企業要件を厳格化してはどうか—中医協・薬価専門部会
長期収載品から後発品への置き換え促進、新薬創出等加算などとセットで議論すべき—中医協・薬価専門部会
製薬メーカーが新薬創出等加算の継続を強く要望―中医協・薬価専門部会
後発品の薬価、現在3区分の価格帯をさらに集約していくべきか-中医協・薬価専門部会
原価計算方式における薬価算定、製薬メーカーの営業利益率などどう考えるか-中医協・薬価専門部会
薬価調査において、医療機関に対する価格調査は継続すべきか-中医協・薬価専門部会
中間年の薬価見直し、対象品目の基準(乖離率など)を事前に示しておくべきか―中医協・薬価専門部会
新薬の薬価設定で、比較対象薬(類似薬)に付加された補正加算をどう考えるべきか―中医協・薬価専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の外国平均価格調整、診療・支払両側から「米国価格は参照対象から除外すべき」との指摘―中医協・薬価専門部会
効能追加などで市場拡大した医薬品の薬価再算定、対象や引き下げ方法の議論開始―中医協薬価専門部会





