薬価制度抜本改革の具体案、費用対効果評価による価格引き上げも—中医協薬価専門部会
2017.11.24.(金)
11月22日に中央社会保険医療協議会の薬価専門部会が開催され、「薬価制度の抜本改革」の具体案が厚生労働省から提示されました。今後、関係団体からの意見なども踏まえ、年末に向けて具体案取りまとめの議論が急ピッチで進められます。
なお、関連して懸案事項となっていた「費用対効果評価結果に基づいた、薬価・保険医療材料価格を引き上げるケースを認めるべきか」というテーマについて、診療・支払双方とも「限定付きで了承」しています。

11月22日に開催された、「第140回 中央社会保険医療協議会 薬価専門部会」
目次
原価計算方式、費用の内訳などの開示を進める
昨年(2016年)末に「薬価制度の抜本改革に向けた基本方針」(以下、基本方針)が、塩崎恭久前厚生労働大臣、麻生太郎財務大臣、菅義偉内閣官房長官、石原伸晃前内閣府特命担当大臣の4大臣会合で固められました。その後、中医協での抜本改革の具体化に向けた議論が行われ、今般、その骨子案が厚生労働省から提示されたものです。骨子案には、さまざまな改革内容が盛り込まれており、ポイントを絞って見ていきましょう。
新薬の薬価は、(1)類似薬がある場合には、それと同じ価格に設定する(類似薬効比較方式)(2)類似薬がない場合には、製造原価などを積み上げて設定する(原価計算方式)―という2つの手法で設定され、さらに有用性や画期性などを踏まえた加算の上乗せ、外国価格を踏まえた調整などが行われます。
このうち(2)の原価計算方式には、「革新的で研究開発費が高額だが、原価が安い」品目では、研究開発費の回収が難しいという課題があります。これは、研究開発費に「業界平均値」という上限(現在は45.9%)が設定されているためで、今般▼総原価の80%が開示され妥当性が確認できる▼化学合成品である—品目について、上限値を「70%」に引き上げる方針が示されました。同時に、有用性や画期性を評価する「加算」についても、総原価の開示度を踏まえた重み付け(開示度が80%未満50%以上にとどまれば加算割合を6割に減額、50%未満であれば2割に減額)も行われます。こうした見直しは、研究開発コストの回収を進めやすくする(結果的に画期的製品が生まれる下地が作られる)とともに、中医協委員からの「原価計算方式は不透明である。メーカー側の言い値ではないか」との指摘に応える狙いがあります。
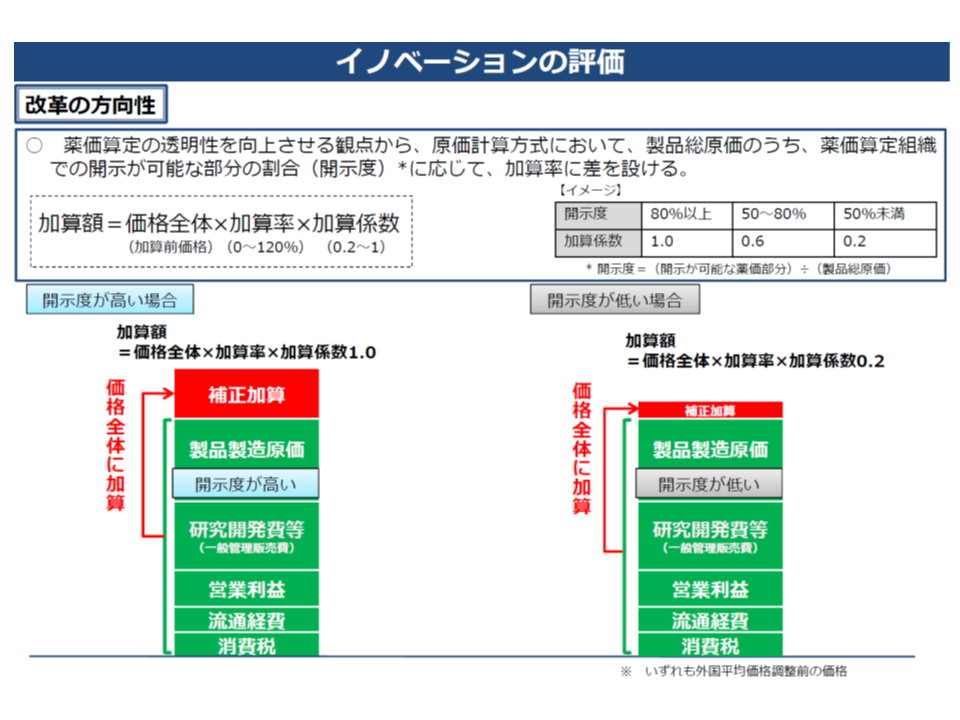
原価計算方式において、原価の開示度が低い場合には加算の減額が行われる
また外国価格との調整は、現在、▼米国▼英国▼フランス▼ドイツ—の4か国の価格を踏まえて行われています(日本の価格が4か国平均よりも高すぎる、あるいは低すぎる場合には調整する)が、「米国価格は市場価格ではない(メーカーの希望小売価格)。比較対象から除外すべきではないか」との指摘があります。しかし、米国は世界最大の市場であるため、これを無視することはできず、厚労省は「米国の医療保険制度(高齢者向けのメディケア、低所得者向けのメディケイド)で採用される価格表(ASP、NADAC)」を採用する考えを示しています。また、(1)の類似薬効比較方式における外国価格調整には、「類似薬と価格を揃えた後に、わざわざ価格の引き上げ(下げ)を行うのは不合理ではないか」との指摘があり、廃止される見込みです。
毎年の薬価調査を実施、新薬創出等加算は企業要件・品目要件を厳格化
上記のように薬価が設定されますが、メーカー・卸・医療機関などへの販売価格(市場実勢価格)はそれよりも低くなります。薬価と市場実勢価格との差(いわゆる薬価差)があまりに大きいことは、公的医療保険では許されないため、現在は、▼2年に一度、市場実勢価格を調査する(薬価調査)▼調査の結果、乖離が大きい品目については薬価を引き下げる(薬価改定)—仕組みが設けられています。
この仕組みについて基本方針では、「国民負担の軽減」や「皆保険制度の維持」といった視点を重視し、「市場実勢価格の調査を毎年行い、乖離の大きな品目は毎年度、価格を見直す」よう指示。厚労省は、現場の負担なども考慮して「すべての医薬品卸を対象に中間年の薬価調査を行い、その結果に基づいて、乖離の大きな品目の薬価改定を行う」方針を明確にしました。最初の中間年調査は2021年から導入されます(2018年度、20年度には通常の薬価調査が行われ、19年度は消費税率引き上げに伴う薬価改定が必要となり、必然的に薬価調査が行われるため)。
このように薬価は「継続して下がっていく」運命にありますが、新薬製造メーカーからは「研究開発などに費やしたコスト回収ができず、新たな製品の開発が難しい」との悲鳴が出ていました。そこで厚労省は、2010年度の薬価制度改革において「一定の品目について、後発品出現するまでの間、薬価を一定程度維持できる」仕組み(新薬創出・適応外薬解消等促進加算)を試行的に導入しました。メーカーが加算で得た原資を新薬開発に回すことで、いわゆるドラッグラグ(外国で承認されている医薬品が、我が国で承認されない事態)の解消を狙ったものです。
しかし加算の対象が、「厚労省からの医薬品開発要請などに応じる」企業(企業要件)の「薬価と市場実勢価格の乖離率が、全品目の平均以下である」製品(品目要件)とされており、中医協委員からは「真に医療上、必要な品目に限定すべき」との強い要請が出ていました。そこで厚労省は、この要件を厳格化。▼新薬の収載実績や、開発要請への対応実績などをポイント化し、上位5%以下のメーカーは加算を減額する▼対象品目は「新規作用機序により既存治療で効果不十分な疾患への有効性がある」「新規作用機序により既存治療よりも優れている」などに限定する—というものです。厚労省はこの仕組みの制度化を考えており、名称も「革新的新薬創出等促進制度」(仮称)に改めたい考えですが、11月22日の薬価専門部会では松本純一委員(日本医師会常任理事)らから「名称も含めて、制度化については今後も検討したい」との慎重姿勢を示しています。
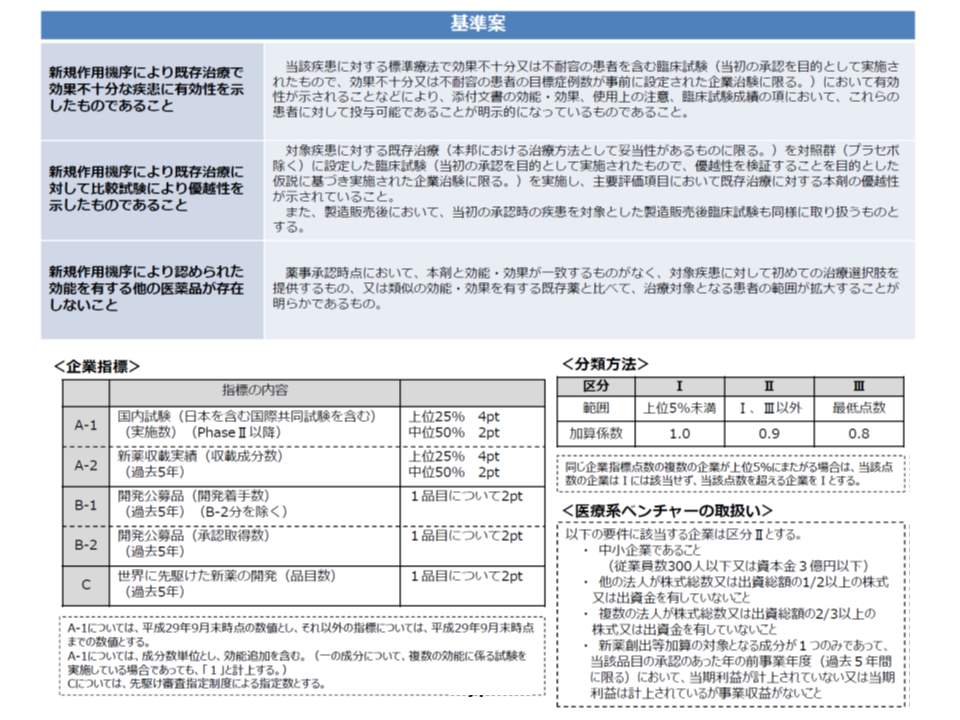
現行の新薬創出・適応外薬解消等促進加算に比べて、企業要件(図下段)、品目要件(図上段)ともに厳格化される
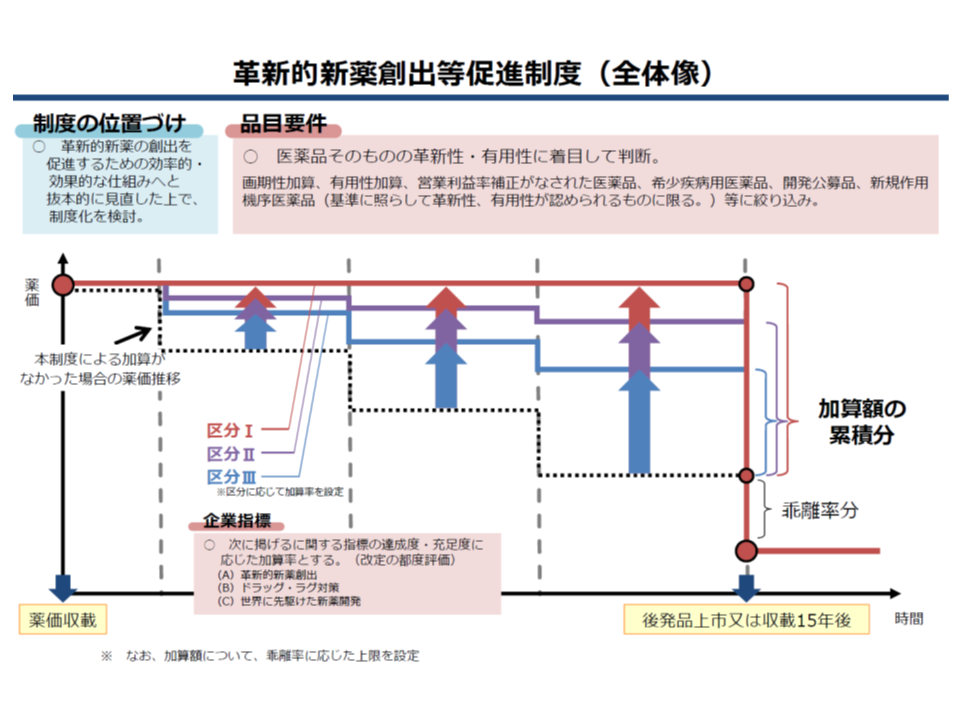
革新的新薬創出等促進制度の全体像
長期収載品から後発品への置き換えを強力に推進する新ルールを創設
上述のように「薬価は継続的に引き下げられる」運命にあり、いずれ特許が切れ、後発品が出現してきます。
政府は医療費適正化の一環として「後発品の使用促進」を重要施策の1つに位置付けており、後発品が出現した先発品(長期収載品)については「後発品へ市場を明け渡す」か、「価格を引き下げる」かの、いずれを選択するかが迫られます。具体的には、後発品への置き換え(市場明け渡し)が進まない長期収載品は、価格が継続的に引き下げられるのです(市場実勢価格を踏まえた引き下げに加え、後発品置き換え率に応じたさらなる引き下げが行われる、Z2ルール)。
今般、厚労省はこの仕組みをさらに進化させ、さらに「後発品への置き換え」を進めたい考えを示しました。次のような仕組みが導入される見込みです。
▼後発品が出現してから5年後から、後発品への置き換え率に応じた引き下げ(Z2ルール)を行う
▼Z2適用から5年後に、後発品への置き換え率に着目した次の新ルールを適用する
▽後発品置き換え率が80%以上の品目については「後発品価格の2.5倍」とし、その2年後に「同2倍」、4年後に「同1.5倍」と段階的に引き下げ、6年度に「後発品と同価格」とする(G1ルール、これらについてはメーカーに市場からの「撤退」を認める)
▽後発品置き換え率が80%未満の品目や(いわば後発品への置き換えが難しい品目)については「後発品価格の2.5倍」とし、その後、2年ごとに「同2.3倍」「同2.1倍」「同1.9倍」「同1.7倍」「同1.5倍」と段階的に引き下げていく(G2ルール)。ただし途中で後発品置き換え率が80%以上になれば、G1ルールへ移行する
▽すでに後発品価格の2.5倍未満となっている長期収載品やバイオ医薬品などは、Z2と同様に「後発品置き換え率」に着目した価格引き下げを継続する(Cルール)
またG1・G2で長期収載品価格が「後発品価格の2.5倍」となる際、当該後発品の価格は「1価格帯」に集約されます(ただしG1品目については、後発品の急激な「増産」も必要となるため、後発品シェア50%を基準に2価格帯とする)。
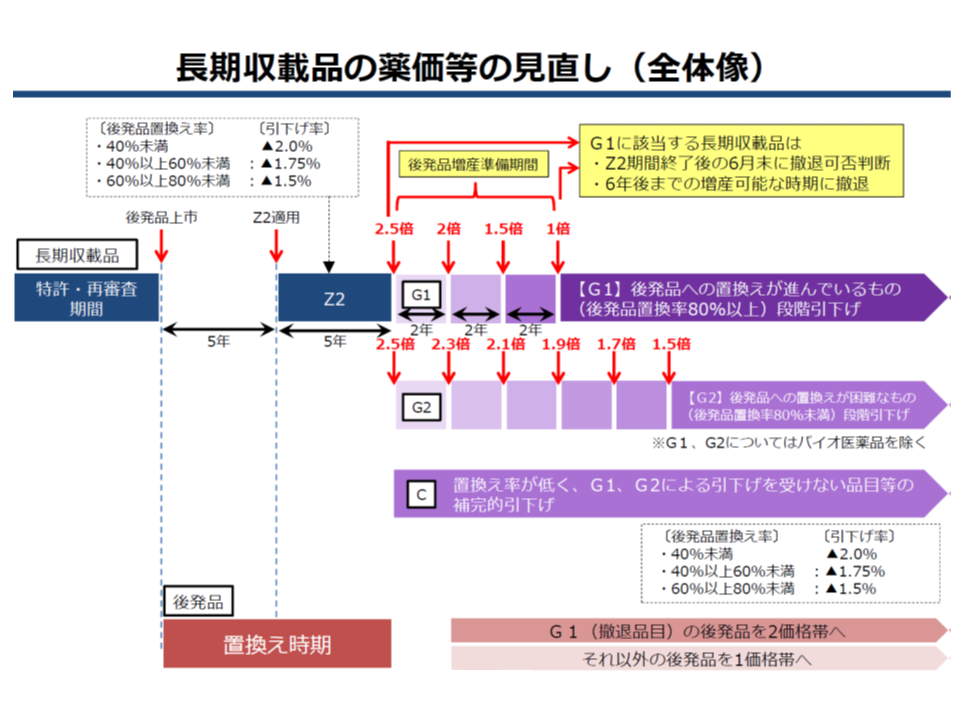
長期収載品から後発品への置き換えを強力に進める新ルール(G1、G2)を導入する
この見直し案に多くの委員が「後発品への置き換えスピードが遅すぎる(G1であれば、長期収載品が後発品と同価格になるのは、後発品出現から16年後)」と指摘しましたが、厚労省保険局医療課の中山智紀薬剤管理官は「後発品出現後に、一気に長期収載品価格を引き下げれば、後発品の出現阻害や、長期収載品価格の高止まりといった弊害もある」旨を説明し、理解を求めています。
効能効果追加などによる市場拡大を迅速に把握し、対応
上記のように、2年に一度の市場実勢価格を踏まえた薬価改定が行われますが(今後は乖離率が大きいものは毎年改定)、その際、「効能効果の追加などで、市場が当初予測よりも大幅に拡大した場合の薬価引き下げ」(市場拡大再算定)なども行われます。
この点、2016年度の前回改定では「画期的抗がん剤のオプジーボについて、市場拡大再算定の対象か否かを判断する時期の後に、効能効果が追加され、市場拡大再算定の対象とならず、高価格が維持される」という事態が生じました。その後、皆保険維持の観点で、オプジーボについて特例の薬価改定が行われたことは記憶に新しいところです。
こうした事態は今後も生じる可能性があり、厚労省は「効能効果追加などで市場が大幅に拡大した医薬品に、より迅速に対応することが必要」とし、▼1年に4回、NDB(National Data Base)を活用して、効能効果追加などがなされた医薬品の市場をウォッチする▼市場が大幅に拡大したと確認された医薬品については、中医協の判断を経て、通常の薬価改定を待たずに薬価を引き下げる—という新ルールを導入する考えを示しています。具体的には、NDBから12月診療分・3月診療分・6月診療分のデータを抽出・分析し(1か月分のデータを12倍し年間販売額を推測する)、「ある医薬品が効能効果追加などの使用量が大幅に増加している」ことが判明した場合には、在庫などに配慮した期間後に薬価の引き下げを行うことになります(9月診療分は、通常の薬価改定ルールに基づいて把握され、引き下げが行われる)。
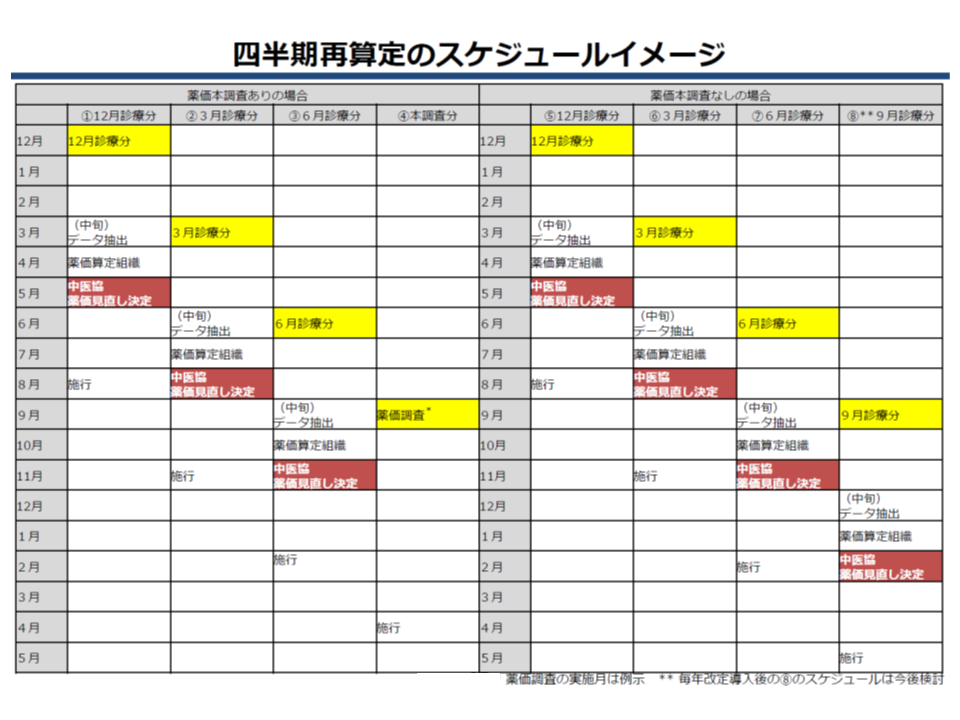
NDBを用いて医薬品使用状況をウォッチし、効能効果追加などで市場が大幅に拡大した製品の価格引き下げを行う
ただし、NDBデータに基づく調査には限界もあるため、メーカーへの過大な不利益を避けるために(薬価調査に基づかない薬価引き下げはメーカー経営に大きな影響を与えてしまう)、引き下げの対象は▼効能効果追加などがなされた医薬品▽薬価収載時に2年度目の販売予想が150億円(原価計算方式の場合は100億円)以上とされたもの—に限定されます。また、年間の推計販売額が350億円を超える場合に「市場が大きい」と判断されることになります。
費用対効果評価を踏まえて加算を対象に価格調整、価格引き上げの可能性も
ところで、医薬品・医療機器などの価格設定について、新たに「費用対効果評価」の観点を導入することになっています。現在、13品目を対象に試行が行われており、2018年度に「費用対効果評価に基づく価格見直し」が行われます。
この点、「価格見直し」の対象を「薬価や材料価格の全体とする」のか、「加算部分にとどめる」のかが問題となっていましたが、厚労省は「試行は、比較薬などと比べて有用性があるとして、加算を受けている品目を対象としている。薬価などの全体を対象に費用対効果評価を行えば、比較薬よりも価格が低く設定される可能性があるが、『有用性がある』との判断と矛盾してしまう」ことなどを考慮し、後者の「加算部分にとどめる」考えを明示しています。なお、原価計算方式で薬価などが設定された品目は、前者の「薬価や材料価格の全体」が対象となりますが、「営業利益本体と製造総原価の合計額」を下回らないように調整されます。
さらに、費用対効果評価に基づく価格引き下げは「90%」を限度とする考えも示されました。上述の「市場実勢価格を踏まえた価格見直し」や「市場拡大再算定」などの後に、費用対効果評価を踏まえた価格見直しが実施されます。後述の点も含めて、薬価専門部会後に開催された保険医療材料専門部会でも了承されました。

費用対効果評価の価格調整対象は、加算部分(類似薬効比較方式)のみとし、最大で90%の価格引き下げ(加算部分)が行われる
なお、「比較薬などよりも、『費用が減少』して『効果が上がる(または同等)』品目」については、価格の引き上げが行われることが了承されています(最大で評価前価格から10%上乗せ)。これまで、支払側の幸野庄司委員(健康保険組合連合会理事)らが「医療保険制度の維持を目的とした仕組みであり、価格引き上げが認められない」と強く反対していましたが(関連記事はこちら)、対象を▼比較対象よりも効果が高い(または同等)▼一般的な改良の範囲を超えている(基本構造や作用原理が異なるなど)―ものを個別に審査し、かつ引上げ額を「比較対象と比べて、患者1人当たりの費用削減額が2分の1に相当する額」以下(引き上げても医療費は削減される)とするなどの限定が行われたことから、了承に至りました。ただし、診療側の松本純一委員は「価格引き上げは試行段階にとどめるべき」と注文を付けています。2018年度中に「本格導入」に向けた結論を得ることとなっており、改めて議論が行われる可能性があります。
【関連記事】
医療現場に必要不可欠な医薬品の価格下支え、対象拡大の方向―中医協・薬価専門部会
新薬の原価計算方式、診療・支払双方が改めて問題点指摘—中医協・薬価専門部会
医薬品の画期性・革新性、薬価にどう公平に反映させていくべきか—中医協・薬価専門部会
新薬創出等加算、「産業構造の転換」促すため対象企業要件を厳格化してはどうか—中医協・薬価専門部会
長期収載品から後発品への置き換え促進、新薬創出等加算などとセットで議論すべき—中医協・薬価専門部会
製薬メーカーが新薬創出等加算の継続を強く要望―中医協・薬価専門部会
後発品の薬価、現在3区分の価格帯をさらに集約していくべきか-中医協・薬価専門部会
原価計算方式における薬価算定、製薬メーカーの営業利益率などどう考えるか-中医協・薬価専門部会
薬価調査において、医療機関に対する価格調査は継続すべきか-中医協・薬価専門部会
中間年の薬価見直し、対象品目の基準(乖離率など)を事前に示しておくべきか―中医協・薬価専門部会
新薬の薬価設定で、比較対象薬(類似薬)に付加された補正加算をどう考えるべきか―中医協・薬価専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の外国平均価格調整、診療・支払両側から「米国価格は参照対象から除外すべき」との指摘―中医協・薬価専門部会
効能追加などで市場拡大した医薬品の薬価再算定、対象や引き下げ方法の議論開始―中医協薬価専門部会
薬価の毎年改定方針を決定、DPC点数表も毎年改定へ―厚労省
既存製品よりも費用が安く済み、効果の高い製品の価格は引き上げるべきか―費用対効果評価合同部会
医薬品などの費用対効果評価、業界は「加算のみへの反映」を切望—中医協・費用対効果評価合同部会
医薬品などの費用対効果評価、結果は加算のみに反映させるか、価格全体に及ぼすか—中医協・費用対効果評価関係
費用対効果評価、10月までに試行導入の詳細、年内に制度化の骨子を固める—中医協・費用対効果評価専門部会
費用対効果、試行導入には「支払い意思額調査」結果は用いず—中医協・費用対効果評価専門部会
費用対効果を判断するための「支払い意思額調査」、聞き方も含めて再検討—中医協・費用対効果評価専門部会
新医療技術の恩恵を受ける国民を対象に「いくらまで支払えるか」を調査—中医協・費用対効果専門部会
費用対効果評価の結果、どのタイミングで薬価などに反映させるか—中医協・費用対効果専門部会
費用対効果評価の結果、「保険償還価格の調整」に活用—中医協・費用対効果専門部会
医療技術の費用対効果評価、厚労省が仮想具体例で詳説—中医協・費用対効果評価専門部会
医療技術の費用対効果評価、「感染症対策への有用性」など6要素も勘案—中医協・費用対効果評価専門部会
医療技術の費用対効果、評価のための基準値を設定する方針に転換―中医協・費用対効果評価専門部会
費用対効果評価、新規収載の医薬品なども対象に2018年度から本格導入へ―費用対効果評価専門部会
2018年度の費用対効果評価に基づく再算定、オプジーボやハーボニーなど12品目に決定―中医協総会
2016年4月以降、費用対効果評価の対象として補正加算が高いものなど8品目程度を選定―中医協総会
費用対効果の良し悪しを判断する基準値、2016年度改定では定めず―費用対効果評価専門部会
費用対効果評価、対象は「保険収載後、1-2回の改定を経たもの」に―費用対効果評価専門部会
費用対効果評価、試行段階では社会的影響を評価する特別ルールは定めず―費用対効果評価専門部会
費用対効果評価の結果は医薬品・医療機器の再算定に活用―費用対効果評価専門部会
費用対効果評価はQALYを基本に実施、他の指標の使用も認める―中医協・専門部会
薬などの費用対効果、まず既収載品の再算定に活用、価格への反映は18年度改定時か―中医協・専門部会





