新薬創出等加算、「産業構造の転換」促すため対象企業要件を厳格化してはどうか—中医協・薬価専門部会
2017.6.14.(水)
ゼロベースでの抜本的見直しが求められている新薬創出・適応外薬解消等促進加算(以下、新薬創出等加算)について、産業構造の転換などを促すために「対象品目や、対象となる製薬企業の絞り込み(厳格化)」を行う必要があるのではないか—。
14日に開催された中央社会保険医療協議会の薬価専門部会では、診療・支払双方の委員からこういった意見が出されました。もっとも製薬業界の急激な再編にもつながる考え方であり、慎重な検討も求められそうです。
新薬創出等加算の「平均乖離率」要件、革新性を評価できていない
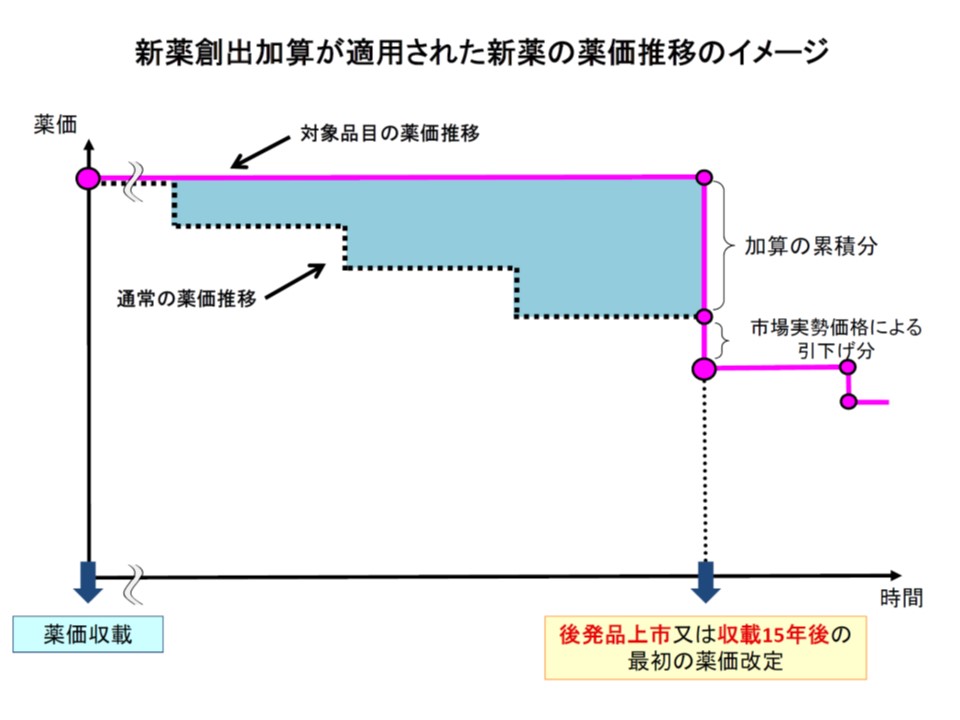
新薬創出等加算は、2010年度の薬価制度改革において「ドラッグラグを解消するために、先発品の薬価を一定程度維持し、製薬メーカーが適応外や未承認の医薬品を開発する原資を確保する」ために創設されました。主に後発品のない先発品(薬価基準収載後15年まで)について、2年に一度の薬価改定後も「市場実勢価格の8割」を維持する(改定前薬価が上限)ものです。
この加算によって適応外薬・未承認薬の開発が相当程度進み、ドラッグラグの解消に大きな効果が出ていますが、(1)対象品目の選定方法(2)対象となる製薬企業の要件(3)加算対象品目が比較薬となる場合—などに問題があるとの指摘がかねてから薬価専門部会で出されており、また昨年(2016年)末の「薬価制度の抜本改革に向けた基本方針」「薬価制度の抜本改革に向けた基本方針」や財政制度等審議会の建議、骨太方針2017などでは「新薬創出等加算のゼロベースでの抜本的見直し」が求められています(関連記事はこちらとこちらとこちら)。
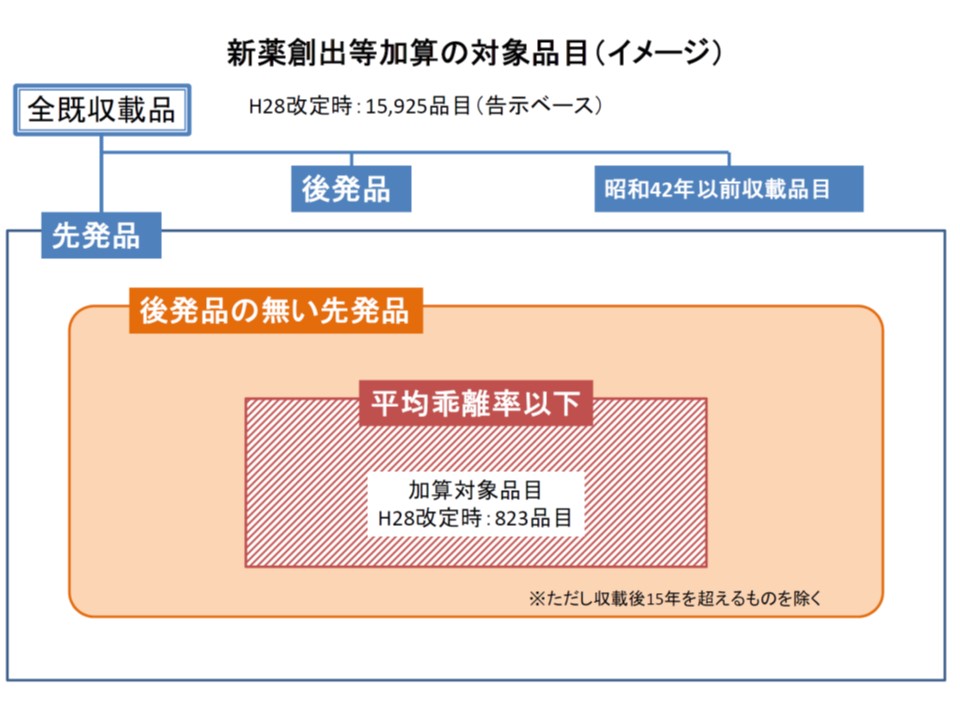
このうち(1)の対象品目については、現在「平均乖離率(薬価と市場実勢価格との乖離)以内の医薬品」とされていますが、「革新的医薬品などを抽出する指標としてふさわしくない」という強い指摘が出されています。さらに平均乖離率を指標とするとことで「製薬メーカーが乖離率を小さくするために仕切価を高く設定し、結果として薬価水準全体の高止まりを生む」との問題があるとの意見もあります。
厚生労働省保険局医療課の中山智紀薬剤管理官は、▼革新性▼真の有効性—に着目した指標の設定を検討すべき旨の見解を述べています。
この点について支払側の吉森俊和委員(全国健康保険協会理事)は、画期性の低い「類似薬効比較方式(II)で薬価算定された医薬品」(新規性に乏しい)や「配合剤」は「新薬創出等加算の対象から除外すべき」と提案しました。しかし中山薬剤管理官は「類似薬効比較方式(II)の対象となる医薬品の中には『同時期に新薬開発が競合してしまった』というケースもあると指摘、またメーカー代表の加茂谷佳明専門委員(塩野義製薬株式会社常務執行役員)は「既存品では安全性の問題があって使用できなかった領域において、新たに安全性を高めて使用できるようになるケースもある」とし、ともに「中身を丁寧に見ながら慎重に検討する必要がある」と説明しています。
製薬企業要件、新薬開発投資率などを指標に厳格化すべきか
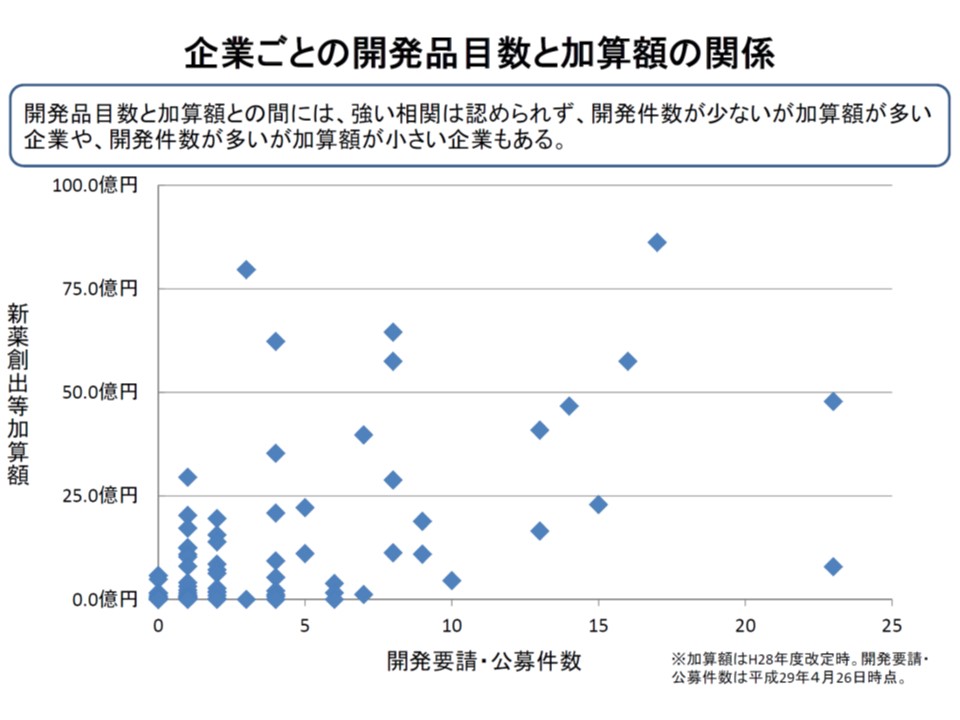
また(2)の製薬企業要件については、「加算を受けるにふさわしいメーカー」(適応外薬・未承認薬の開発を行う、真に医療の質向上に貢献する医薬品の開発を行うメーカー)への絞り込みが行われていますが、依然として「加算と要件のミスマッチ」があると指摘されます。具体的に言えば、加算額が多いにもかかわらず、適応外薬・未承認薬の開発数が少ない企業があるという問題です。
中山薬剤管理官は、ミスマッチの解消に向けて▼売上高に占める新薬開発への投資比率▼世界同時開発(国際共同治験)の実施▼産学連携への取り組み—などを指標として、「革新的新薬の創出」の程度に応じて加算額に「段階」を設けてはどうかとの考えを示しました。例えば、A製薬メーカーは適応外薬などの開発を行っているが、その程度が低いので「加算の対象にはなるが、加算率は下げる」といった手法などが考えられそうです。
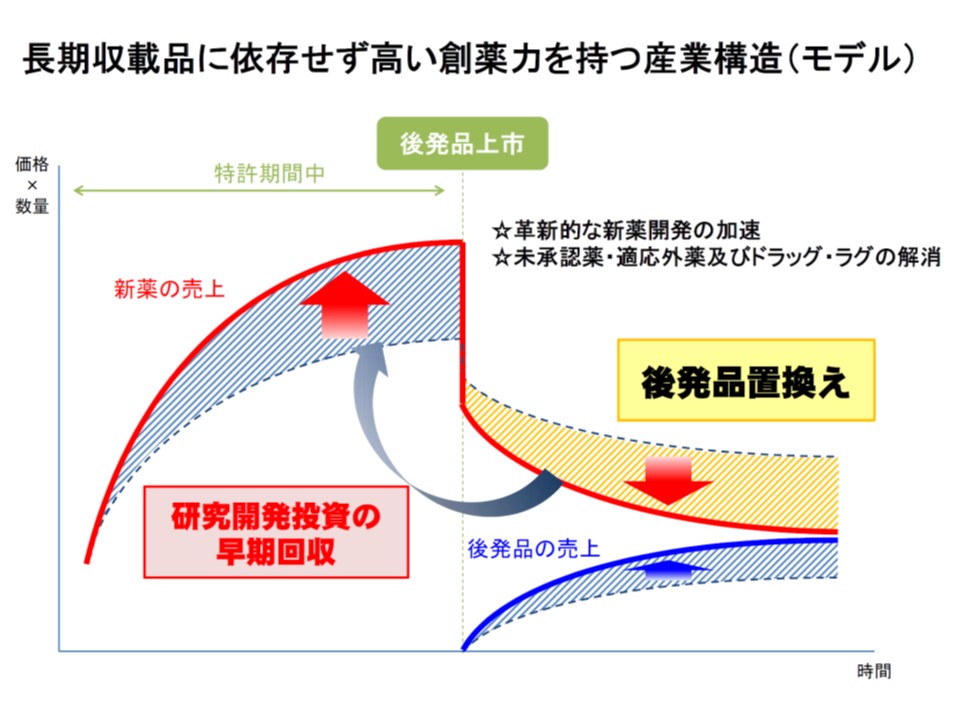
診療・支払双方ともに「高い創薬力」を持つ産業構造への転換を促すべきであり、そこでは「革新性の高い医薬品・新に有効な医薬品を開発する企業」の要件などを厳格化し、先発品メーカーがその水準に上がってきてほしいと考えているようで、支払側の幸野庄司委員(健康保険組合連合会理事)は中山薬剤管理官の提案に賛同し、中川委員も提案に明確な反対は示していません。もっとも中川委員は「国際共同治験から一歩踏み込んで、『日本国内の治験症例数』などを指標にしてはどうか」「グローバルメガファーマがより強くなる仕組みだが、先発品メーカーの再編などが加速しないか注視する必要がある」と注文を付けています。より開発力の高い(一般的には体力のある)先発品メーカーへのさらなる集中が起こることを見越した注文と言えます。
また(3)は、新薬創出等加算の対象でない企業(下図の白抜き部分)からAという新薬が開発され、このAの薬価を算定する際に、比較薬(類似薬)として新薬創出等加算の対象となっているBが選択された場合、「Aの価格にはBの加算分が考慮され、高い薬価が設定されてしまう」(間接的に加算の恩恵を受けている)という問題です。
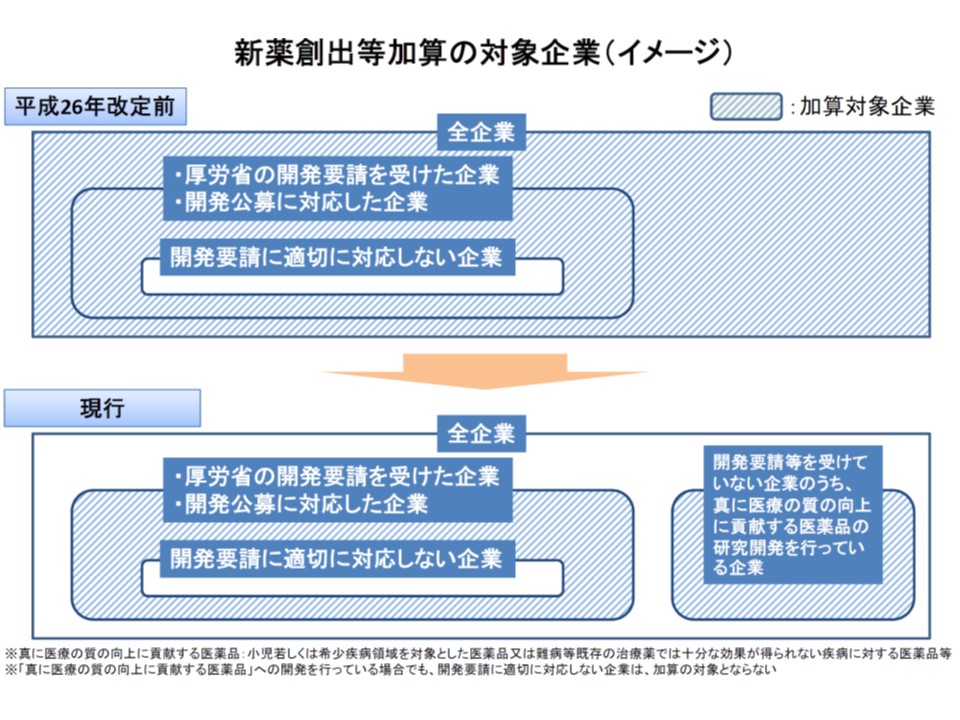
新薬創出等加算の対象となる企業は、適応外薬・未承認薬の開発や医療の質向上に貢献する医薬品の開発を行っているところに限定される(つまり、こうした要件に該当しない企業の先発品は、乖離率が小さくても加算の対象とならない)
この点、中山薬剤管理官は「比較薬Bにおいて、これまで薬価引き下げが猶予された分」も、新薬加算終了時に追加して引き下げた薬価としてはどうかとの提案を行いました。しかし中川委員は、「開発コストをメーカーが回収し終わった後に価格を引き下げるのは、新薬創出等加算の趣旨にそぐわない」と指摘し、再考を求めました。なお、上記のような問題は制度的には存在しますが、適応外薬・未承認薬の開発要請に対応していないメーカー(下図の白抜き部分)は現時点で存在せず、実際面では上記のような問題は生じていません。
なお「新薬創出等加算」改革に関して中川委員と幸野委員は、「試行を継続しながら見直す」(抜本改革をした上で制度化するわけではない)べきと主張しましたが、加茂谷専門委員は「企業経営の予見性・安定性を確保するために制度化を検討すべき」と反論しています(こちら)。
また幸野委員は「新薬創出等加算の原資(財源)」は「Z2などの引き下げ」で賄うべき(いわゆる財政中立とする)旨を指摘しています。


【関連記事】
長期収載品から後発品への置き換え促進、新薬創出等加算などとセットで議論すべき—中医協・薬価専門部会
製薬メーカーが新薬創出等加算の継続を強く要望―中医協・薬価専門部会
後発品の薬価、現在3区分の価格帯をさらに集約していくべきか-中医協・薬価専門部会
原価計算方式における薬価算定、製薬メーカーの営業利益率などどう考えるか-中医協・薬価専門部会
薬価調査において、医療機関に対する価格調査は継続すべきか-中医協・薬価専門部会
中間年の薬価見直し、対象品目の基準(乖離率など)を事前に示しておくべきか―中医協・薬価専門部会
新薬の薬価設定で、比較対象薬(類似薬)に付加された補正加算をどう考えるべきか―中医協・薬価専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の外国平均価格調整、診療・支払両側から「米国価格は参照対象から除外すべき」との指摘―中医協・薬価専門部会
効能追加などで市場拡大した医薬品の薬価再算定、対象や引き下げ方法の議論開始―中医協薬価専門部会
薬価の毎年改定方針を決定、DPC点数表も毎年改定へ―厚労省
2018年度改定、医療費の伸び、国民負担など考慮せよ—骨太方針2017を閣議決定、ここでもプラス改定を牽制
2018年度診療報酬改定で入院基本料の報酬水準や要件など検討せよ—経済財政諮問会議で骨太方針2017素案