薬価制度抜本改革案を修正、新薬創出等加算の厳格化を一部緩和―中医協薬価専門部会
2017.12.13.(水)
薬価制度抜本改革の具体案について、企業側の意向なども一部踏まえて、「新薬創出・適応外薬解消等促進加算の見直し案」などを一部修正することが、12月13日の中央社会保険医療協議会・薬価専門部会で了承されました。
近く骨子案が厚生労働省から示され、年内(2017年内)には中医協・総会で改革の具体案が正式に固められます。

12月13日に開催された、「第142回 中央社会保険医療協議会 薬価専門部会」
関係団体ヒアリングでの厳しい指摘なども踏まえ、薬価抜本改革案を一部修正
昨年(2016年)末に、▼国民皆保険の持続性▼イノベーションの推進—を両立しながら、▼国民負担の軽減▼医療の質の向上—を実現することを目指した、「薬価制度の抜本改革に向けた基本方針」(以下、基本方針)が、塩崎恭久前厚生労働大臣、麻生太郎財務大臣、菅義偉内閣官房長官、石原伸晃前内閣府特命担当大臣の4大臣会合でまとまりました。
薬価専門部会では、今年(2017年)初めから基本方針の具体化に向けた議論を精力的に行い、11月22日には膨大な見直し内容を盛り込んだ具体案が厚労省から提示されました。例えば、新薬創出・適応外薬解消等促進加算(以下、新薬創出等加算)の対象品目の限定、長期収載品から後発医薬品への置き換えを促進するための新ルール(G1・G2ルールの創設)、費用対効果評価に基づく価格調整ルールの導入など、大きな見直し項目が目白押しとなっています。
しかし、大きな見直しゆえに製薬メーカー側の動揺も大きく、11月29日の薬価専門部会における関係団体(日本製薬団体連合会、米国研究製薬工業協会:PhRMA、欧州製薬団体連合会:EFPIA Japanなど)からは極めて厳しい意見が相次ぎました。特に対象品目を厳しく絞る「新薬創出等加算の見直し案」には強い批判が出され、PhRMAは「日本では開発費用が割高になる。新薬創出等加算の見直しがこのまま行われれば、日本を『新薬の最初の導入国』にすることが不可能になる」とコメントしていました。これはいわゆるドラッグ・ラグの「拡大」につながると懸念されます。
厚労省は、こうした指摘なども踏まえ、具体案を一部修正することを決断しました。
まず「新薬創出等加算」については、当初、厚労省から次のような見直し案が提示されました。
(1)【品目要件】について、現在の「薬価と市場実勢価格の乖離率が、全品目の平均以下である製品」という基準から、▼希少疾病用医薬品▼開発公募品▼加算適用品▼革新性・有用性のある新規作用機序医薬品―に厳格化する
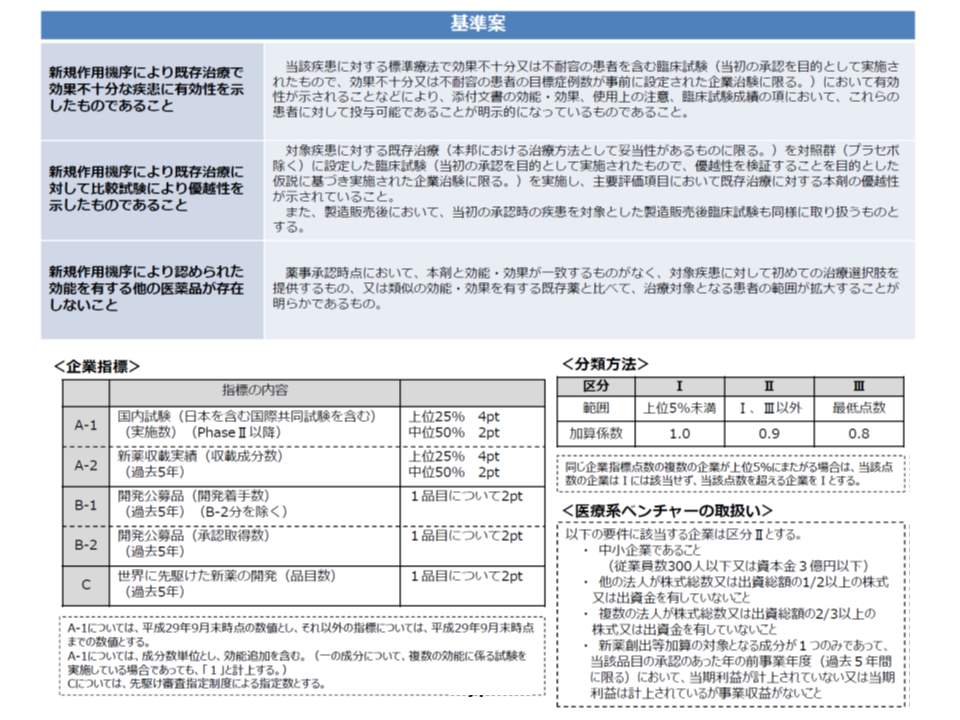
(2)【企業要件】についてメリハリをつけ、▼新薬の収載実績▼開発要請への対応実績―などをポイント化し、ポイント合計が「上位5%」未満のメーカーが製造する製品については、(1)の品目要件を満たしていても「加算の減額」を行う(最下位メーカーの製品は加算を80%に減額、それ以外の「上位5%」以上のメーカーの製品は加算を90%に減額)
現行の新薬創出・適応外薬解消等促進加算に比べて、企業要件(図下段)、品目要件(図上段)ともに厳格化される
これについてメーカーサイドの「厳しすぎる見直し案である」との指摘を踏まえ、厚労省は(1)(2)のいずれについても一部修正を行うことにしています。
まず(1)の品目要件のうち、「革新性・有用性のある新規作用機序医薬品」について、当初案では▼革新性・有用性の基準を満たす1番手の製品▼1番手から「1年以内」に薬価収載され、かつ「1番手が加算適用品」である2番手・3番手の製品―とされていましたが、後者の2番手・3番手製品について「1番手から『3年以内』に薬価収載され、かつ1番手が加算適用品または革新性・有用性基準該当品目である」と拡大修正を行う考えです。

新薬創出等加算の見直し案における「企業要件」について、新規作用機序医薬品の2番手・3番手製品について対象の絞り込みを一定程度緩和する

新薬創出等加算の見直し案において、新たな対象品目について、「新規作用機序医薬品」では、3つの革新性・有用性基準を満たすもののみが対象となるとの厳格化が行われる(ここは当初案から変更なし)
2番手・3番手の製品開発にも1番手と同等の開発リスクが生じることや、1番手の情報を踏まえてから2番手・3番手製品を開発した場合には「3年以内でも薬価収載が困難である」という状況を踏まえた拡大修正案です。
また(2)の企業要件については、「上位5%未満」という加算を満額取得できる企業の要件が「厳しすぎる」との指摘を踏まえ、「上位25%程度」に拡大する修正案が提示されました。ただし、診療側の松本純一委員(日本医師会常任理事)や今村聡委員(日本医師会副会長)から「曖昧ではないか。仮に25%のラインに多くの企業が乗った場合には、満額の加算を取得できる企業が多くなる可能性がある」との強い指摘が出され、「上位25パーセンタイルの同点企業を含むが、一定の上限を設ける」と再修正することになりました。具体的な記載ぶりは近く示される「骨子案」を待つ必要があります。
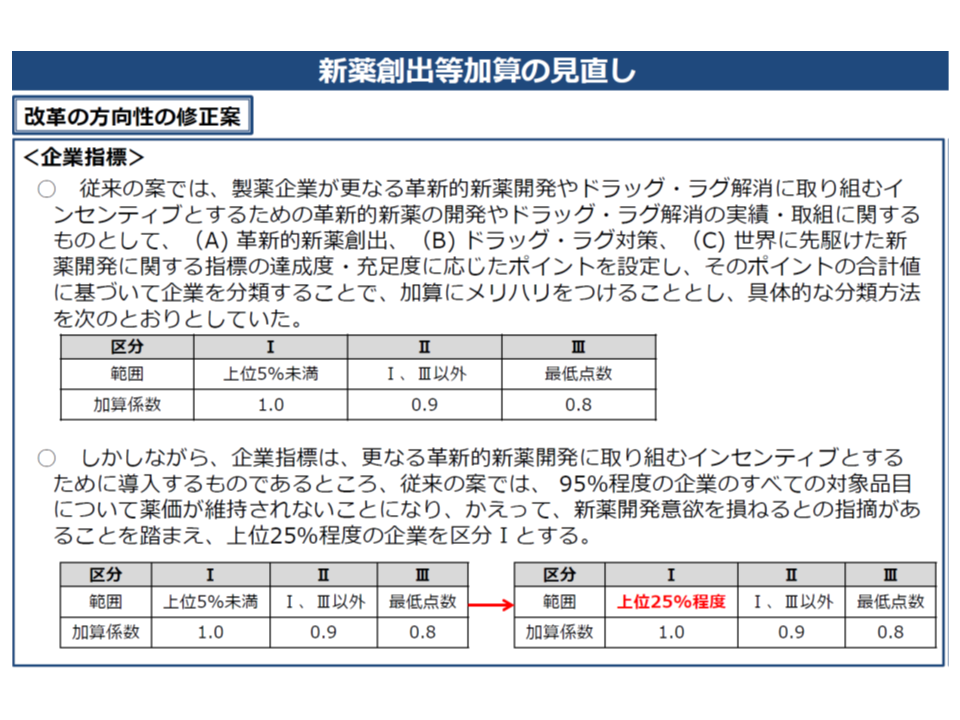
新薬創出等加算の見直し案における「企業要件」について、一定の緩和を行う(当初案では上位5%未満のメーカー製品のみが加算を満額取得できるが、見直し案では上位25%程度までのメーカー製品が加算を満額取得できる)
なお、この「上位25%」などの基準値は、まったくの新規で設定されるため、メーカー側にどれほどの影響が出るのかは把握しきれません。このため、運用状況を踏まえながら、2020年度、22年度と適宜、見直しが必要かどうか検証されることになります。支払側の幸野庄司委員(健康保険組合連合会理事)はこの点を強く求めています。
この新薬創出等加算の見直しは「対象品目の限定」が最大のポイントであり、厚労省保険局医療課の中山智紀薬剤管理官は、▼対象品目は2016年度には823品目であるが、厚労省の当初見直し案で約520品目に、今回の修正案でも約540品目に限定される▼対象企業は2016年度には90社であり、厚労省の当初見直し案では5%未満の4社程度、修正案では25%の15-20社程度に限定される—と見通しています。
さらに、厚労省は当初、「新薬創出等加算の対象以外」の品目を比較薬として、類似薬効比較方式で薬価を算定した製品については、「新薬創出等加算相当分を控除」して薬価を算定する、との考えを示していました。
しかし、類似薬効比較方式の中でも、新規性のある「類似薬効比較方式I」に該当する製品などでは、開発リスクを負うメーカーへの影響なども考慮する必要があることや、「一度薬価収載された後に、希少疾病用医薬品に指定されるなどして、新薬創出等加算の対象になる可能性もある」ことなどを踏まえ、次のように分けて考える修正案が新たに提示されました。
▼新規性に乏しい「類似薬効比較方式II」に該当する製品では、当初案どおり、薬価の算定に当たって「新薬創出等加算相当分」を控除する(加算を除いた低い価格と同等に設定する、下図の緑のライン)
▼新規性のある「類似薬効比較方式I」に該当する製品などでは、現行どおり、薬価の算定に当たって「新薬創出等加算相当分」は控除しない(加算を含めた高い価格と同等に設定する、下図の青のライン)
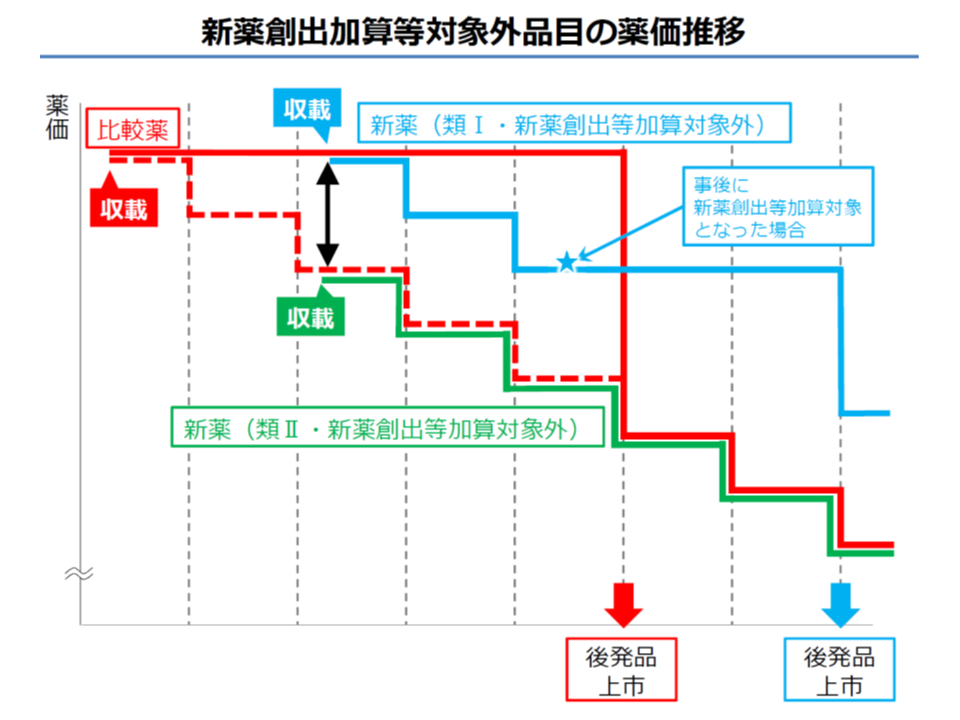
新薬創出等加算の対象外となる新薬について、類似薬効比較方式で薬価算定する際、新規性の乏しいもの(方式II)では新薬創出等加算を控除した薬価をベースにするが(緑色のライン)、新規性のあるもの(方式I)では新薬創出等加算を控除しない薬価全体をベースにする(青のライン)
中山薬剤管理官は、後者の「類似薬効比較方式I」の修正案について、2020年度の次々回薬価改定時までに、例えば「収載後に新薬創出等加算の対象になった場合の対応」などを踏まえて、見直しを検討する考えも併せて示しました。この点について支払側の幸野委員は「大きな方針変更である。今回の修正案は、次回改定で見直されることを明示すべき」と強く要請しています。
【関連記事】
新薬創出等加算の見直し、「容認できない」と製薬メーカー猛反発—中医協薬価専門部会
薬価制度抜本改革の具体案、費用対効果評価による価格引き上げも—中医協薬価専門部会
医療現場に必要不可欠な医薬品の価格下支え、対象拡大の方向―中医協・薬価専門部会
新薬の原価計算方式、診療・支払双方が改めて問題点指摘—中医協・薬価専門部会
医薬品の画期性・革新性、薬価にどう公平に反映させていくべきか—中医協・薬価専門部会
新薬創出等加算、「産業構造の転換」促すため対象企業要件を厳格化してはどうか—中医協・薬価専門部会
長期収載品から後発品への置き換え促進、新薬創出等加算などとセットで議論すべき—中医協・薬価専門部会
製薬メーカーが新薬創出等加算の継続を強く要望―中医協・薬価専門部会
後発品の薬価、現在3区分の価格帯をさらに集約していくべきか-中医協・薬価専門部会
原価計算方式における薬価算定、製薬メーカーの営業利益率などどう考えるか-中医協・薬価専門部会
薬価調査において、医療機関に対する価格調査は継続すべきか-中医協・薬価専門部会
中間年の薬価見直し、対象品目の基準(乖離率など)を事前に示しておくべきか―中医協・薬価専門部会
新薬の薬価設定で、比較対象薬(類似薬)に付加された補正加算をどう考えるべきか―中医協・薬価専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の外国平均価格調整、診療・支払両側から「米国価格は参照対象から除外すべき」との指摘―中医協・薬価専門部会
効能追加などで市場拡大した医薬品の薬価再算定、対象や引き下げ方法の議論開始―中医協薬価専門部会
薬価の毎年改定方針を決定、DPC点数表も毎年改定へ―厚労省
既存製品よりも費用が安く済み、効果の高い製品の価格は引き上げるべきか―費用対効果評価合同部会
医薬品などの費用対効果評価、業界は「加算のみへの反映」を切望—中医協・費用対効果評価合同部会
医薬品などの費用対効果評価、結果は加算のみに反映させるか、価格全体に及ぼすか—中医協・費用対効果評価関係
費用対効果評価、10月までに試行導入の詳細、年内に制度化の骨子を固める—中医協・費用対効果評価専門部会
費用対効果、試行導入には「支払い意思額調査」結果は用いず—中医協・費用対効果評価専門部会
費用対効果を判断するための「支払い意思額調査」、聞き方も含めて再検討—中医協・費用対効果評価専門部会
新医療技術の恩恵を受ける国民を対象に「いくらまで支払えるか」を調査—中医協・費用対効果専門部会
費用対効果評価の結果、どのタイミングで薬価などに反映させるか—中医協・費用対効果専門部会
費用対効果評価の結果、「保険償還価格の調整」に活用—中医協・費用対効果専門部会
医療技術の費用対効果評価、厚労省が仮想具体例で詳説—中医協・費用対効果評価専門部会
医療技術の費用対効果評価、「感染症対策への有用性」など6要素も勘案—中医協・費用対効果評価専門部会
医療技術の費用対効果、評価のための基準値を設定する方針に転換―中医協・費用対効果評価専門部会
費用対効果評価、新規収載の医薬品なども対象に2018年度から本格導入へ―費用対効果評価専門部会
2018年度の費用対効果評価に基づく再算定、オプジーボやハーボニーなど12品目に決定―中医協総会
2016年4月以降、費用対効果評価の対象として補正加算が高いものなど8品目程度を選定―中医協総会
費用対効果の良し悪しを判断する基準値、2016年度改定では定めず―費用対効果評価専門部会
費用対効果評価、対象は「保険収載後、1-2回の改定を経たもの」に―費用対効果評価専門部会
費用対効果評価、試行段階では社会的影響を評価する特別ルールは定めず―費用対効果評価専門部会
費用対効果評価の結果は医薬品・医療機器の再算定に活用―費用対効果評価専門部会
費用対効果評価はQALYを基本に実施、他の指標の使用も認める―中医協・専門部会
薬などの費用対効果、まず既収載品の再算定に活用、価格への反映は18年度改定時か―中医協・専門部会





