新薬創出等加算の見直し、「容認できない」と製薬メーカー猛反発—中医協薬価専門部会
2017.11.30.(木)
「薬価制度の抜本改革」案の中で、新薬創出・適応外薬解消等促進加算を大幅に改組し、企業要件・品目要件ともに厳格化した「革新的新薬創出等促進制度」が提案されているが、95%の製薬メーカーの製品では加算が減額されてしまう。これは製薬メーカー側の主張とかけ離れた提案で容認できない—。
11月29日に開催された中央社会保険医療協議会の薬価専門部会では、関係団体からこういった不満が噴出しました。外国の製薬団体からは「このままでは日本で新薬開発が行えなくなる」(外国で開発を進めることとなり、ドラッグラグが拡大してしまう)とのコメントも出ています。

11月29日に開催された、「第141回 中央社会保険医療協議会 薬価専門部会」
日本を「最初に新薬を導入する国」にできなくなる、とPhRMA
昨年(2016年)末に「薬価制度の抜本改革に向けた基本方針」(以下、基本方針)が、塩崎恭久前厚生労働大臣、麻生太郎財務大臣、菅義偉内閣官房長官、石原伸晃前内閣府特命担当大臣の4大臣会合で固められ、これをベースとした改革の具体案(以下、骨子案)が11月22日の薬価専門部会で厚労省から提示されました。
11月29日の薬価専門部会では、これに対する関係団体からの意見聴取が行われています。
製薬関係団体からは、「基礎的医薬品の拡充」や「原価計算方式における薬価全体への加算」などを歓迎する意見が出たものの、全体的に骨子案に対して厳しい指摘が行われました。とくに「新薬創出・適応外薬解消等促進加算」(以下、新薬創出等加算)の見直しについては、極めて明確に「受け入れられない」との強い反論が出ています。
新薬創出等加算の見直しポイントは「対象の選択基準の厳格化」です。加算の対象を選別するために(1)企業要件(2)品目要件—の2要件が設定されており、現在は、「厚労省からの医薬品開発要請などに応じる」企業(企業要件)が製造する「薬価と市場実勢価格の乖離率が、全品目の平均以下である」製品(品目要件)が対象ですが、中医協では「限定すべき」との指摘がありました。
そこで骨子案では、まず(2)の品目要件について、▼新規作用機序により既存治療で効果不十分な疾患への有効性がある▼新規作用機序により既存治療よりも優れている—ものなどに限定。さらに、(1)の企業要件については、▼新薬の収載実績▼開発要請への対応実績―などをポイント化し、ポイント合計が「上位5%」以下のメーカーが製造する製品については、(2)の品目要件を満たしていても「加算の減額」が行われます(最下位メーカーの製品は加算を80%に減額、それ以外の「上位5%」以下のメーカーの製品は加算を90%に減額)。
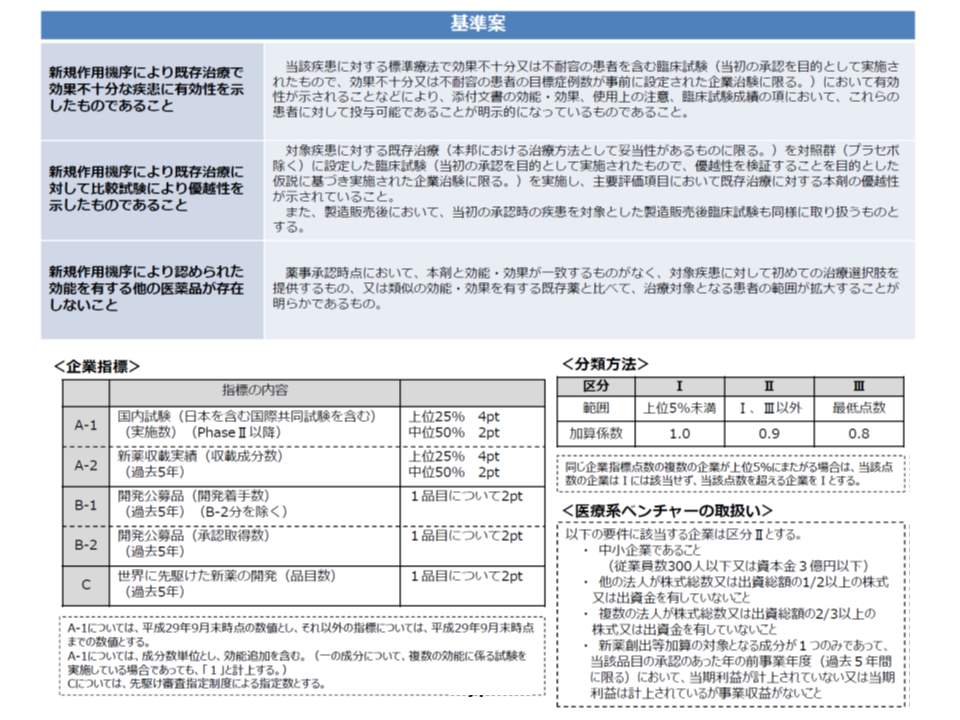
現行の新薬創出・適応外薬解消等促進加算に比べて、企業要件(図下段)、品目要件(図上段)ともに厳格化される
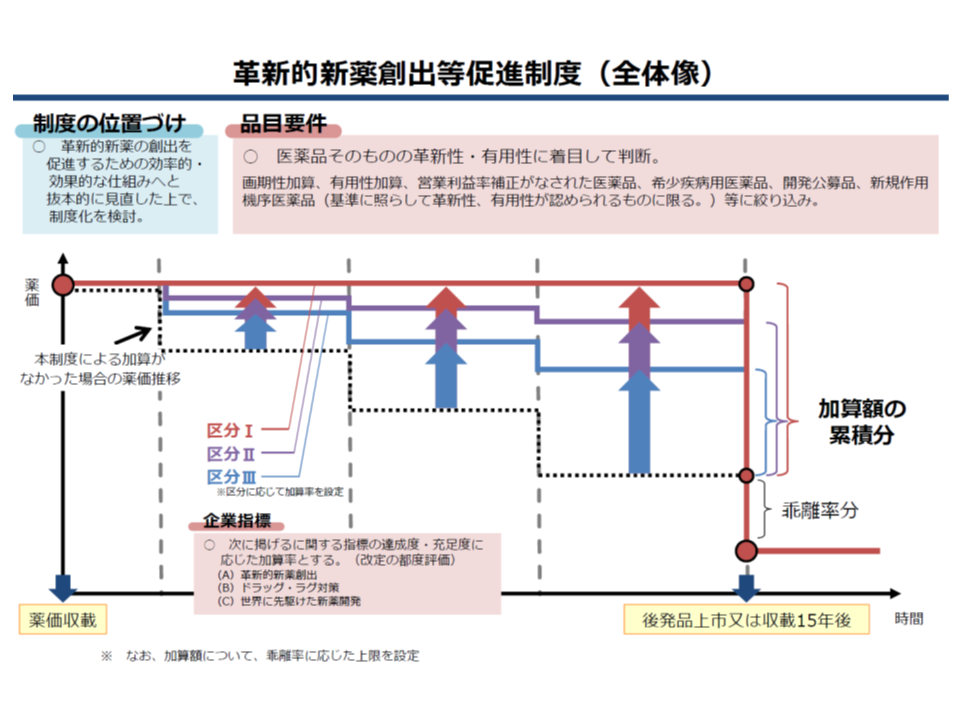
革新的新薬創出等促進制度の全体像
この考え方に対して製薬関係団体は、こぞって「上位5%以外、つまり全体の95%のメーカーでは満額の加算を取得できない」と強く反発し、「到底容認できない」と訴えています。もっとも、単なる反発にとどまらず、「少なくとも区分I(加算を満額取得できる)に該当するメーカーの範囲を拡大すべき」との提案も行っています。
なお、米国の先発品メーカー団体である米国研究製薬工業協会(PhRMA)は「日本では開発費用が割高になる。新薬創出等加算の見直しがこのまま行われれば、日本を『新薬の最初の導入国』にすることが不可能になる」とコメント。このコメントからは、諸外国で新薬を最初に導入することになり、日本に導入するまでに一定の時間がかかる、つまり「ドラッグラグ」が拡大する可能性が示唆されます。新薬創出等加算は、導入当時(2010年)に大きな問題となっていたドラッグラグ(外国で承認されている医薬品が、我が国で承認されていないなど)を解消するために設けられた仕組みです。特許期間中の医薬品価格を下支えし、その収益を原資に製薬メーカーが新薬開発に積極的に取り組むことが期待され、事実、効果も上がっています。このPhRMAのコメントが、今後の議論にどう影響するのか注目が集まります。
長期収載品から後発品へのシフト方向は理解するが、十分な経過措置を
また、厚生労働省は「長期収載品から後発品への置き換え」を強力に進める、次のような見直し案も提案しています。
▼後発品が出現してから5年後から、後発品への置き換え率に応じた引き下げ(Z2ルール)を行う
▼Z2適用から5年後に、後発品への置き換え率に着目した次の新ルールを適用する
▽後発品置き換え率が80%以上の品目については「後発品価格の2.5倍」とし、その2年後に「同2倍」、4年後に「同1.5倍」と段階的に引き下げ、6年後に「後発品と同価格」とする(G1ルール、これらについてはメーカーに市場からの「撤退」を認める)
▽後発品置き換え率が80%未満の品目(いわば後発品への置き換えが難しい品目)については「後発品価格の2.5倍」とし、その後、2年ごとに「同2.3倍」「同2.1倍」「同1.9倍」「同1.7倍」「同1.5倍」と段階的に引き下げていく(G2ルール)。ただし途中で後発品置き換え率が80%以上になれば、G1ルールへ移行する
▽すでに後発品価格の2.5倍未満となっている長期収載品やバイオ医薬品などは、Z2と同様に「後発品置き換え率」に着目した価格引き下げを継続する(Cルール)
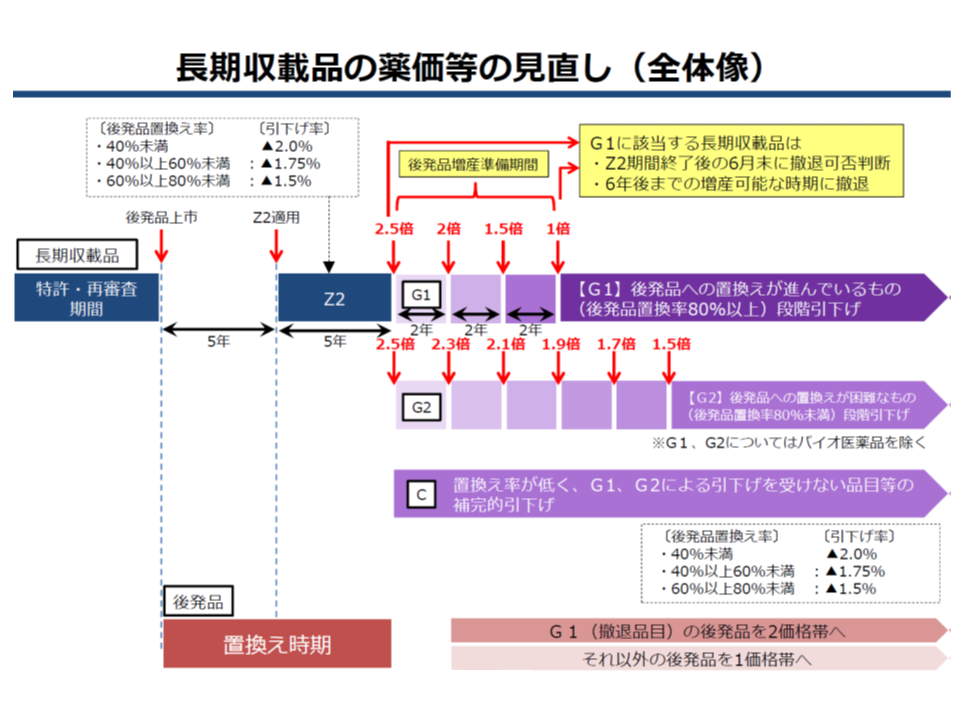
長期収載品から後発品への置き換えを強力に進める新ルール(G1、G2)を導入する
製薬メーカー団体は「長期収載品に依存した経営」モデルから「新薬開発」モデルへの転換方針に異論はないとしながら、「長期収載品の価格が後発品価格を基準に設定されることとなる。しかし長期収載品の状況・背景は異なるため、医薬品安定供給などの観点から一定の品目は除外すべきである」「十分な激変緩和措置を設けるべきである」といった注文を付けています。
費用対効果評価、引き下げ率の縮小などを求める声も
さらに、医薬品価格設定の新たな評価軸となる「費用対効果評価」については、日本製薬団体連合会から▼引き下げ率(見直し案では最大90%)の縮小▼価格全体の引き上げ率の上限設定―と言った注文がなされたほか、PhRMAからは「費用対効果評価を導入した国では、イノベーションが阻害され、必要な医薬品へのアクセス遅延が生じ、患者が不利益を被っている」との指摘が行われました。

費用対効果評価の価格調整対象は、加算部分(類似薬効比較方式)のみとし、最大で90%の価格引き下げ(加算部分)が行われる
薬価専門部会では、改定の都度に関係団体から意見聴取を行いますが、今回は「非常に厳しい反対意見が相次いだ」「意見陳述時間が通常よりもはるかに長かった」という特徴があり、医薬品関連団体が骨子案に強い危機感を抱いていることが伺えます。とくに、外国の製薬メーカー団体(PhRMAや、欧州製薬団体連合会:EFPIA Japan)からは「製薬市場として、我が国の魅力(国民皆保険制度があり、さらに3割負担上限や高額療養費制度などが設けられ、1億人超が超高額な医薬品にアクセスできる機会が保障されている)が減少する」点が極めて強く訴えられました。こうした意見を踏まえて、薬価制度の抜本改革案がどう修正されるのか(あるいはされないのか)、今後の議論を注視する必要があります。
【関連記事】
薬価制度抜本改革の具体案、費用対効果評価による価格引き上げも—中医協薬価専門部会
医療現場に必要不可欠な医薬品の価格下支え、対象拡大の方向―中医協・薬価専門部会
新薬の原価計算方式、診療・支払双方が改めて問題点指摘—中医協・薬価専門部会
医薬品の画期性・革新性、薬価にどう公平に反映させていくべきか—中医協・薬価専門部会
新薬創出等加算、「産業構造の転換」促すため対象企業要件を厳格化してはどうか—中医協・薬価専門部会
長期収載品から後発品への置き換え促進、新薬創出等加算などとセットで議論すべき—中医協・薬価専門部会
製薬メーカーが新薬創出等加算の継続を強く要望―中医協・薬価専門部会
後発品の薬価、現在3区分の価格帯をさらに集約していくべきか-中医協・薬価専門部会
原価計算方式における薬価算定、製薬メーカーの営業利益率などどう考えるか-中医協・薬価専門部会
薬価調査において、医療機関に対する価格調査は継続すべきか-中医協・薬価専門部会
中間年の薬価見直し、対象品目の基準(乖離率など)を事前に示しておくべきか―中医協・薬価専門部会
新薬の薬価設定で、比較対象薬(類似薬)に付加された補正加算をどう考えるべきか―中医協・薬価専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の外国平均価格調整、診療・支払両側から「米国価格は参照対象から除外すべき」との指摘―中医協・薬価専門部会
効能追加などで市場拡大した医薬品の薬価再算定、対象や引き下げ方法の議論開始―中医協薬価専門部会
薬価の毎年改定方針を決定、DPC点数表も毎年改定へ―厚労省
既存製品よりも費用が安く済み、効果の高い製品の価格は引き上げるべきか―費用対効果評価合同部会
医薬品などの費用対効果評価、業界は「加算のみへの反映」を切望—中医協・費用対効果評価合同部会
医薬品などの費用対効果評価、結果は加算のみに反映させるか、価格全体に及ぼすか—中医協・費用対効果評価関係
費用対効果評価、10月までに試行導入の詳細、年内に制度化の骨子を固める—中医協・費用対効果評価専門部会
費用対効果、試行導入には「支払い意思額調査」結果は用いず—中医協・費用対効果評価専門部会
費用対効果を判断するための「支払い意思額調査」、聞き方も含めて再検討—中医協・費用対効果評価専門部会
新医療技術の恩恵を受ける国民を対象に「いくらまで支払えるか」を調査—中医協・費用対効果専門部会
費用対効果評価の結果、どのタイミングで薬価などに反映させるか—中医協・費用対効果専門部会
費用対効果評価の結果、「保険償還価格の調整」に活用—中医協・費用対効果専門部会
医療技術の費用対効果評価、厚労省が仮想具体例で詳説—中医協・費用対効果評価専門部会
医療技術の費用対効果評価、「感染症対策への有用性」など6要素も勘案—中医協・費用対効果評価専門部会
医療技術の費用対効果、評価のための基準値を設定する方針に転換―中医協・費用対効果評価専門部会
費用対効果評価、新規収載の医薬品なども対象に2018年度から本格導入へ―費用対効果評価専門部会
2018年度の費用対効果評価に基づく再算定、オプジーボやハーボニーなど12品目に決定―中医協総会
2016年4月以降、費用対効果評価の対象として補正加算が高いものなど8品目程度を選定―中医協総会
費用対効果の良し悪しを判断する基準値、2016年度改定では定めず―費用対効果評価専門部会
費用対効果評価、対象は「保険収載後、1-2回の改定を経たもの」に―費用対効果評価専門部会
費用対効果評価、試行段階では社会的影響を評価する特別ルールは定めず―費用対効果評価専門部会
費用対効果評価の結果は医薬品・医療機器の再算定に活用―費用対効果評価専門部会
費用対効果評価はQALYを基本に実施、他の指標の使用も認める―中医協・専門部会
薬などの費用対効果、まず既収載品の再算定に活用、価格への反映は18年度改定時か―中医協・専門部会





