市販後データ踏まえ医療材料の有用性等を再評価する「チャレンジ申請」、2020年度改定で拡大しては―中医協・材料専門部会
2019.7.31.(水)
2018年度の医療材料価格制度改革においては、市販後のデータを踏まえて医療材料の有用性等を再評価する機会を設ける「チャレンジ申請」制度が導入された。保険収載時には十分なデータ収集が難しい医療材料の特性を踏まえたものだが、2020年度の次期改定に向けて、このチャレンジ申請の対象を拡大してはどうか―。
7月24日に開催された中央社会保険医療協議会の保険医療材料専門部会(以下、材料専門部会)で、こういった議論が行われました。

7月24日に開催された、「第100回 中央社会保険医療協議会 保険医療材料専門部会」
保険医療材料専門組織から、2020年度改定に向けた意見聴取
2020年度の材料価格制度改革に向けて、これまでに材料専門部会では▼2018年度の材料価格制度改革骨子で「今後、検討する」とされた事項▼これまでに問題提起されている事項▼保険医療材料等専門組織から提起された事項▼関係業界から提起された事項―を踏まえて、2020年度の材料価格制度改革の「論点」を8月(2019年8月)までに絞り込み、9月(2019年9月)以降に具体的な検討を行うという大きなスケジュールが示されました(関連記事はこちら)。
論点絞り込みのために、7月24日の材料専門部会では下部組織(保険医療材料専門組織、以下、専門組織)から意見を聴取。保険医療材料専門組織は、中医協が定めた材料価格算定基準に基づいて、個別具体的な製品の値決め等を行う組織です。今般、「値決め等」で直面する制度上の課題(改善点)について意見が示されたものです。
意見は多様ですが、次のような項目が注目されます。
まず「イノベーションの評価」について、2018年度改定では「新規収載時にこそ有用性等のエビデンスがないものの、使用実績を踏まえて有用性等エビデンスを構築でき、再評価を行うことが妥当」と認められた製品について「チャレンジ申請」を行うことが可能となりました。現在は区分C1(新機能)・区分C2(新機能・新技術)の製品のみですが、専門組織からは「区分B1(既存機能区分)・区分B2(既存機能区分・変更あり)製品についてもチャレンジ申請を可能としてはどうか、との提案がなされました(関連記事はこちら)。
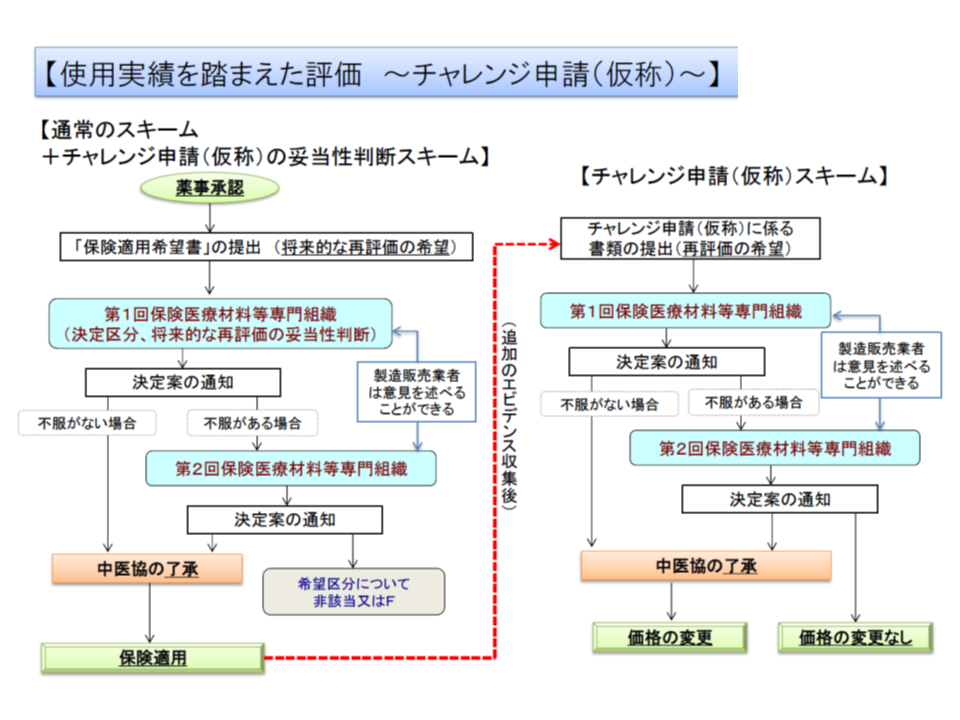
使用実績を踏まえて、保険収載後に、新機能区分の該当性を再度評価することを認める「チャレンジ申請」制度のイメージ
また、「原価計算方式」におけるイノベーション評価に関して、薬価制度抜本改革で導入された「イノベーションの評価における透明性を向上させるため、製品総原価のうち専門組織での開示が可能な部分の割合(開示度)に応じた加算率に差を設ける仕組み」の導入も提案しています。現在は、「営業利益」部分に対し革新性の程度に応じてマイナス50%からプラス100%の範囲内で補正を行っていますが、原価開示度の高い製品については、より高い加算(価格全体に加算)を取得できるようにしてはどうかとの提案です。
なお、「著しく単価の高い製品」については「補正加算率を傾斜配分する」提案も行われています。ヒトの細胞を用いた再生医療等製品などでは、大量生産ができないため著しく単価が高くなります。その場合、加算率が低くとも、補正加算「額」そのものが大きくなるため、医療保険財政に与える影響が甚大となります。この点を調整する必要があると専門組織は考えています。
さらに「再生医療等製品」に着目し、専門組織は、▼条件・期限付承認を受けた製品については、市販後のデータを活用して「チャレンジ申請」(有用性等のエビデンスに基づく再算定を可能とする)の対象とする▼改めて承認を受けるまでの間、「暫定価格」などと呼称する―ことを提案しています。
このほか、▼複数の遺伝子をまとめて測定できる医療機器の登場などを踏まえ、「複数遺伝子検査に係る運用」を検討する▼内外価格差のさらなる是正に向けて、新規収載・既収載のいずれにおいても、現在の「外国価格平均の1.3倍を上回る場合に1.3倍の価格とする」との比較水準を引き下げる▼適応追加などで市場が著しく拡大した場合の再算定ルールを検討する▼「医薬品の適応判定を目的として対応する遺伝子変異を検出するための遺伝子変異解析プログラム」などについて、保険適用時期が医薬品とずれないような特例を設ける―ことなども専門組織から提案されました。
こうした提案内容、とくに「チャレンジ申請の拡大」などについて、中医協診療側の城守国斗委員(日本医師会常任理事)らは賛意を示しており、2020年度に対象製品の拡大が予想されます。
一方、支払側の幸野庄司委員(健康保険組合連合会理事)は、提案内容のうち「原価計算方式におけるイノベーション評価の見直し」について、「医薬品でも原価開示を促進するために、開示度に応じた加算率設定を導入した。しかし、価格全体をベースに加算が行われるため、開示度が低くとも相当程度の加算がなされるようで、原価の開示が進んでいない。医薬品についても、このルールは見直すべきと考えており、材料価格への導入は極めて慎重に考えるべきである」との考えを述べています。
今後、関係団体からのヒアリングを行い、さらに具体的な議論を進めていくことになります。
【関連記事】
2020年度の薬価・材料価格制度改革に向けて、中医協で本格議論スタート―中医協、薬価・材料専門部会
薬価・材料価格制度の見直し案を決定、14成分の医薬品が市場拡大算定―中医協総会 第384回(2)
使用実績を踏まえ材料機能区分を再申請(チャレンジ申請)できる仕組み新設―中医協・材料専門部会
2018年度の材料価格改定、メーカー側は注文付けるも大枠は賛同―中医協・材料専門部会
保険医療材料価格の内外価格差是正に向け、外国価格調整を強化—中医協・材料専門部会
既存品目からの置き換えとなる改良医療機器、機能区分をどう考えるか―中医協・材料専門部会
材料価格制度、イノベーション評価推進や市場拡大再算定導入などを検討—中医協・材料専門部会
「医療ニーズが高い」との開発要請に応えない医療機器メーカーにペナルティなど与えるべきか—医療材料専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の毎年改定方針を決定、DPC点数表も毎年改定へ―厚労省
費用対効果評価、新規収載の医薬品なども対象に2018年度から本格導入へ―費用対効果評価専門部会





