使用実績を踏まえ材料機能区分を再申請(チャレンジ申請)できる仕組み新設―中医協・材料専門部会
2017.12.14.(木)
2018年度の保険医療材料価格制度改革に向け、12月13日に開催された中央社会保険医療協議会の保険医療材料専門部会(材料専門部会)で骨子案が了承されました。
▼イノベーションの評価▼費用対効果評価の導入▼外国平均価格調整の見直し―などが柱であり、イノベーションの評価では「保険収載後、長期間の使用実績を踏まえなければ有用性の確認が難しい」製品について、新たな機能区分を申請できる(つまり高価格を設定することが可能になる)仕組み(チャレンジ申請、仮称)が創設されます。

12月13日に開催された、「第90回 中央社会保険医療協議会 保険医療材料専門部会」
既収載の医療材料も、2年間に限り「チャレンジ申請」可能
材料価格制度改革の骨子案には膨大な新設・見直し項目が含まれています。ポイントを絞って眺めてみましょう。
まず「イノベーションの評価」として、冒頭に述べた「チャレンジ申請」制度の創設が目を引きます。保険医療材料の中には、「長期間、体内に埋め込む」ことが想定され、数年から十数年経って初めて「有用性」が確認できる、といった製品もあります。通常、保険収載時に有用性があると判断されれば、例えば新規機能区分を設定するなどして「高く評価」されますが、こうした製品では、その時点で有用性が十分に判断できないため、結果として従来の機能区分となり「低い評価」にとどまっていました。

使用開始より数年から数十年経たなければ、有用性をきちんと評価できない医療機器もある(その1)
材料専門部会は、こうした「長期間の使用実績を踏まえて有用性を確認できる」製品についても正しく評価できるよう、「製品導入時には評価できなかった部分について、使用実績を踏まえて、保険収載後に新規機能区分の該当性について再度評価を行うことができる」仕組み(チャレンジ申請、仮称)の創設を了承しました。新規に保険収載される際に、「将来的な再評価の希望」があり、保険医療材料専門組織(中医協の下部組織)で「将来的な再評価が妥当である」と判断されることが必要です。なお、すでに保険収載されている(2017年度までに収載)製品の中にも、こうした特性を持つものがあると考えられ、「2年間に限り、チャレンジ申請を行える」仕組みも用意されます(関連記事はこちら)。
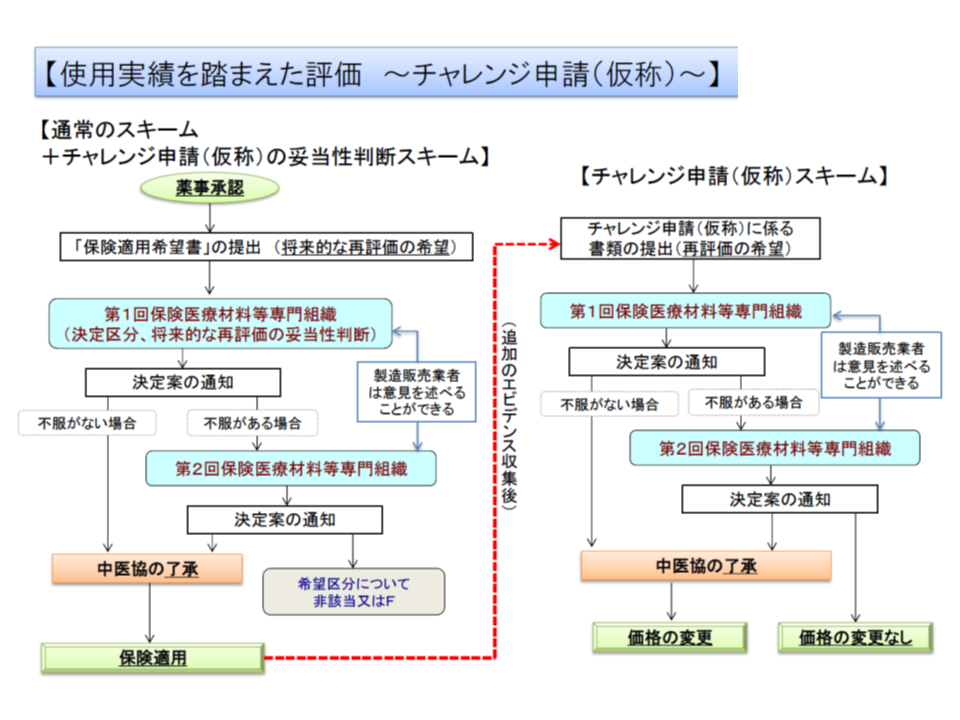
使用実績を踏まえて、保険収載後に、新機能区分の該当性を再度評価することを認める「チャレンジ申請」制度のイメージ
このほか、イノベーション評価については、次のような新設・見直しが行われます。
▼「先駆け審査指定制度」に指定されたC1(新機能)・C2(新機能・新技術)製品については、機能区分の特例対象とする(革新性の高い新規の医療機器については、2回の改定を経るまで、同様の機能を持つ他の製品と区別して、価格改定・再算定を行う仕組み。後続品出現による償還価格の下落を一定程度免れることが可能)(関連記事はこちら)
▼既存機能区分の既収載品と置き換わり得る製品について、同一機能区分としつつ、収載から2回の改定を経るまで時限的な加算を新設する(関連記事はこちら)
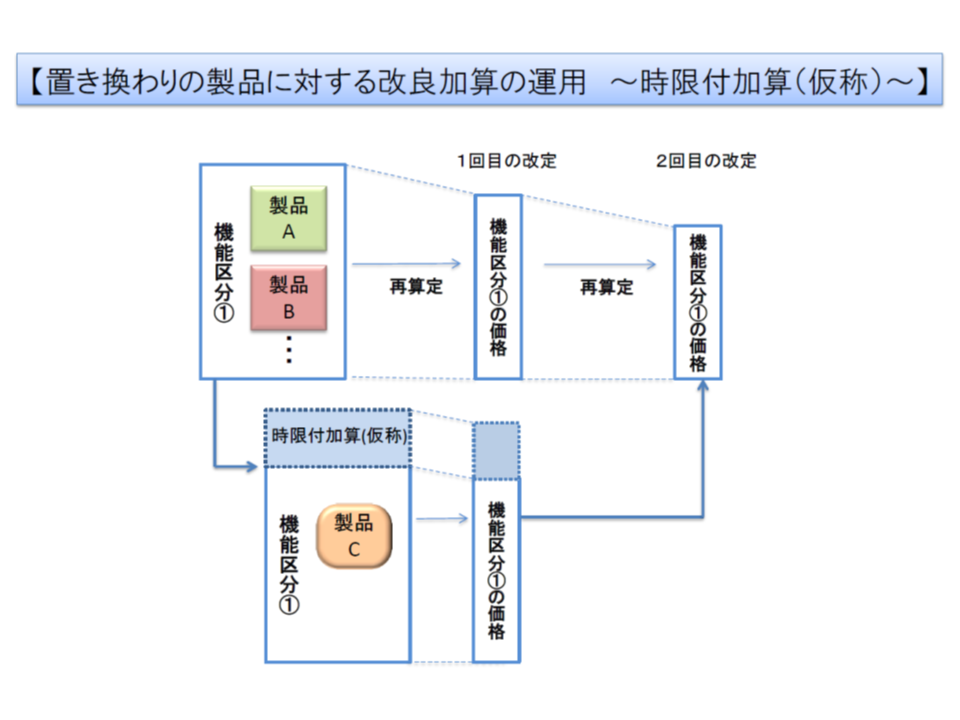
置き換わり製品について、同一機能区分としたままで「時限付き加算」を設定するイメージ
▼複雑な製品が保険適用後に、より単純化した製品が開発された場合には「既存製品の機能区分から減額する仕組み」を新設する
▼「迅速な保険導入に係る評価」の試行を継続するが、要件である「審査期間のうちの申請者側の期間」を、実績を踏まえて▽新医療機器の優先品目90日以内(現在は150日以内)▽新医療機器の通常品目180日以内(同240日以内)▽改良医療機器の臨床あり105日以内(同150日以内)—に短縮する
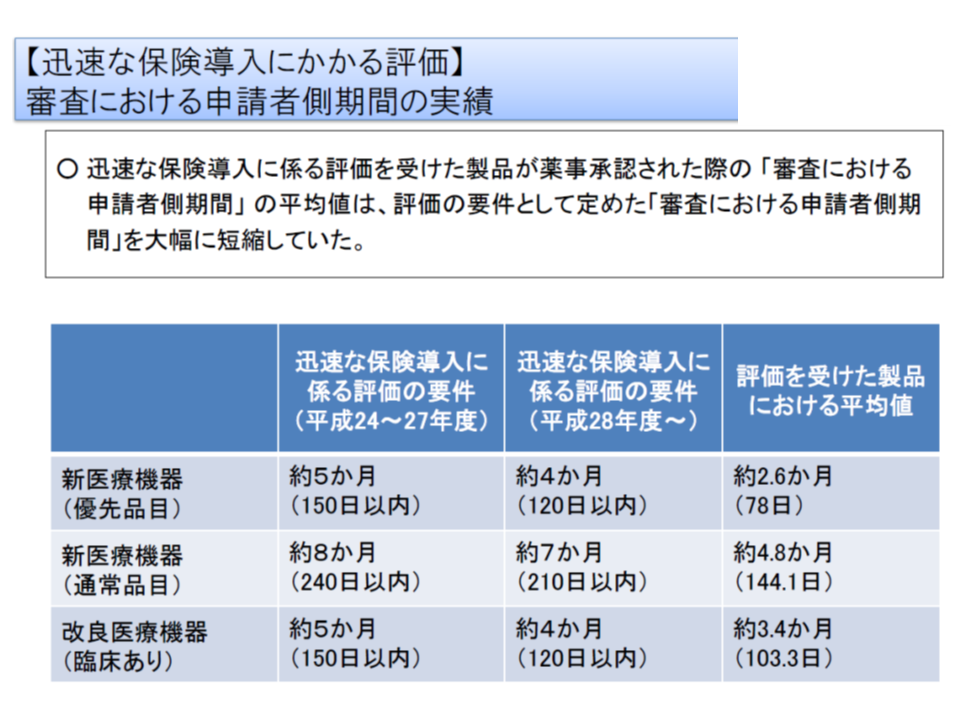
迅速な保険導入に係る評価を受けるための要件として、「審査機関における申請者(メーカー)側期間が一定以内である」ことがあるが、今般、実績を踏まえてこの要件が厳格化される
費用対効果評価を導入、価格引き上げの可能性も
まったく新たな仕組みとして「費用対効果評価に基づく価格調整」ルールが導入されます。類似機能区分比較方式や原価計算方式などを経て、さらに有用性などを踏まえた加算設定などの後に、最終的な価格調整として「費用対効果評価」が行われます。
専らICER(増分費用効果比)という指標を用いて、加算部分を対象に価格調整(引き下げ)をするものです(原価計算方式では価格全体が対象になるが、営業利益本体・製品総原価・流通経費合計を下限とする)。なお、「効果が増加し(あるいは同等)、費用が削減される」製品については、一定の価格引き上げも行われます。

費用対効果評価の価格調整対象は、加算部分(類似薬効比較方式)のみとし、最大で90%の価格引き下げ(加算部分)が行われる
外国平均価格調整ルールを一部厳格化
医療機器の内外価格差是正が、かねてから課題になっており、新規収載品・既収載品の双方で「外国平均価格調整」ルールが次のように見直されます(関連記事はこちら)。
【新規収載、直近2回の改定を通じて償還価格の下落率が15%以内の既収載品】
▼現在の【3倍ルール】を【2.5倍ルール】に厳格化する
→例えば、英国A円、ドイツB円という具合に「2か国以上で価格が設定」されており、そのうち英国A円が最高で、ドイツB円が最低の場合、英国A円がドイツB円の「2.5倍」超であるような場合には、英国A円を「除外」する
▼現在の【2倍ルール】を【1.8倍ルール】に厳格化する
→例えば、英国A円、ドイツB円、フランスC円と言う具合に「3か国以上で価格が設定」されており、そのうち英国A円が「ドイツB円とフランスC円の平均」の「1.8倍」超である場合には、英国A円を「ドイツB円+フランスC円の平均」×1.8と置き換える(見做す)
材料と体外診断薬の保険適用区分を見直し
このほか、重要なポイントして「保険適用区分の新設と、手続きの簡素化」も行われます。具体的には以下のようになります(関連記事はこちら)。
【保険医療材料】
▼区分A1(包括、不特定の診療報酬に包含される「縫合糸」など)・A2(特定包括、特定の診療報酬に包含される「眼内レンズと水晶体再建術」など)に加えて、「既存技術により評価される技術で、留意事項等の変更を伴うもの」としてA3(既存技術・変更あり)の区分を新設する
▼区分B(既存機能区分、「PTCAカテーテルなど)を細分化し、現在のBに該当するものをB1(既存機能区分、現在のBに該当)とし、「既存機能区分により評価される医療材料のうち定義等の変更を伴うもの」をB2(既存機能区分・変更あり)とする

ごくわずかな仕様変更で、メーカーが既存機能区分への収載を希望するが、機能区分の定義に合致せず、C1(新機能)として保険適用申請しなければならないケースがある
これにより保険医療材料の評価区分は、A1(包括)、A2(特定包括)、A3(既存技術・変更あり)、B1(既存機能区分)、B2(既存機能区分・変更あり)、C1(新機能)、C2(新機能・新技術)の7区分となります。
【体外診断用医薬品】
▼現在、▽E1(既存)▽E2(新方法)▽E3(新項目、改良項目)—と整理されているが、その「新規性」に基づいて区別することとし、新たな告示が必要なものをE3(新項目・改良項目)とし、既存項目により評価される検査技術で留意事項等の変更を伴うものをE2(既存項目・変更あり)と整理する

測定項目や方法に変更がないが、測定対象のみが拡大された場合でもE3(改良項目)として保険適用が必要となり、手続きが煩雑である
この見直しに合わせて、保険医療材料の区分A3(既存技術・変更あり)、B2(既存機能区分・変更あり)、体外診断用医薬品の区分E2(既存項目・変更あり)についても、従来の区分A2などと同様に、保険適用手続きの簡素化(中医協での了承を不要とする)が図られます。
【関連記事】
2018年度の材料価格改定、メーカー側は注文付けるも大枠は賛同―中医協・材料専門部会
保険医療材料価格の内外価格差是正に向け、外国価格調整を強化—中医協・材料専門部会
医療現場に必要不可欠な医薬品の価格下支え、対象拡大の方向―中医協・薬価専門部会
既存品目からの置き換えとなる改良医療機器、機能区分をどう考えるか―中医協・材料専門部会
材料価格制度、イノベーション評価推進や市場拡大再算定導入などを検討—中医協・材料専門部会
「医療ニーズが高い」との開発要請に応えない医療機器メーカーにペナルティなど与えるべきか—医療材料専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の毎年改定方針を決定、DPC点数表も毎年改定へ―厚労省
費用対効果評価、新規収載の医薬品なども対象に2018年度から本格導入へ―費用対効果評価専門部会





