「医療ニーズが高い」との開発要請に応えない医療機器メーカーにペナルティなど与えるべきか—医療材料専門部会
2017.4.13.(木)
「医療ニーズが高い」として開発要請がなされているにも関わらず、一定期間以上開発を行わない医療機器メーカーに対し、インセンティブとペナルティのどちらの側面からアプローチしていくべきか―。
12日に開催された中央社会保険医療協議会の保険医療材料専門部会では、こういった議論が行われました(関連記事はこちらとこちらとこちら)。厚生労働省からは材料価格制度の抜本改革に向け、「長期経過後に有用性を再評価できる仕組み」や「先駆け審査指定」された医療機器の評価について提案が行われています。
技術は確立しているが、採算などさまざまな事情で開発が後手に回るケースも
いわゆるデバイスラグ(海外では流通しているが、我が国では開発されていない医療機器)を解消するために、厚生労働省は「医療ニーズの高い医療機器等の早期導入に関する検討会」(ニーズ検討会)を設置し、学会などからの要望を踏まえて「医療ニーズの高い医療機器」の選定を行っています。
2016年度の前回材料価格制度改革においては、「医療ニーズの高い医療機器」として選定された品目について、▼機能区分特例の対象への追加▼外国価格調整における比較水準の緩和―などが行われました(関連記事はこちら)。いずれも「高い材料価格を維持できる」仕組みで、開発企業に対するインセンティブ付与を狙ったものです。
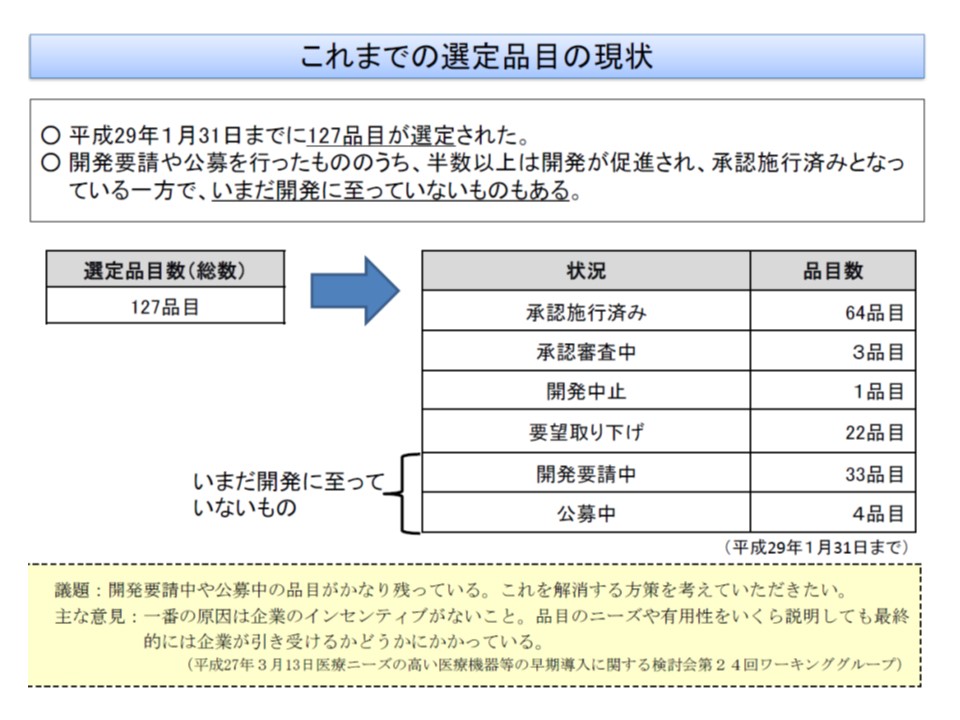
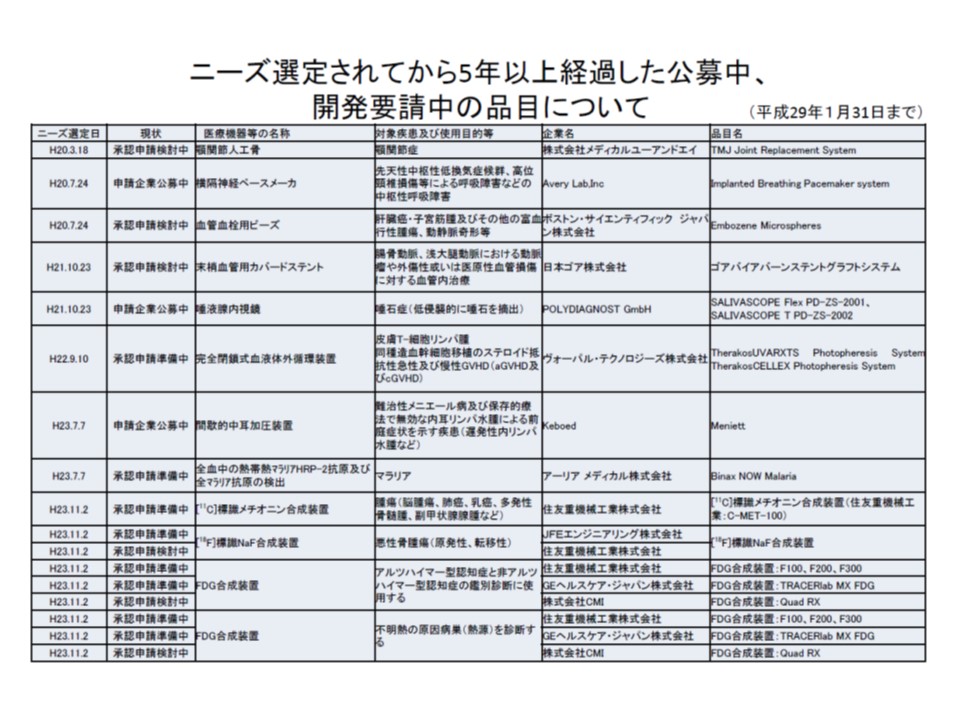
ところでニーズ検討会では、今年(2017年)1月までに127品目を「医療ニーズの高い医療機器」として選定しましたが、うち37品目は開発がなされていません。中には「横隔神経ペースメーカ」(2008年7月に選定)のように選定されてから長期間経過したにも関わらず、開発に手を上げる企業すら現れていないものもあります。
2016年度の前回改定では、こうした事態を打開するために厚労省が「開発要請を受けながら一定期間以上開発を進めない企業が申請する新規材料については、特にやむを得ない正当な理由がない限り、補正加算を認めない」などのペナルティを検討してはどうかと提案しましたが、支払側の幸野庄司委員(健康保険組合連合会理事)は「一律にペナルティをかけるのはいかがなものか。メーカーの規模や、開発に着手しない理由などをケースバイケースで判断すべきであろう」と慎重な姿勢を崩さず、「2018年度改定までの宿題」となっていました(関連記事はこちらとこちらとこちら)。12日の専門部会では、この宿題について議論を行っています。
厚労省医薬・生活衛生局医療機器審査管理課の磯部総一郎課長は、「医療ニーズが高いものの、販売量が少なく、また小規模メーカーであるため、どうしても開発が後回しになってしまう傾向があるようだ。『医療ニーズが高い医療機器』と選定されてから5年以上経過しているような品目については、既に欧米で承認されており、技術は確立しているが、『国内治験』『市販後調査』などの負担もある」と背景を説明し、どのような対応をとるべきかを議論してほしいと要望しました。
これを聞いた幸野委員は、「技術不足であればインセンティブ付与という選択肢もある。しかし、技術が確立しているにも関わらず、収支が合わないために開発しないのは、企業としての資質にも問題がある。インセンティブ付与は妥当ではなく、ペナルティの方向で考える必要があろう」とコメント。もっとも、品目ごと、メーカーごとにさまざまな事情があると推測されることから、厚労省保険局医療課の眞鍋馨企画官は「個々の事情も勘案し、より深堀した論点を示したい」との考えを示しました。
なお、前述した2016年度改定で創設された「インセンティブ」付与ですが、機器の開発・承認・保険収載までには時間がかかるため、まだ活用はなされていません。したがって2018年度の次期改定で、この「インセンティブ」付与の仕組みの妥当性などを検討するのは時期尚早でしょう。
有用性の評価に数年から数十年が必要な医療機器も
ところで、薬価と同様に、材料価格についても「抜本改革」を行うことが求められており、2月8日の前回会合で検討項目などが固められました。▼イノベーション評価▼費用対効果評価▼外国価格調整▼手続きの適正化―といった大項目と、それぞれに関する小項目で整理されています。材料部会では、これに沿って、順次「抜本改革」論議を進めていく考えです。
12日の部会では、このうちイノベーション評価の方法として(1)使用実績を踏まえた評価(2)先駆け審査指定制度に指定された製品—を議論しました(前述の「医療ニーズが高い医療機器」もこの一環)。
医療機器の中には、「数年から数十年経たなければ有用性をきちんと評価できない」製品があります。眞鍋企画官は▼吸収性冠動脈ステント(Asborb GT1 生体吸収性スキャフォールドシステム)▼生体弁(カーペンターエドワーズ牛心のう膜僧帽弁プラスTFX)―を例に挙げ、後者では「従来品は20年の長期臨床成績が2014年に発表されており、従来品と当該製品との有用性(当該製品は石灰化抑制処理がなされ、弁の機能不全や再手術が抑制される可能性がある)を比較するためには、同じく20年の期間が必要になる」ことなどが説明されました。
当然、承認時や保険収載申請時には、こうした「長期間経過して明らかになる有用性」のエビデンスがないため、材料価格に反映させることはできません。そこで眞鍋企画官は▼長期に体内に埋植する製品などでは、使用実績を踏まえて長期経過後に再評価できる仕組み▼製品導入時には評価できなかった部分について、使用実績を踏まえて、保険収載後に再度新機能区分の申請ができる運用―を検討してはどうかと提案しています。委員から反対意見は出ておらず、今後、具体的な仕組みの検討が行われます。
先駆け審査指定された医療機器、医薬品のように加算を付与すべきか
(2)の先駆け審査指定制度とは、「世界に先駆けて、革新的医薬品・医療機器・再生医療等製品を日本で早期に実用化すべく、世界に先駆けて開発され、早期の治験段階で著明な有効性が見込まれる医薬品などを指定し、各種支援による早期の実用化(例えば、医薬品・医療機器では通常の半分の6か月間で承認する)を目指す」仕組みで、2015年4月に創設されました。メーカーにさまざまなインセンティブを与え、優れた医薬品・医療機器が開発されることで、我が国の経済再興を狙っています。
医薬品では、この「先駆け審査指定」された品目について経済的なインセンティブ(先駆け審査指定制度加算)が設けられていますが、医療機器にはありません。また、小規模なベンチャー企業を支援する必要性もあり、眞鍋企画官は、「材料価格制度においても、『先駆け審査指定』された医療機器(再生医療等製品も含む)の評価」を検討してはどうかと提案しました。
診療側の万代恭嗣委員(日本病院会常任理事)はこの提案に賛同しましたが、支払側の平川則男委員(日本労働組合総連合会総合政策局長)は「なぜ評価すべきなのかが不明確である」と慎重な構えです。さらなる議論が待たれます。
なお、先駆け審査指定された医療機器としては、▼脊髄損傷に伴う神経症候・機能障害の改善に用いる「STR01」(自家骨髄由来幹細胞)▼食道がん手術後の広範囲創傷部位に移植する「口腔粘膜由来食道細胞シート」―などがあります。
【関連記事】
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の毎年改定方針を決定、DPC点数表も毎年改定へ―厚労省
費用対効果評価、新規収載の医薬品なども対象に2018年度から本格導入へ―費用対効果評価専門部会
2016年度材料価格制度改革の詳細が決定、医療ニーズの高い材料は機能区分特例に―中医協総会
2016年度の薬価・材料価格制度改革、イノベーション評価などの骨子を中医協総会が了承
2016年度材料価格制度改革、骨子案了承し年明けから細部調整―中医協・材料専門部会
医療材料への市場拡大再算定導入を見据え、16年度改定で下準備進める―中医協・材料専門部会
医療ニーズが高く開発公募がなされた医療機器、開発した企業は高く評価する―中医協・材料専門部会
オプジーボ、腎細胞がんと古典的ホジキンリンパ腫治療の最適使用推進ガイドライン—中医協(2)
複数医療機関による訪問診療を認めるべきか、患者の状態に応じた在宅医療の報酬をどう考えるか—中医協(1)
原価計算方式における薬価算定、製薬メーカーの営業利益率などどう考えるか—中医協・薬価専門部会