材料価格制度、イノベーション評価推進や市場拡大再算定導入などを検討—中医協・材料専門部会
2017.7.26.(水)
2018年度の材料価格制度改革に向けて、使用実績を踏まえた「製品導入時に評価できなかった部分を、保険収載後に再度、新機能区分の申請を認める」ことになどによってイノベーション評価を充実させると同時に、内外価格差の是正に向けた外国価格調整の基準値を現在の「1.3倍」から引き下げることや、市場拡大再算定ルールの導入などを検討してはどうか―。
26日に開催された中央社会保険医療協議会の保険医療材料専門部会では、下部組織である「保険医療材料等専門組織」の小澤壯治委員長(東海大学医学部消化器外科食道グループ教授)から、こういった提言が行われました。専門組織で材料価格設定を行う中で顕在化してきた問題点をベースにした提言で、メリハリの効いた内容となっており、今後の専門部会論議に注目が集まります。

7月26日に開催された、「第83回 中央社会保険医療協議会 保険医療材料専門部会l
目次
長期間使用後に効果が把握できるという、材料の特性踏まえた評価を
小澤委員長の提言は、(1)イノベーションの評価(2)技術に関する取り扱い(3)内外価格差の是正(4)その他―の4項目にわたります。
まず(1)のイノベーション評価では、薬価制度抜本改革の基本方針を踏まえて、すでに専門部会でも議論されている「材料の特性に照らした評価方法」を掲げています(関連記事はこちら)。医療材料の中には、「極めて長期間体内に埋め込むもの」(例えば植込み型人工心臓)などがありますが、これらが既存製品に比べてどれだけ革新性に富んでいるのかは、保険導入時には必ずしも十分に評価されず、「長期間経過後に明らかになる」ことも少なくありません。例えば、例示した人工心臓などでは、新製品が患者の予後に与えた影響を十分に評価するためには相当期間が必要なことからも理解できます。このため小澤委員長は「製品導入時には評価できなかった部分について、使用実績を踏まえて、保険収載後に再度新機能区分の申請ができる運用」について、改めて検討するよう専門部会に提言しています。
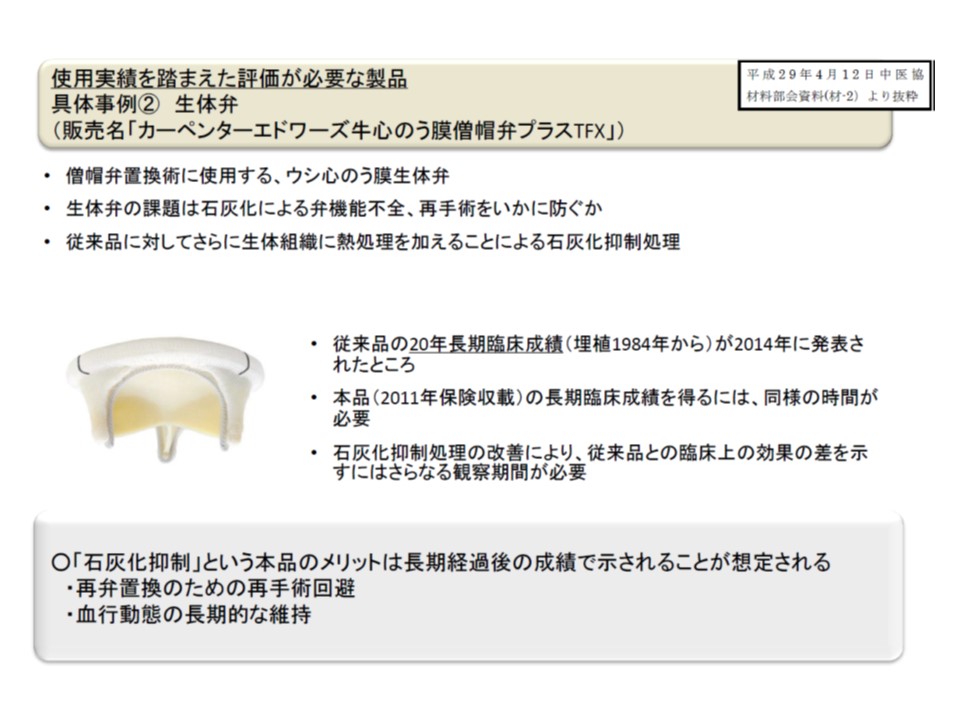
保険医療材料の中には、効果を十分把握できるまでに極めて長期間が必要なものが少なくない
機能区分別保険収載の趣旨に則った上で、改良・改善の評価を
また、既存製品Aを改良・改善した製品A1について、新規の機能区分を設定することがあります。特定保険医療材料は、医薬品と異なり「機能区分に応じて1つの価格を設定する」仕組みとなっているため、改良・改善によって「既存の機能区分では評価しきれない」場合には、新規の機能区部が設けられるのです。しかし小澤委員長は、「既存製品からの置き換わり」となるようなケースで新規機能区分創設を認めていたのでは、機能区分が極めて多くなり、本来の機能区分別保険収載制度の趣旨に反する(極論すれば、改良した製品ごとに機能区分が設定されれば事実上の銘柄別収載になってしまう)ため、「置き換わり」製品は既存の機能区分で保険収載すべきと提言しています。もっとも改良・改善を阻害してはいけないため、「機能区分制度としての役割を維持しつつ、改良・改善を評価しやすい仕組み」を検討していくことも求めています。
具体的な仕組みは、今後、専門部会で議論されることになりますが、万代恭嗣委員(日本病院会副会長)は「新規収載品が、既存製品と『置き換わる』かどうか予測し、アドオン的な仕組みの導入が好ましい」との見解を示しています。既存製品Aを改良した新製品A1の機能区分は、まず保険収載時に決まります。その際、Aに置き換わることが確実であれば「既存の機能区分とすべき」と小澤委員長は提案していますが、確実かどうかの判断は難しいため、前述の「保険収載後の機能区分申請」とも関連した柔軟な仕組みを検討するよう万代委員は求めているものと考えられます。
ところでイノベーションを評価する加算(画期性加算や有用性加算など)はありますが、既存製品の一部分を単純化したような場合の「減算」の仕組みはありません。この点、小澤委員長は「機能の一部を単純化・省略すれば、全体としては機能が減じられるので、それに沿った算定をすべきである」と述べ、「減算」制度の検討を要望しました。もっとも、医療安全確保のためなどに単純化を行うようなケースは、これらの対象外となる見込みです。
内外価格差の是正や市場拡大再算定導入に向けた検討を
保険医療材料についても、医薬品と同様に「内外価格差」の是正が図られており(上記の(3))、新規収載品・既収載品のいずれについても、諸外国(▼米国▼英国▼ドイツ▼フランス▼オーストラリア)の平均価格に比べて1.3倍を上回る場合には「1.3倍となる水準に引き下げる」というルールが設けられています(外国価格調整、2016年度の前回改定より前の1.5倍基準から厳格化)。小澤委員長はこの点、「必要な配慮」をしながら、さらなる「引き下げ」を検討するよう求めています。
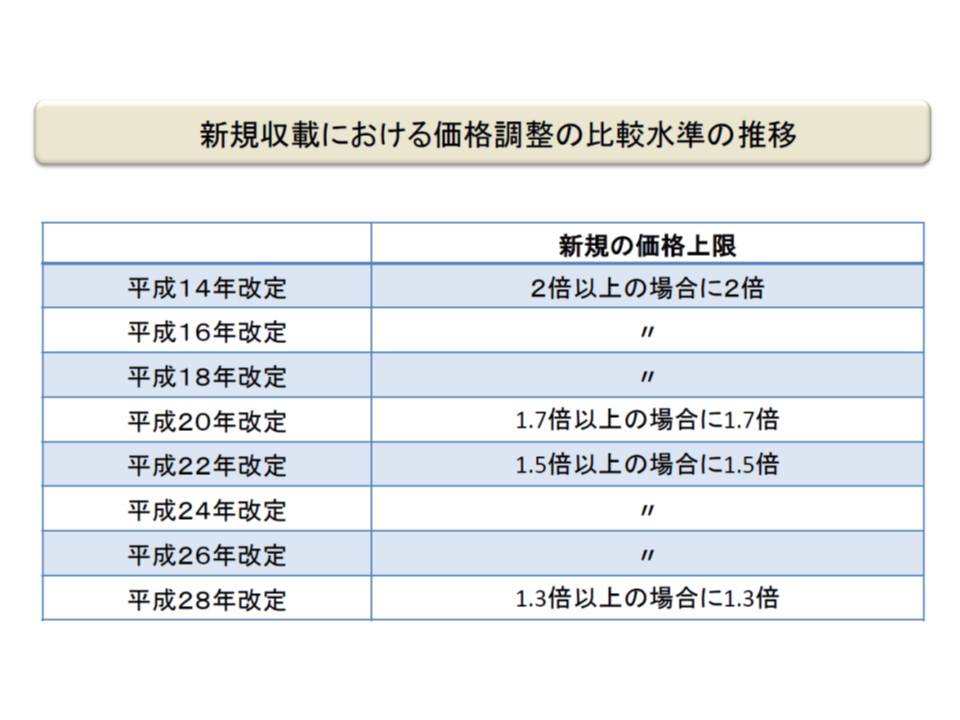
新規材料の外国価格調整の基準値の変遷
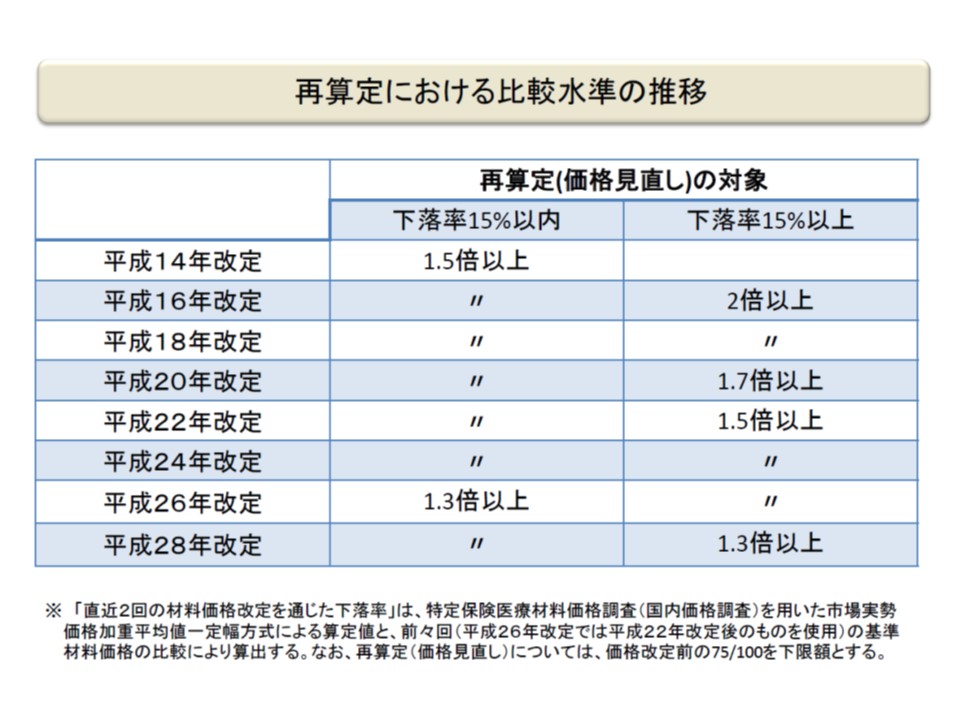
既存材料の外国価格調整の基準値の変遷
もっとも我が国では「諸外国に比べて人口当たりの医療機関数」が多く、各医療機関で多くの材料を備蓄しなければならないために、必然的に価格が高くなる(少数の医療機関に症例を集約し、材料をまとめて購入する場合、バイイングパワーが増し、価格は低下していく)という問題もあります。小澤委員長は「外国価格調整の基準値引き下げによって、医療保険財政や患者負担に好影響を与える」とコメントいていますが、こうした構造的な問題についても、将来検討が行われることになるかもしれません。
このほか、保険医療材料について▼離床実態を踏まえた、機能区分の細分化、合理化、定義の見直し▼適応追加などにより市場が著しく拡大した場合の方策(医薬品における市場拡大再算定のような仕組みの材料価格制度への拡大)―なども検討するよう、小澤委員長は提言しています。
複数のがん遺伝子検査を同時に実施する場合のルールを検討
また小澤委員長は、がんの遺伝子検査について「複数遺伝子検査に係る適切な運用」の検討も求めています。
医療技術・検査技術の進展により、同じがん(例えば肺がん)であっても、がん細胞の遺伝子によって「Aという抗がん剤では高いは効果が出る」が、「Bという抗がん剤では効果が期待できない」という知見が集積されてきています。このため、がん細胞の遺伝子を検査する技術が保険収載されており(D004-2『悪性腫瘍組織検査』)、今後も検査項目が増加してくと考えられます。オプジーボやキイトルーダの「適正使用推進ガイドライン」もこのがん細胞の遺伝子に着目したものです(関連記事はこちらとこちらとこちらとこちら)。
この点について小澤委員長は「同一がん種に対して、同時に複数項目の遺伝子検査を測定することが想定され、『複数遺伝子検査に係る適切な運用』を検討すべき」と提案しているのです。例えば「包括支払い」方式などが考えられますが、万代委員は「必要な検査が阻害されないようにすべき」と注文を付けています。
なお、がんの遺伝子検査については、近い将来、「医学的に意義がある複数の遺伝子検査(パネル検査)」の保険収載が予想され(検査結果に基づき最適な抗がん剤などを選択するゲノム医療の実現につながる)、その際には、また新たなルールが検討されることになるでしょう(関連記事はこちら)。
【関連記事】
「医療ニーズが高い」との開発要請に応えない医療機器メーカーにペナルティなど与えるべきか—医療材料専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の毎年改定方針を決定、DPC点数表も毎年改定へ―厚労省
費用対効果評価、新規収載の医薬品なども対象に2018年度から本格導入へ―費用対効果評価専門部会
2016年度材料価格制度改革の詳細が決定、医療ニーズの高い材料は機能区分特例に―中医協総会
2016年度の薬価・材料価格制度改革、イノベーション評価などの骨子を中医協総会が了承
2016年度材料価格制度改革、骨子案了承し年明けから細部調整―中医協・材料専門部会
医療材料への市場拡大再算定導入を見据え、16年度改定で下準備進める―中医協・材料専門部会
医療ニーズが高く開発公募がなされた医療機器、開発した企業は高く評価する―中医協・材料専門部会
肺生検困難な肺がん患者について、血漿による遺伝子検査を7月から保険収載―厚労省
肺がん患者に抗がん剤「クリゾチニブ」投与が有効か調べる遺伝子検査、6月から保険収載―厚労省
がんゲノム医療を提供できる中核病院を、本年度(2017年度)中に7-10施設指定—がんゲノム医療懇談会
オプジーボ、腎細胞がんと古典的ホジキンリンパ腫治療の最適使用推進ガイドライン—中医協(2)
オプジーボ、頭頸部がんに適応拡大、最適使用推進ガイドラインなどを新たに通知—厚労省
オプジーボとキイトルーダ、基準満たした施設で有効性の認められた患者に投与せよ―厚労省
オプジーボなどの適正使用推進GL固まる、留意事項通知を2月14日に発出―中医協総会(2)





