2020年度薬価制度改革を了承、類似薬効方式(I)で新薬創出等加算対象外の新薬は一定期間後に大幅薬価引き下げ―中医協総会(2)
2020.1.27.(月)
2020年度の次期薬価制度改革の内容が1月22日の中央社会保険医療協議会・薬価専門部会および総会で了承されました。
薬価制度改革の内容は以下のとおりで、2月上旬に厚労省保険局長通知として各都道府県知事らに発出されます。2018年度に「薬価制度の抜本改革」として非常に大きな制度改革が行われており、2020年度改革では「現行薬価制度の不合理を解消する」趣旨の非常に細かい見直しが目立ちます。優れた医薬品の開発を促すイノベーション評価を進めるとともに、長期収載品から後発医薬品への置き換えをさらに進める内容となっています。

1月22日に開催された、「第164回 中央社会保険医療協議会 薬価専門部会」
【新規収載医薬品の薬価算定】
▼3成分以上が含まれる「新医療⽤配合剤」について、単剤が薬価収載されていない成分を含むが当該成分および当該新医療⽤配合剤の他の成分を含む既存配合剤が薬価収載されている場合、当該既存配合剤を単剤と同様に取り扱い、「新医療⽤配合剤の特例」の対象とする
▼「再⽣医療等製品」を原価計算方式で算定する場合の流通経費について個々の品目毎に精査し、平均的な係数を用いて算出される額よりも低い場合はその額を用いて算定する。また補正加算率について、「補正加算前の価格が1000万円を超え、ピーク時市場規模(予測)が50億円を超える場合」には、傾斜配分する
▼「類似薬効比較方式(I)等で算定された新薬で、新薬創出・適応外薬解消等促進加算(以下、新薬創出等加算)の対象とならなかったもの」について、薬価収載から4年経過後の初めての薬価改定(収載後3回目の薬価改定)の際に、収載後の効能追加等により新薬創出等加算の対象となった場合を除いて、収載時点での比較薬の累積加算分を控除する(今後の状況を踏まえて、必要な措置を検討する)
▼「原価計算方式」で薬価算定し、ピーク時市場規模(予測)が50億円未満のバイオ医薬品について、研究開発費のみで⼀般管理販売費率の上限を超え、かつ原価の開⽰度が80%以上でその妥当性が確認できる場合には、⼀般管理販売費率の上限を70%に引き上げることとする
▼「バイオAG(先発品と有効成分、原薬、添加物、製法等が同一のバイオ医薬品で、後発品として薬事承認を受けたもの)の新規収載時の薬価」について、バイオ後続品(バイオシミラー)との適切な競争環境を維持すべき点を踏まえ、先発品薬価の70%とする。また、バイオAGが収載された場合、その先発品であるバイオ医薬品をG1・G2ルール(長期収載品から後発品への置き換えを流すための特別の薬価引き下げルール)の対象とする
【既収載医薬品の薬価改定】
▼長期収載品から後発品への置き換えを促すG1・G2ルールについて、「後発品上市後10年経過前でも、後発品への置換え率が80%以上となった⻑期収載品は、その2年後の薬価改定時に置換え率が80%以上となっていることを再度確認した上でG1ルールを前倒し適用する」「Z2およびCにおける置換え率の基準である40%未満・40%以上60%未満・60%以上80%未満の区分を、それぞれ50%未満・50%以上70%未満・70%以上80%未満」に引き上げる」「G1・G2・Cルールで大きな影響を受ける一定の品目・企業に対して円滑実施措置を⾏う」こととする
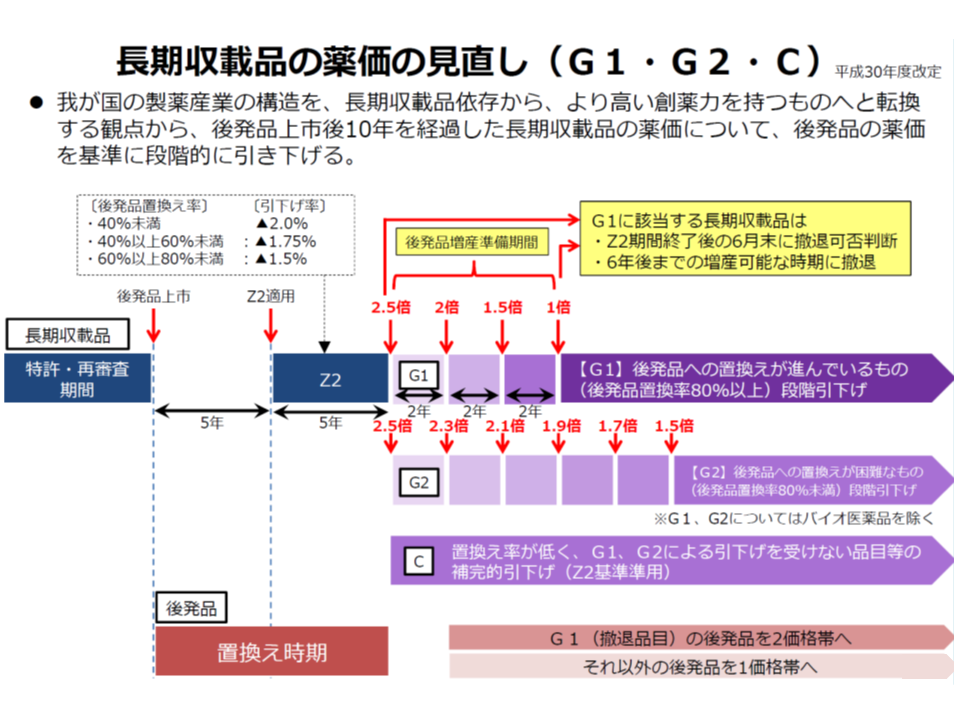
長期収載の価格引き下げルール(中医協 薬価専門部会2 191122)
▼後発品価格帯の集約で改定前より薬価が引き上がることを抑制するため、次のような対応を行う
・市場実勢価格に基づく算定値が、改定前価格帯より上の価格帯に相当する品目について、改定前薬価が「当該上の価格帯の加重平均値」を下回る場合は、改定前と同じ価格帯として算定する
・最高価格の30%以上50%未満の価格帯、および30%を下回る価格帯において、改定前薬価が「各価格帯の加重平均値」を下回る品目については、価格帯ごとに、該当全品目を改めて加重平均し、これを当該品目の改定後薬価とする
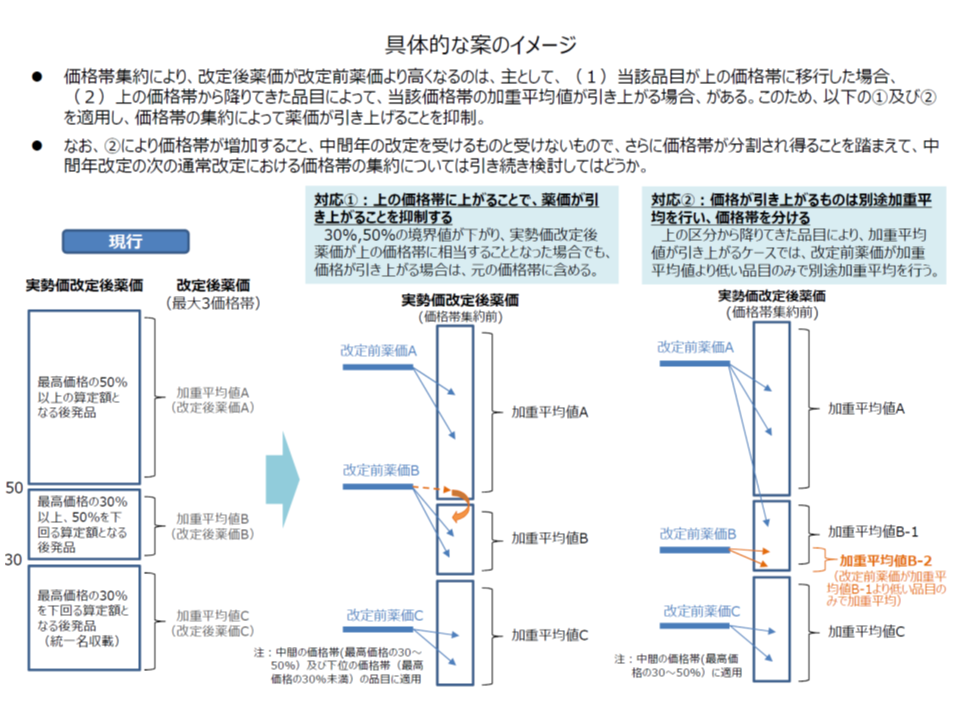
後発品の価格集約見直し案(中医協 薬価専門部会4 191122)
▼G1・G2に係る後発品は、市場から撤退する予定のG1に係る後発品のうち増産対応するものとそれ以外で価格帯を分けているが、後者について改定前より薬価が引き上がることを抑制するため、「改定前薬価が加重平均値を下回る品目については、該当全品目で改めて加重平均を⾏う」「改定前薬価が加重平均値以上の品目については、該当全品目で改めて加重平均を⾏う」こととし、それぞれ価格帯を集約する
▼新薬創出等加算について、次のような見直しを行う
●企業指標・企業要件
下表のとおりとする
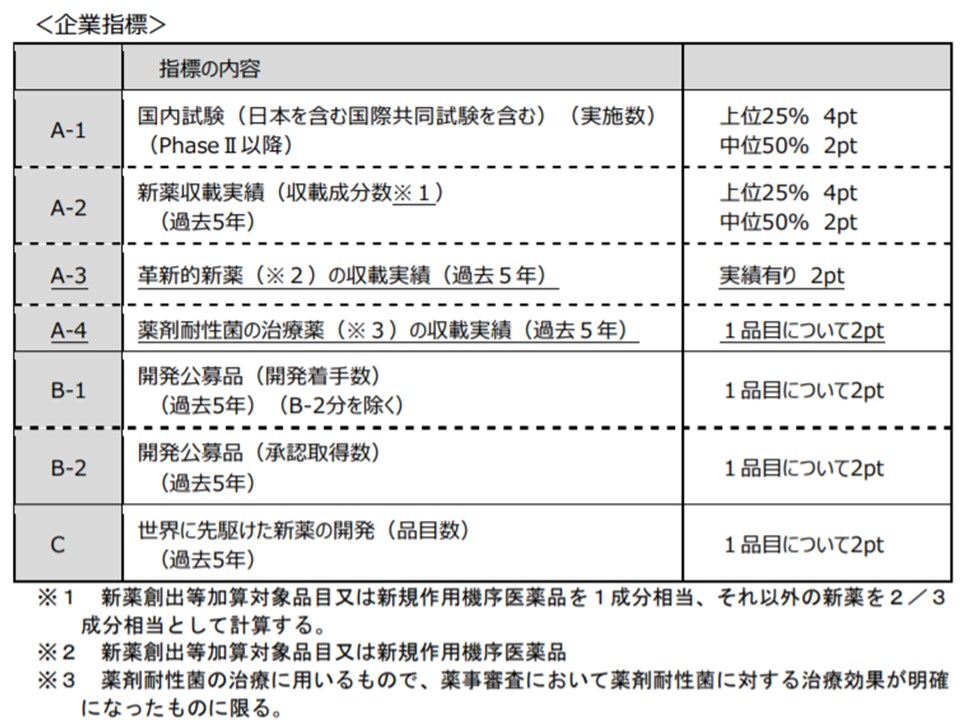
新薬創出等加算の企業要件・企業指標の見直し(中医協・薬価専門部会 200122)
●品目要件
2020年度改定以降に薬価収載・効能追加されたものについて、「先駆け審査指定制度の対象品目、薬剤耐性菌の治療薬を品目要件に追加する」「薬価収載後に効能追加等が⾏われたもののうち、追加された効能等において新規作用機序であって、新規作用機序医薬品の革新性・有用性に係る基準に該当するものを品目要件に追加する(既存の効能・効果の対象患者の限定を解除したもの等、既存効能と類似性が高い場合を除く)」こととする
▼薬価収載後の加算について、「小児効能等の追加に係る加算」「希少疾病等に係る効能等の追加に係る加算」と「真の臨床的有⽤性の検証に係る加算」とを併算定可能とする
▼「条件・期限付承認を受けた再⽣医療等製品」が、改めて承認を受けた際、初回承認時に明らかでなかった医療上の有用性が客観的に示された場合は、改めて補正加算の該当性について評価することとし、その際、現行収載後加算と同様に傾斜配分を行う
▼市場拡大再算定を受けた後に再び市場規模が拡大し、「改めて市場拡大再算定の対象となる品目」について、前回再算定時の市場規模拡大が下止めの水準を超過した程度を踏まえて、市場規模拡⼤率の値を調整した上で、改めての再算定における再算定後薬価を算出する。⽤法⽤量変化再算定(主たる効能・効果に係る効能変更等に伴い用法・⽤量に大幅な変更があったものに限る)を受けた品目についても同様に取り扱うことを明確化する
▼効能追加により主たる効能・効果の変更があった場合、変更後の主たる効能・効果に係る薬理作⽤類似薬がある場合はその価格に近づくよう効能変化再算定を⾏うが、さらに、薬理作⽤類似薬がない場合でも、「変更後の主たる効能・効果に係る参照薬(変更後の主たる効能・効果と同一・類似する効能・効果を有する既存薬のうち、治療上の位置づけ等が類似するもの)と比較して著しく1日薬価が高く、市場規模が著しく大きくなる」と考えられる場合は、当該参照薬の1日薬価を参照して、現⾏の効能変化再算定と同様の再算定を⾏う特例を設ける
・対象となる医薬品は▽1日薬価が参照薬の1日薬価の10倍以上▽変更後の効能・効果に係る参照薬の市場規模が150億円以上▽主たる効能・効果変更で対象患者数が最大10倍以上、また対象患者が最大5万人以上と認められる―のすべてを満たすものとし(ただし、変更後の主たる効能・効果が根治的治療法に該当するもの、生命に重大な影響のある重篤疾患、指定難病、血友病、抗HIVの効能を追加するものは除く)、市場拡⼤再算定と同様に、年間販売額が350億円を超える場合は、4半期再算定を行う
このうち新薬創出等加算の見直しでは、薬剤耐性菌対策の重要性が世界的にも高まっている状況を踏まえ、「耐性菌治療薬の開発を促す」ことを狙う内容が含まれています(品目要件において耐性菌治療薬を加算の対象とすることが明確化された)。
また類似薬効比較方式(I)で新薬創出等加算の対象となっていない品目については、支払側委員から「薬価収載の時点で、比較薬の薬価から『新薬創出等加算分』を除外せよ」(つまり、当初から低い価格を設定せよ)との強い指摘がありました(すでに新規性の乏しい新薬の薬価を算定する類似薬効比較方式(II)では、当初から加算分が除外されている)。しかし、支配側委員の主張を採用した場合、新薬の薬価は類似薬(比較薬)に比べて最大17%低く設定され、「類似した医薬品は同じ薬価(1日薬価)とし、市場での競争を促す」という類似薬効比較方式の根幹を大きく揺るがしてしまうこととなり、今般の仕組みが採用されるに至ったものです。2010-18年度に保険適用された新薬のうち54%は6年以内に「新薬創出等加算の対象」となっており、逆に言えば「46%は加算の対象外となっている」ことから、新ルールの導入で「半数程度の新薬は、3回後の薬価制度改革において、大幅に薬価が引き下げられる」ことになりそうです。
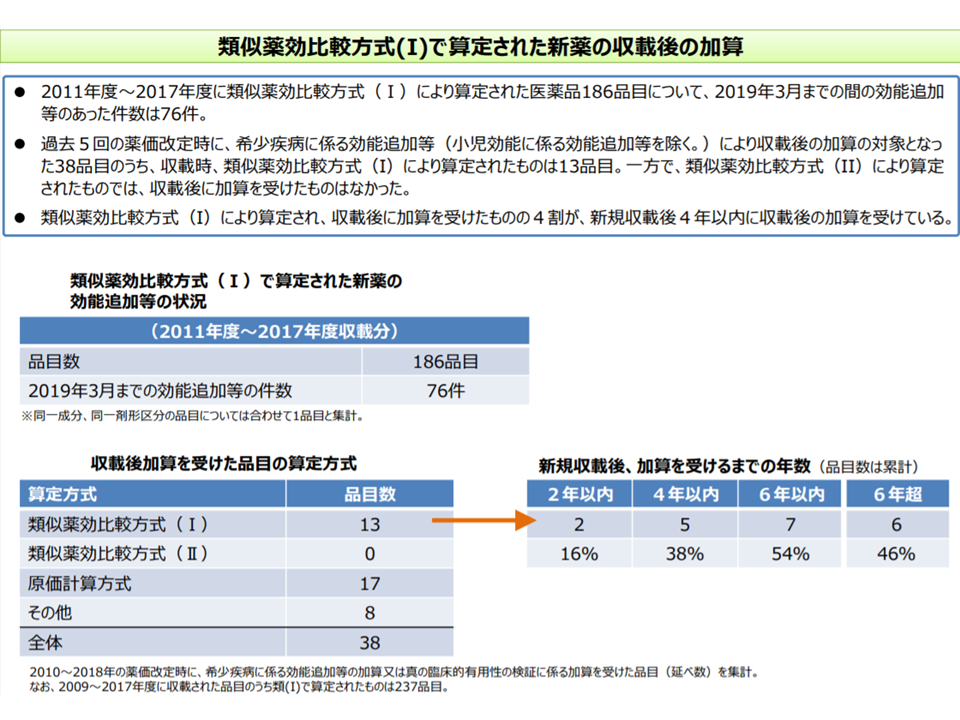
類似薬効比較方式(I)のうち54%が6年以内の新薬創出等加算の適用を受けている(中医協・薬価専門部会 190911)
【関連記事】
2020年度薬価制度改革に向けて論点整理、新薬創出等加算の企業・品目要件を一部見直しへ―中医協・薬価専門部会
市場拡大再算定や基礎的医薬品のルールを2020年度改定に向けてどう見直すべきか―中医協・薬価専門部会
先行バイオ医薬品と同一のバイオAG、苦渋の選択として「先行バイオ品の70%」とするしかない―中医協・薬価専門部会
再製造の単回使用医療機器(RSUD)、オリジナル品と別の機能区分とし、低い償還価格を―中医協、材料専門部会・薬価専門部会
長期収載品の段階的価格引き下げルール、2020年度改定で厳格化すべきか―中医協・薬価専門部会
再生医療等製品、独自の薬価算定ルールを設けるべきか―中医協・薬価専門部会
新薬の価値そのものに着目した評価を求めるメーカーに対し、中医協委員は「新薬開発の競争促進」も重要と指摘―中医協・薬価専門部会
2020年度の薬価・材料価格制度改革に向けて、中医協で本格議論スタート―中医協、薬価・材料専門部会
2020年度薬価制度改革、新薬創出等加算や後発品使用促進策などが重要テーマ―中医協・薬価専門部会
先行バイオ医薬品とまったく同一の「バイオセイム」登場、薬価の在り方など検討―中医協総会(2)
薬価制度抜本改革案を修正、新薬創出等加算の厳格化を一部緩和―中医協薬価専門部会
新薬創出等加算の見直し、「容認できない」と製薬メーカー猛反発—中医協薬価専門部会
薬価制度抜本改革の具体案、費用対効果評価による価格引き上げも—中医協薬価専門部会
医療現場に必要不可欠な医薬品の価格下支え、対象拡大の方向―中医協・薬価専門部会
新薬の原価計算方式、診療・支払双方が改めて問題点指摘—中医協・薬価専門部会
医薬品の画期性・革新性、薬価にどう公平に反映させていくべきか—中医協・薬価専門部会
新薬創出等加算、「産業構造の転換」促すため対象企業要件を厳格化してはどうか—中医協・薬価専門部会
長期収載品から後発品への置き換え促進、新薬創出等加算などとセットで議論すべき—中医協・薬価専門部会
製薬メーカーが新薬創出等加算の継続を強く要望―中医協・薬価専門部会
後発品の薬価、現在3区分の価格帯をさらに集約していくべきか-中医協・薬価専門部会
原価計算方式における薬価算定、製薬メーカーの営業利益率などどう考えるか-中医協・薬価専門部会
薬価調査において、医療機関に対する価格調査は継続すべきか-中医協・薬価専門部会
中間年の薬価見直し、対象品目の基準(乖離率など)を事前に示しておくべきか―中医協・薬価専門部会
新薬の薬価設定で、比較対象薬(類似薬)に付加された補正加算をどう考えるべきか―中医協・薬価専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の外国平均価格調整、診療・支払両側から「米国価格は参照対象から除外すべき」との指摘―中医協・薬価専門部会
効能追加などで市場拡大した医薬品の薬価再算定、対象や引き下げ方法の議論開始―中医協薬価専門部会
薬価の毎年改定方針を決定、DPC点数表も毎年改定へ―厚労省





