2020年度薬価制度改革に向けて論点整理、新薬創出等加算の企業・品目要件を一部見直しへ―中医協・薬価専門部会
2019.11.25.(月)
2020年度の次期薬価制度改革に向けて、中央社会保険医療協議会の薬価専門部会で「論点整理」が行われました。
これまでの薬価制度改革論議を踏まえて、「2020年度にどのような見直しを行うべきか」を詰めていきます。中医協委員からは、既に修正提案がいくつか出ており、今後の関係団体ヒアリング結果も見て、具体的な検討内容が年末に固められます。

11月22日に開催された、「第160回 中央社会保険医療協議会 薬価専門部会」
目次
新薬創出等加算、中小メーカーに不利とならないような仕組みに
厚生労働省保険局医療課の田宮憲一薬剤管理官が示した「論点整理」は以下のように多岐にわたるため、ポイントを絞って眺めてみましょう。
(1)新薬創出・適応外薬解消等促進加算制度の⾒直し(企業指標・企業要件、品⽬要件)
(2)⻑期収載品の段階的引下げまでの期間の在り⽅、⻑期収載品の薬価等の⾒直し
(3)イノベーションの評価(効能追加等による革新性・有用性の評価等)
(4)薬価算定方式の妥当性・正確性の向上(新薬創出等加算対象品目を比較薬とする場合の薬価算定、原価計算⽅式、類似薬効⽐較⽅式、再⽣医療等製品の価格算定、配合剤の価格算定)
(5)後発医薬品の薬価の在り方
(6)再算定(市場拡大再算定、⽤法⽤量変化再算定)
(7)その他(基礎的医薬品への対応の在り方、2020年度改定における実勢価の反映)
まず(1)の新薬創出等加算は、「通常であれば改定の都度に価格が下がっていく医薬品」のうち、▼製品に革新性があり、医療現場にとって欠かせないものか(品目要件)▼当該製品を開発するメーカーが、革新的な創薬に向けた成果を出しているか(企業要件・企業指標)―という2軸で選定した製品について、価格を一定程度維持することを認めるものです。
前者の品目要件については、これまでに「後発品が上市されていない新薬のうち、▼希少疾病用医薬品▼開発公募品▼加算適用品(画期性加算、有用性加算I・II、営業利益率の補正加算、真の臨床的有⽤性の検証に係る加算)▼新規作用機序医薬品(革新性・有用性のあるものに限る)等―」とされていますが、2020年度改定では、さらに▼先駆け審査指定制度の対象品目▼薬剤耐性菌の治療薬―を追加してはどうかとの提案が行われています。
一方、後者の企業要件・企業指標については、製薬メーカー側から「現在は、革新的医薬品等の開発数のみに着目しており、中小規模メーカーに不利である」との指摘を受け、▼新薬創出等加算対象品目・新規作用機序医薬品を1成分相当、それ以外の新薬を2/3成分相当として計算(重みづけ)する▼革新的新薬(新薬創出等加算対象品目又は新規作用機序医薬品)の収載実績を勘案する▼薬剤耐性菌治療薬の収載実績を勘案する―といった見直しを行ってはどうかとの提案がなされています(関連記事はこちら)。
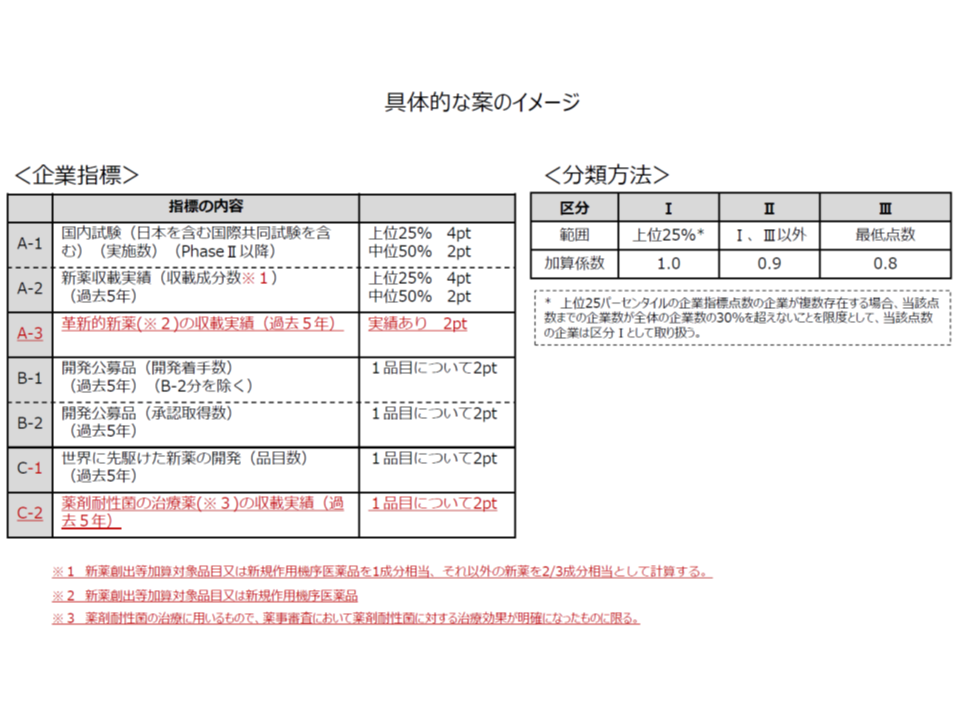
企業要件・指標の見直し案(中医協 薬価専門部会4 191122)
薬剤耐性菌対策の重要性が世界的にも高まっている一方で、「耐性菌治療薬の開発がなかなか進まない」現状を打開することも目指す見直し案と言え、方向性そのものは中医協委員に受け入れられています。ただし、現行制度では「企業要件の獲得ポイントが最低点となった企業以外、つまりほとんどのメーカーでは加算率が100%または90%となる」点について、支払側の幸野庄司委員(健康保険組合連合会理事)から「問題である。相対評価から絶対評価への移行、あるいは区分2(上位25%以下で、最低点ではない企業)・区分3(最低点の企業)の加算率を大幅に引き下げるなどの見直しを行うべき」と強く求めています。
後発品への置き換えが進んでいる長期収載品、より早期に価格引き下げ対象に
また(2)の長期収載品の薬価については、「長期収載品から後発品への置き換え」を進めるために、「置き換え率に応じて、段階的に薬価を下げていく仕組み」(G1・G2・C)が2018年度に導入されました。
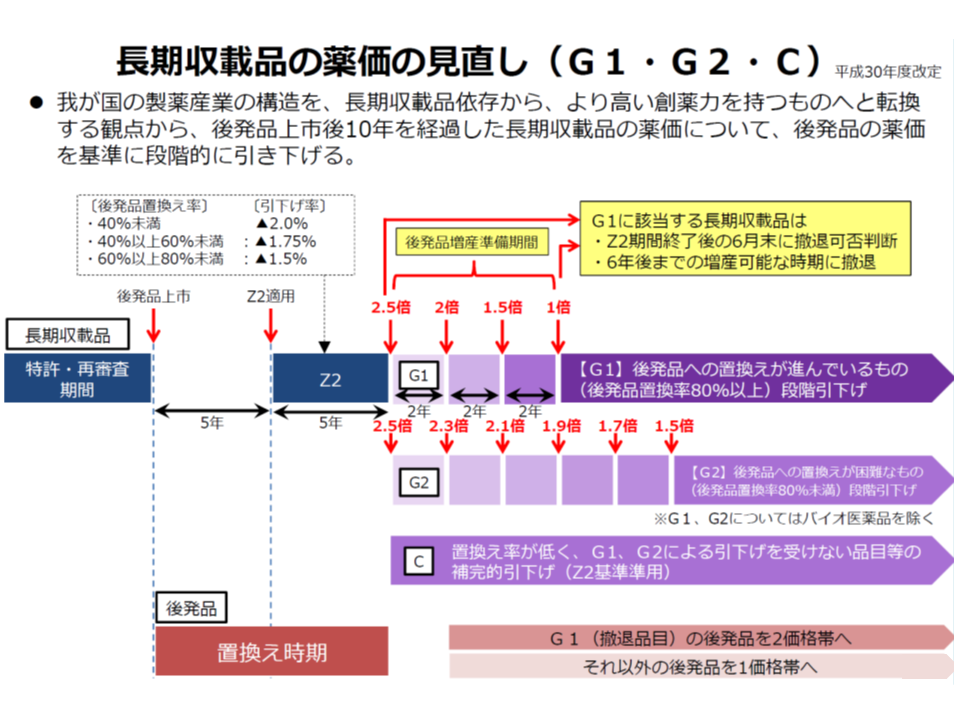
長期収載の価格引き下げルール(中医協 薬価専門部会2 191122)
ただし、「後発品の安定供給」(後発品の製造体制の強化には一定の時間がかかる)や「長期収載品の市場からの撤退期間」などを考慮して、「後発品が出現してから10年経過後にG1ルール等を適用する」(それまでは従前からあるZ2ルールで長期収載品の薬価を緩やかに引き下げていく)こととなっており、支払側の幸野委員らは「価格引き下げまでの期間が長すぎる」と主張していました(関連記事はこちら)。
そこで田宮薬剤管理官は、「後発品の出現から10年を経過する前であっても、後発品への置換え率が80%以上となった場合は、その2年後の薬価改定時に再度置換え率が80%以上となっていることを確認した上でG1の対象とする」という新たな仕組みの創設を提案しました。
この点、「2度も置き換え率が80%以上であることを確認する必要があるのか」との疑問が中医協委員から出ていますが、田宮薬剤管理官は「長期収載品メーカーの予見可能性を確保しなければならない」と理解を求めています。置き換え率を個別メーカーが確実に把握することは難しく、ある時点で突然、「貴社の製品は置き換え率80%に達したので、G1ルールに基づいて価格を引き下げます」と判断されたのでは、「当該製品の製造を継続する」か「市場を後発品に明け渡し、自社は撤退するか」などを検討する時間がないためです。
ただし幸野委員は「置き換え率80%以上の確認は一度で十分である。確認されてから1年を待ってG1ルールを適用すればよい」と注文しており、今後、どういった議論が行われるのか注目する必要があるでしょう。
類似薬効比較方式、比較薬の新薬創出等加算分をどの段階で控除すべきか
また(4)の薬価算定方式については、類似薬効比較方式(I)(新規性の高い医薬品の薬価算定ルール)において「比較薬が新薬創出等加算の対象であった場合、加算分をどう考えるか」という論点が大きくクローズアップされています。
新薬の薬価設定においては、まず「類似薬がある場合には、その医薬品と同じ価格とする(1日薬価を同じくする)」という類似薬効比較方式を探り、類似薬がない場合に原価を積み上げて薬価を考える「原価計算方式」が採用されます。
ただし、新規性の乏しい新薬については、類似薬(比較薬)の薬価から「新薬創出等加算分を除外」した価格に合わせて薬価が設定されます(類似薬効比較方式(II))。
この点、支払側の幸野委員らは「加算は、当該医薬品の価値に着目して上乗せされるものであり、類似薬効比較方式(I)においても新薬創出等加算の累積分を除外して、新薬の薬価を設定すべき」との考えを強く示しています。
この論理にも頷ける部分がありますが、幸野委員の提案を採用した場合、新薬の薬価は類似薬(比較薬)に比べて最大17%低く設定されます。これは「類似した医薬品は同じ薬価(1日薬価)とし、市場での競争を促す」という類似薬効比較方式の根幹を大きく揺るがすことになります。
そこで中医協では、「新薬の保険適用時には『新薬創出等加算分も組み込んで薬価を設定』し(現在と同じ考え方)、ただし、一定期間のうちに当該新薬が新薬創出等加算の対象とならない場合(つまり当該新薬について革新性等が認められない場合)には、一定期間経過後に新薬創出等加算の累積分を控除した価格に見直す」というルールを設けてはどうか、との考え方も出ています。2010-18年度に保険適用された新薬のうち54%は6年以内に「新薬創出等加算の対象」となっており、この新ルールが導入された場合、「半数程度は、一定期間後に大幅に薬価が引き下げられる」ことになるでしょう。
この点、中医協委員の間でも2つの案に賛否が出ており(診療側委員の多くは後者の提案を妥当としている)、今後、さらに議論が続けられます。
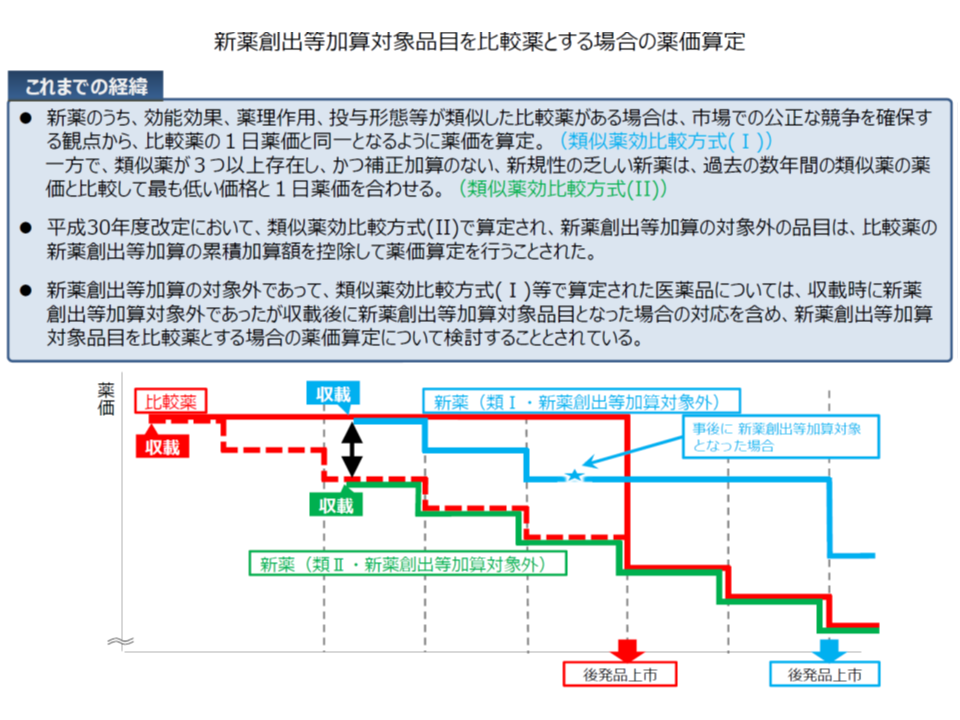
新薬創出等加算品目を比較薬とする場合の薬価算定(中医協 薬価専門部会3 191122)
なお、原価計算方式における「原価の開示度に応じた加算率」の設定について田宮薬剤管理官は、「現⾏の取扱いを継続することとし、引き続き開⽰度の向上方策について検討する」との考えを示しました。
この点、10月23日の中医協・薬価専門部会には、2018年度以降に原価計算方式が適用された新薬16成分のうち、10成分で▼開示度50%未満にとどまっている▼ただし従前と比べて実質加算率はプラス0.4%となり、従前と同程度の加算を取得できている―状況が報告されました。幸野委員は「開示の向上に向けて、開示度50%未満の製品については、加算率を現在の0.2から0.1に引き下げるべき」と求めています。
後発品、価格帯集約の弊害を是正する仕組みを導入
さらに(5)の後発品については、「価格帯の集約」が進められています。後発品の使用促進を阻む要因の1つとして、「後発品の品目が多すぎ、信頼性を損ねている」ことが指摘されています。
そこで、現在、▼最高価格の50%以上となる後発品は、その加重平均値を薬価とする(A)▼最高価格の30%以上50%未満となる後発品は、その加重平均値を薬価とする(B)▼最高価格の30%未満となる後発品は、その加重平均値を薬価とし、統一名収載とする(C)―という3つの価格帯に後発品を集約することとなっています。
しかし、この仕組みでは、例えば▼B価格帯に該当していた製品B1がA価格帯に移行した倍、その製品はA価格帯の加重平均に組み入れられ、結果として薬価が高くなってしまう▼A価格帯に該当していた製品A1がB価格帯に落ちてきたとき、Bの加重平均値が上がり、B価格帯の薬価が高くなってしまう―という問題が生じます。
そこで田宮薬剤管理官は、前者について「B1の価格が引き上がる場合、B1は元の価格帯(B)に含める」、後者について「A1とBとを分けて加重平均を算出する」(価格帯が3区分から4区分になる)という見直し案を提示しました。
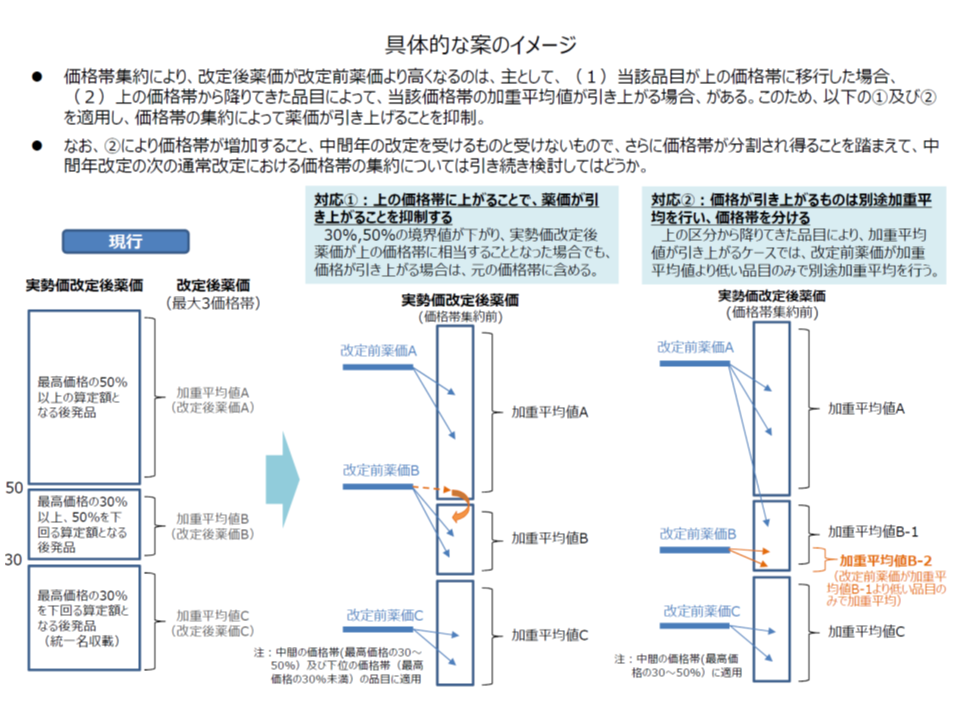
後発品の価格集約見直し案(中医協 薬価専門部会4 191122)
この方向そのものに異論は出ていませんが、支払側の幸野委員や吉森俊和委員(全国健康保険協会理事)、診療側の松本吉郎委員(日本医師会常任理事)ともに「最も低い価格帯(C)についても、こうした仕組みを導入すべき」と注文しています。また松本委員・幸野委員からは「後発品メーカーの再編統合そのものも検討してほしい」との要望も出ています。
【関連記事】
市場拡大再算定や基礎的医薬品のルールを2020年度改定に向けてどう見直すべきか―中医協・薬価専門部会
先行バイオ医薬品と同一のバイオAG、苦渋の選択として「先行バイオ品の70%」とするしかない―中医協・薬価専門部会
再製造の単回使用医療機器(RSUD)、オリジナル品と別の機能区分とし、低い償還価格を―中医協、材料専門部会・薬価専門部会
長期収載品の段階的価格引き下げルール、2020年度改定で厳格化すべきか―中医協・薬価専門部会
再生医療等製品、独自の薬価算定ルールを設けるべきか―中医協・薬価専門部会
新薬の価値そのものに着目した評価を求めるメーカーに対し、中医協委員は「新薬開発の競争促進」も重要と指摘―中医協・薬価専門部会
2020年度の薬価・材料価格制度改革に向けて、中医協で本格議論スタート―中医協、薬価・材料専門部会
2020年度薬価制度改革、新薬創出等加算や後発品使用促進策などが重要テーマ―中医協・薬価専門部会
先行バイオ医薬品とまったく同一の「バイオセイム」登場、薬価の在り方など検討―中医協総会(2)
薬価制度抜本改革案を修正、新薬創出等加算の厳格化を一部緩和―中医協薬価専門部会
新薬創出等加算の見直し、「容認できない」と製薬メーカー猛反発—中医協薬価専門部会
薬価制度抜本改革の具体案、費用対効果評価による価格引き上げも—中医協薬価専門部会
医療現場に必要不可欠な医薬品の価格下支え、対象拡大の方向―中医協・薬価専門部会
新薬の原価計算方式、診療・支払双方が改めて問題点指摘—中医協・薬価専門部会
医薬品の画期性・革新性、薬価にどう公平に反映させていくべきか—中医協・薬価専門部会
新薬創出等加算、「産業構造の転換」促すため対象企業要件を厳格化してはどうか—中医協・薬価専門部会
長期収載品から後発品への置き換え促進、新薬創出等加算などとセットで議論すべき—中医協・薬価専門部会
製薬メーカーが新薬創出等加算の継続を強く要望―中医協・薬価専門部会
後発品の薬価、現在3区分の価格帯をさらに集約していくべきか-中医協・薬価専門部会
原価計算方式における薬価算定、製薬メーカーの営業利益率などどう考えるか-中医協・薬価専門部会
薬価調査において、医療機関に対する価格調査は継続すべきか-中医協・薬価専門部会
中間年の薬価見直し、対象品目の基準(乖離率など)を事前に示しておくべきか―中医協・薬価専門部会
新薬の薬価設定で、比較対象薬(類似薬)に付加された補正加算をどう考えるべきか―中医協・薬価専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の外国平均価格調整、診療・支払両側から「米国価格は参照対象から除外すべき」との指摘―中医協・薬価専門部会
効能追加などで市場拡大した医薬品の薬価再算定、対象や引き下げ方法の議論開始―中医協薬価専門部会
薬価の毎年改定方針を決定、DPC点数表も毎年改定へ―厚労省





