再製造の単回使用医療機器(RSUD)、オリジナル品と別の機能区分とし、低い償還価格を―中医協、材料専門部会・薬価専門部会
2019.10.17.(木)
10月9日に開催された中央社会保険医療協議会の保険医療材料専門部会(以下、材料専門部会)および薬価専門部会では、2020年度の材料価格制度・薬価制度改革に向けて、具体的な議論を行いました。
医療材料については、注目される「再製造の単回使用医療機器」(RSUD)の価格設定について「オリジナル品よりも低く設定する」方向で検討が進んでいます。
また薬価については、新薬創出・適応外薬解消等加算について議論し、対象品目を拡大する方向が見え隠れしていますが、メーカーサイドの要望する「企業要件・企業指標」については具体的な見直し方向は見えてきていません。
目次
医療材料のチャレンジ申請、B1・B2での区分申請製品も対象にする方向
材料専門部会では、2020年度の次期材料価格制度改革に向けて▼チャレンジ申請▼再生医療等製品の価格算定▼単回使用医療機器の再製造品の価格算定―を議論しました。いずれも「イノベーション評価」に関連する事項です。

10月9日に開催された、「第103回 中央社会保険医療協議会 保険医療材料専門部会」
チャレンジ申請とは、「新規収載時にこそ有用性等のエビデンスがないものの、使用実績を踏まえて有用性等エビデンスを構築でき、再評価を行うことが妥当」と認められた製品について「事後に再評価を行ってほしい」と申請することを可能とする仕組みで、2018年度改定で創設されました。現在、8製品についてチャレンジ申請の権利が付与され、別に1品目(チャレンジ申請創設前に保険適用されていたが、チャレンジ申請が妥当と判断された)がチャレンジ申請に基づく再評価が行われています。
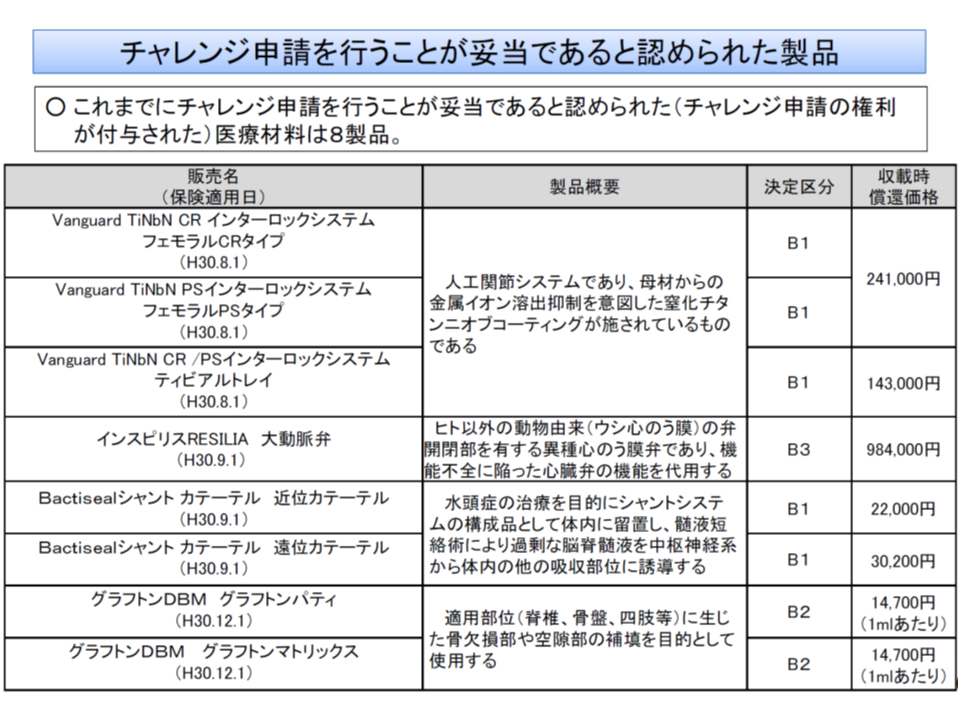
チャレンジ申請が認められた医療材料(中医協・材料価格専門部会1 191009)

チャレンジ申請での再評価(中医協・材料価格専門部会2 191009)
厚生労働省は、このチャレンジ申請について、保険医療材料専門組織の意見やこれまでの中医協論議を踏まえて、次の3点の見直しを行ってはどうかと提案しています。
(1)保険適用時にB1・B2として希望のあった製品についても、追加的な臨床的有用性が期待される場合があり、チャレンジ申請を希望可能とする
(2)チャレンジ申請の権利付与をメーカーが希望する場合には、再評価する内容を明確にするため「収載後のデータ収集」「評価の計画」を具体的に提示することを求める
(3)チャレンジ申請の権利が付与された製品について「データ収集の進捗状況」等の定期的な報告を求める
まず(1)について、現在はC1(新機能)・C2(新機能・新技術)での保険適用を希望した製品のみがチャレンジ申請可能ですが、▼これまでにチャレンジ申請の権利が付与された8製品は、いずれも結果としてB1・B2(既存の機能区分)と判断されたものであること▼有用性の評価に時間がかかるため、B1・B2で保険適用を申請する製品が少なくないこと―を踏まえた見直しです。
また(2)(3)は、チャレンジ申請に向けたデータ収集等を、いわば「国が支援する」仕組みと言えるでしょう。実際は有用性があるにもかかわらず、「データ収集の計画が甘いがために、適切にデータ収集が行えず、エビデンスを示せなかった」という事態を防止することが期待できます。
なお、これまでに診療側の城守国斗委員(日本医師会常任理事)らは「有用性が劣っているなどのデータが示された場合には、評価を引き下げる」ことも検討すべきではないか、と指摘していましたが、厚労省は「まず適切なデータ収集を行う仕組み」構築から進めたい考えです。中医協では、この方向に異論は出ていません。
再生医療等製品、独自の価格設定ルール創設は時期尚早
またヒトや動物の細胞に加工を施した再生医療等製品の中には、極めて高額(輸送等が高コストで、自己細胞由来製品では当該患者にしか使用できずスケールメリットが生じない)で、医療保険財政に大きな与える影響を与えるものもあるため「独自の価格設定ルールを検討してはどうか」との指摘が診療側・支払側双方の委員から出ていました。
ただし、これまでに保険適用された再生医療等製品(医療材料)は▼重症熱傷や先天性巨大色素性母斑、栄養障害型表皮水疱症、接合部型表皮水疱症の治療に用いる「ジェイス」(ヒト(自己)表皮由来細胞シート)▼外傷性軟骨欠損症、離断性骨軟骨炎の治療に用いる「ジャック」(ヒト(自己)軟骨由来組織)▼虚血性心疾患による重症心不全治療に用いる「ハートシート」(ヒト(自己)骨格筋由来細胞シート)―の3製品にとどまっており、「ルール化は時期尚早」という点で診療側・支払側の意見は一致しました。
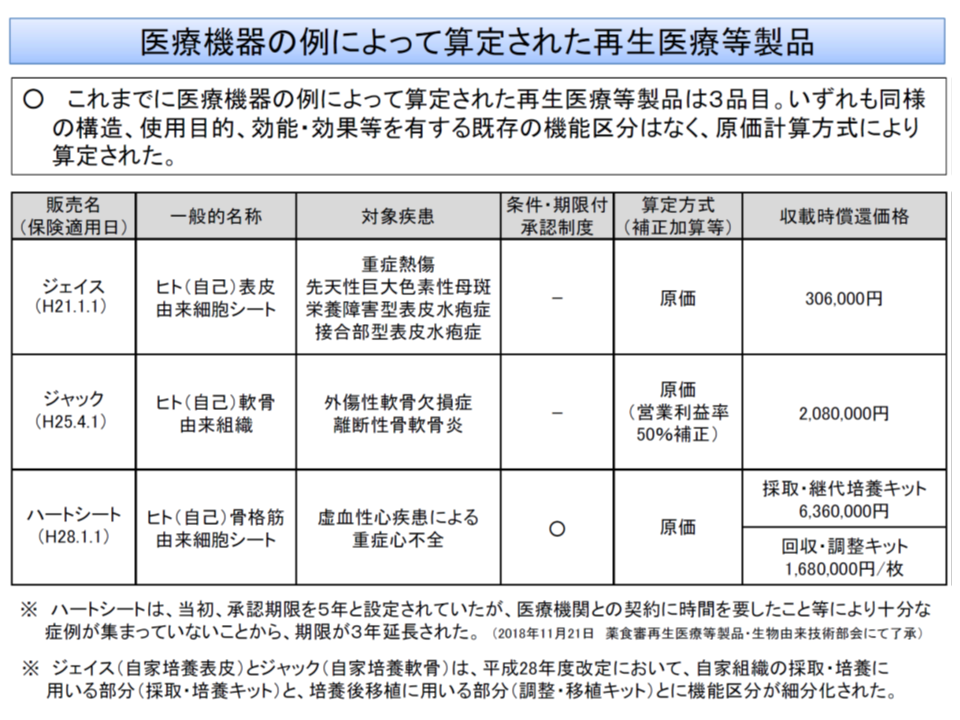
再生医療等製品(中医協・材料価格専門部会3 191009)
今後も、再生医療等製品の薬事承認・保険適用が進むと考えられ、事例を積み重ねる中で「独自の価格設定ルール」を検討していくことになるでしょう。
なお、再生医療等製品については、対象患者が極めて限られることから「期限付き・条件付きの薬事承認」が行われるものもあります(上述のハートシートなど)。薬事承認・保険適用によって症例が拡大し、そこで「有効性等の十分なエビデンス」を構築することで、改めての薬事承認等を受けるというものです(エビデンスが構築できなければ、逆に薬事承認が失効することもある)。こうした製品については、上述の「チャレンジ申請」の対象とする方向も示されています。
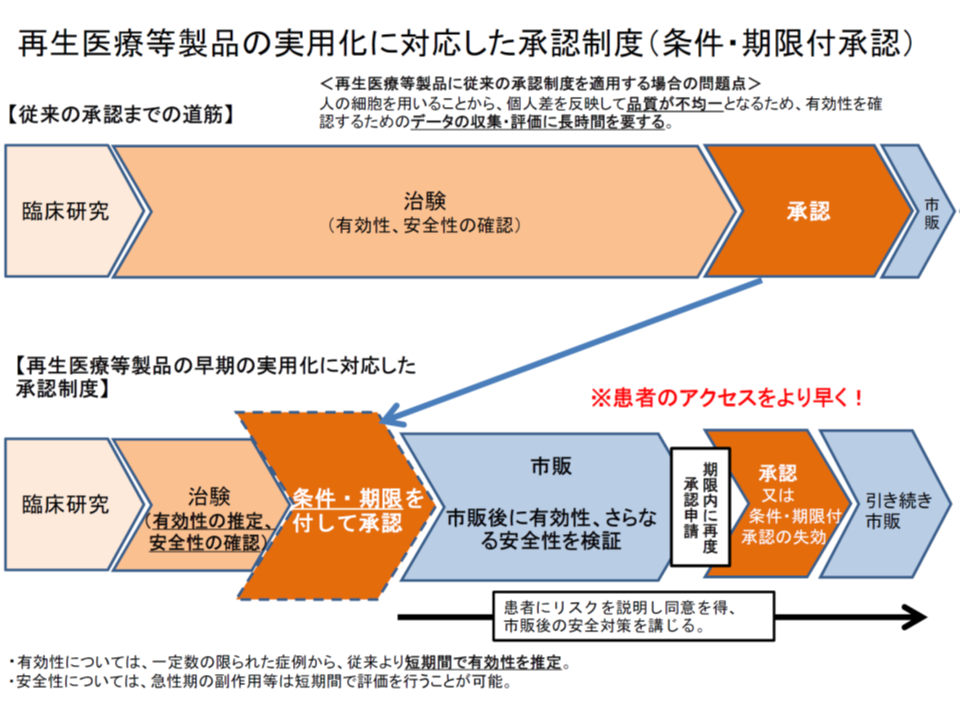
再製造の単回使用医療機器、保険償還価格はオリジナル品よりも低く設定する方向
一方、「単回使用医療機器の再製造品」(RSUD)とは、医療安全の観点から「1度きりの使用しか認められていない」医療機器(SUD)について、一定の要件を満たした場合に、企業が回収・洗浄・滅菌等をして「再使用」が認められた製品です。

RSUDの概要(中医協・材料価格専門部会5 191009)
これまでに、臓電気生理学的検査・一時的ペーシングを行うために経皮経管的に心臓内に留置して使用する【再製造ラッソー2515】(日本ストライカー社)のみが薬事承認を受けていますが、今後、再製造品の薬事承認が進む可能性があり、保険適用するにあたって「価格設定ルール」を決めておく必要があるのです。
この点、▼米国や欧州ではRSUD製品はオリジナル品の2-5割引きの価格で医療機関に納品されている▼RSUDでは研究・開発等のコストが生じない―ことなどを踏まえ、厚労省保険局医療課医療技術評価推進室の岡田就将室長は「オリジナル品とは異なる価格設定としてはどうか」との提案を行いました。例えば、Aという機能区分のSUD製品があり、その再製造品が保険適用される場合には、「Aの機能区分」そのものには含めず、例えば「同じ機能をもつ再製造品のみの新たな機能区分」を設け、そこでAよりも低廉な保険償還価格を設定することなどが考えられるでしょう。どの程度の価格設定となるのか、今後の議論が注目されます。
なお、再製造品によっては、洗浄・滅菌のコストが高くつくものもあると考えられ、市場実勢価格がオリジナル品とは異なる動きをする可能性もあります。このため岡田医療技術評価推進室長は、「価格改定において、オリジナル品とは別に市場実勢価格を調査し、価格改定を行う」「ただしオリジナル品よりも高い価格には設定しない」との方針を示し、中医協委員もこれを受け入れています。
新薬創出等加算、中医協委員は「企業要件・企業指標は合理的」との考え
また薬価専門部会では、2020年度の次期薬価制度改革に向けて▼新薬創出・適応外薬解消等促進加算制度(企業要件・企業指標、品目要件)▼後発医薬品の薬価の在り方―を議論しました。

10月9日に開催された、「第157回 中央社会保険医療協議会 薬価専門部会」
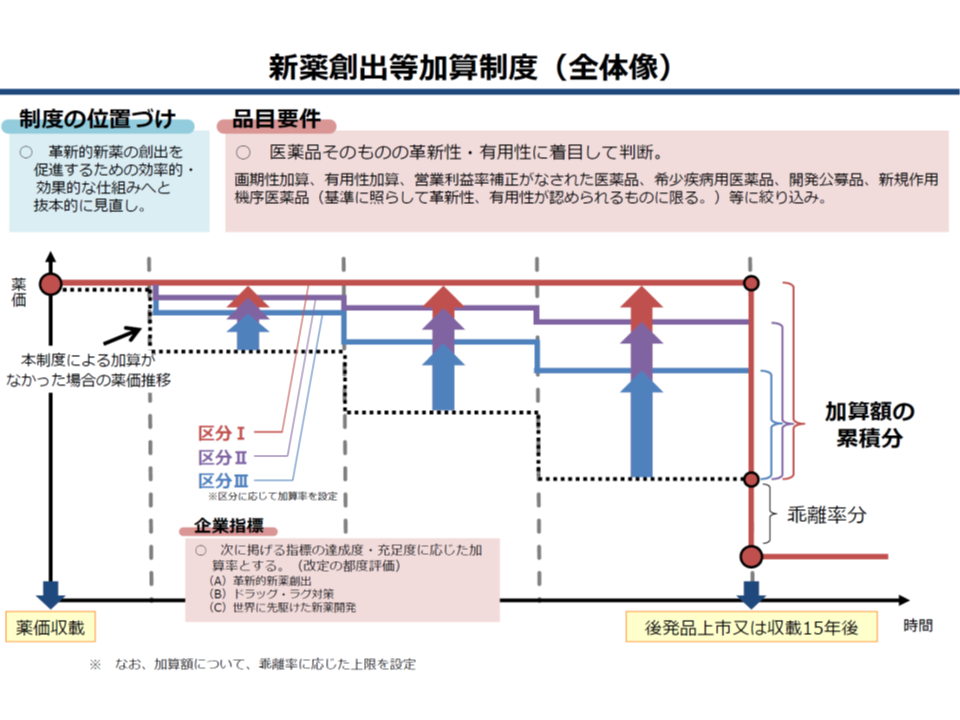
前者の新薬創出・適応外薬解消等促進加算(以下、新薬創出等加算)については、2018年度の薬価制度抜本改革において、例えば次のような大きな見直しを行うとともに、「制度化」が行われました。
【品目要件】
▽真に革新性・有用性のある医薬品に限定する(希少疾病用医薬品、開発公募品、加算適用品(画期性加算、有用性加算I・II、営業利益率の補正加算、真の臨床的有用性の検証に係る加算)、新規作用機序医薬品(革新性・有用性のあるものに限る)など)
▽「薬価と市場実勢価格との乖離率が平均以下」との要件は撤廃する
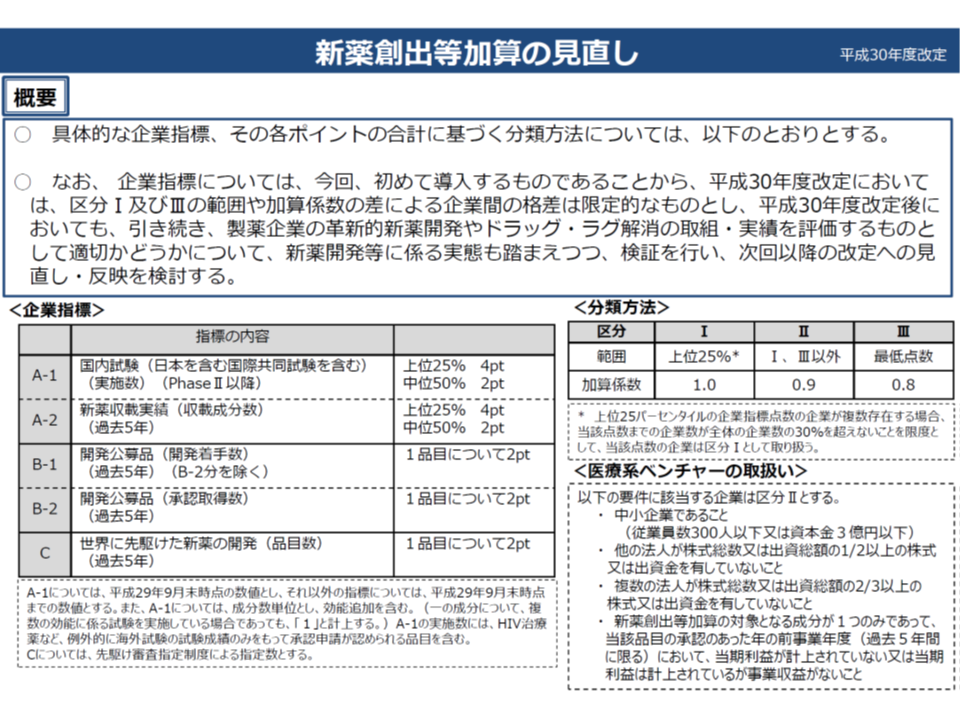
【企業要件・企業指標】
▽従前どおり「医療上の必要性の高い未承認薬・適応外薬検討会議」に基づく厚生労働省からの開発要請に適切に対応しない企業については、加算の対象から除外する
▽▼革新的新薬創出▼ドラッグ・ラグ対策▼世界に先駆けた新薬開発―に関する指標を設定し、その達成度・充足度(ポイント)指標の達成度・充足度に応じて加算にメリハリをつける(上位25%は加算係数を1.0、中位は(上位・最下位以外)は加算係数を0.9、最下位は加算係数を0.8)
【加算】
▽加算額=[(改定前薬価-市場実勢価改定後の価格)または下記上限のいずれか低い方]×加算係数(1.0から0.8)
▽加算上限を設ける(▼平均乖離率以下:市場実勢価改定後の価格×(平均乖離率-2%)×0.8▼平均乖離率超え:市場実勢価改定後の価格×(平均乖離率-2%)×0.5―とする)
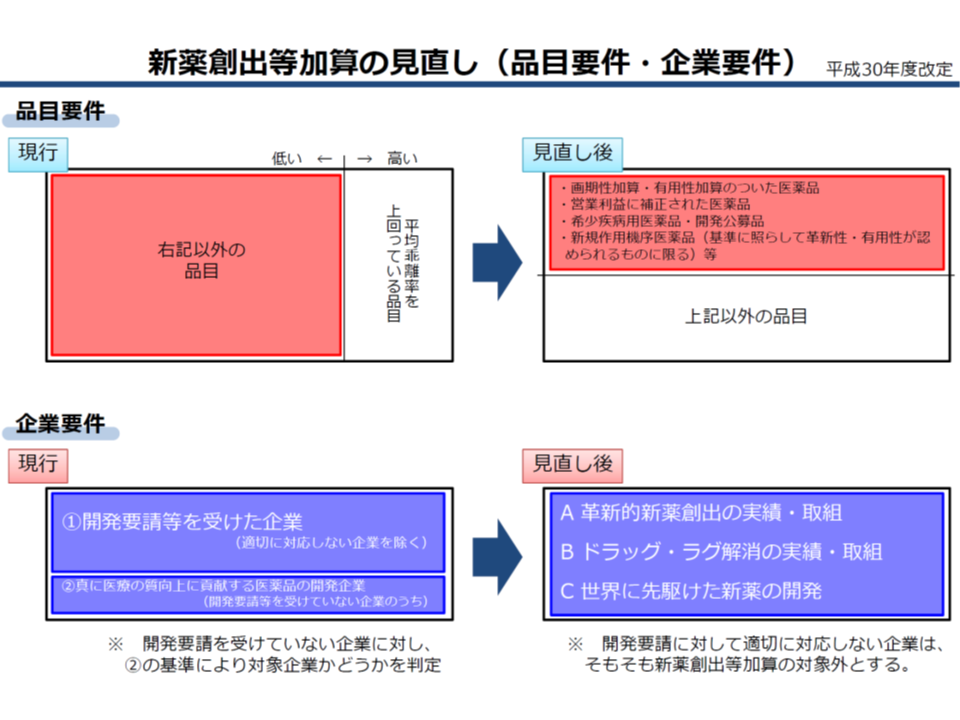
新薬創出等加算(その1)(中医協・薬価専門部会1 191009)
新薬創出等加算(その2)(中医協・薬価専門部会2 191009)
新薬創出等加算(その3)(中医協・薬価専門部会3 191009)
まず【品目要件】については、関係団体ヒアリングにおいて、例えば▼先駆け審査指定品目や条件付き早期承認品目を含む優先審査の対象品目▼効能追加や市販後に提示された新たなデータで示された追加的価値▼新薬創出等加算の対象とならない2番手以降の品目のうち「革新性・有用性に係る基準を満たす品目」―などを新薬創出等加算の対象に加えてほしいとの要望が出ています。
この点、中医協委員からは「先駆け審査指定品目は対象に追加しても良いのではないか」(支払側の幸野庄司委員:健康保険組合連合会理事)などの具体的な意見も出ていますが、「医療保険財政に与える影響などを詳しく見ていく必要がある」(支払側の吉森俊和委員:全国健康保険協会理事ら)との指摘も踏まえ、「さらに検討する」ことになりました。

先駆け審査指定制度の概要(中医協・薬価専門部会4 191009)
一方【企業要件・企業指標】は、「優れた医薬品の開発」を促進することが目的ですが、メーカーサイドからは「個々の医薬品の価値そのものを評価すべき。企業要件・企業指標は抜本的に見直すべきである」との指摘が出ています。例えば、小規模メーカーであれば開発件数がどうしても少なくなり「加算率が低くなってしまう」という課題があるとの指摘です。
この点、診療側の松本吉郎委員(日本医師会常任理事)や支払側の吉森委員らは「メーカーサイドは公平性に欠けるというが、代替案はあるのか。革新性の高い医薬品開発数などに着目した現行制度には合理性があり、代替案がなければ現行制度を継続すべきである」との考えが示されています。
今後の関係団体ヒアリングや、専門委員発言での、メーカーの出方が注目されます。
後発品の価格帯集約で、かえって「高薬価が設定される」事態も
また後発品については、▼新規収載時の価格設定ルール(先発品の50%、ただし銘柄数が10を超える場合には40%)をどう考えるか▼価格帯(最高価格の30%未満の後発品は統一名収載、最高価格の30%以上50%未満の後発品、最高価格の50%以上の算定額となる後発品の3価格帯)の集約をどう考えるか―という論点があります。
前者の新規収載時の価格設定については、「安定供給のために現在のルール(先発品の50%、ただし銘柄数が10を超える場合には40%)を維持すべき」との考えが診療側の松本委員から示されましたが、支払側の幸野委員は「実勢価格を見て引き下げも検討すべき」と述べており、さらに調整が必要なようです。

後発医薬品の価格設定(中医協・薬価専門部会5 191009)
また後者の価格帯については、「後発品の銘柄が多すぎ、これが医療関係者や国民の信頼を損ねる一因にもなっている」との指摘を受け、徐々に集約が進められています。しかし一方で、例えば先発品Xの後発品が多数あったとして、その中に「先発品価格の20%のX1」「先発品価格の25%のX2」という製品があった場合、現行ルールではX1とX2はまとめて薬価を設定することになり、「X1は従前より高い薬価が設定される」ことになります(下図参照)。これは価格帯集約の一種の弊害であり、中医協委員からも「何らかの対応が必要」との意見が多数出ています。現時点で明確な方向性は見えませんが、過渡的に「3価格帯以外の後発品の薬価設定」が行われる可能性もありそうです。
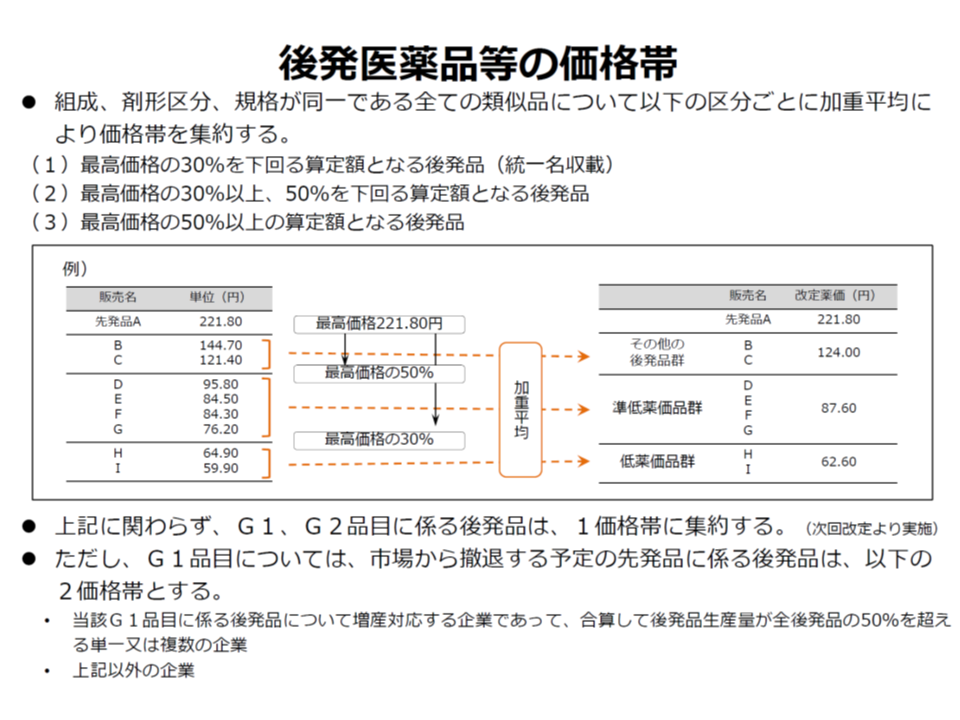
後発医薬品の価格帯(中医協・薬価専門部会6 191009)


【関連記事】
先駆け審査指定制度の対象医療材料、新たな加算で評価すべきか―中医協・材料専門部会
医療機器の「チャレンジ申請」、対象拡大や「チャレンジ失敗時の対応」を検討へ―中医協・材料専門部会(2)
「医療機器の流通コスト」を契機に、「症例集約を進めるべきか」で舌戦―中医協・材料専門部会(1)
市販後データ踏まえ医療材料の有用性等を再評価する「チャレンジ申請」、2020年度改定で拡大しては―中医協・材料専門部会
2020年度の薬価・材料価格制度改革に向けて、中医協で本格議論スタート―中医協、薬価・材料専門部会
使用実績を踏まえ材料機能区分を再申請(チャレンジ申請)できる仕組み新設―中医協・材料専門部会
2018年度の材料価格改定、メーカー側は注文付けるも大枠は賛同―中医協・材料専門部会
保険医療材料価格の内外価格差是正に向け、外国価格調整を強化—中医協・材料専門部会
医療現場に必要不可欠な医薬品の価格下支え、対象拡大の方向―中医協・薬価専門部会
既存品目からの置き換えとなる改良医療機器、機能区分をどう考えるか―中医協・材料専門部会
材料価格制度、イノベーション評価推進や市場拡大再算定導入などを検討—中医協・材料専門部会
「医療ニーズが高い」との開発要請に応えない医療機器メーカーにペナルティなど与えるべきか—医療材料専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
長期収載品の段階的価格引き下げルール、2020年度改定で厳格化すべきか―中医協・薬価専門部会
再生医療等製品、独自の薬価算定ルールを設けるべきか―中医協・薬価専門部会
新薬の価値そのものに着目した評価を求めるメーカーに対し、中医協委員は「新薬開発の競争促進」も重要と指摘―中医協・薬価専門部会
2020年度の薬価・材料価格制度改革に向けて、中医協で本格議論スタート―中医協、薬価・材料専門部会
2020年度薬価制度改革、新薬創出等加算や後発品使用促進策などが重要テーマ―中医協・薬価専門部会
先行バイオ医薬品とまったく同一の「バイオセイム」登場、薬価の在り方など検討―中医協総会(2)
薬価制度抜本改革案を修正、新薬創出等加算の厳格化を一部緩和―中医協薬価専門部会
新薬創出等加算の見直し、「容認できない」と製薬メーカー猛反発—中医協薬価専門部会
薬価制度抜本改革の具体案、費用対効果評価による価格引き上げも—中医協薬価専門部会
医療現場に必要不可欠な医薬品の価格下支え、対象拡大の方向―中医協・薬価専門部会
新薬の原価計算方式、診療・支払双方が改めて問題点指摘—中医協・薬価専門部会
医薬品の画期性・革新性、薬価にどう公平に反映させていくべきか—中医協・薬価専門部会
新薬創出等加算、「産業構造の転換」促すため対象企業要件を厳格化してはどうか—中医協・薬価専門部会
長期収載品から後発品への置き換え促進、新薬創出等加算などとセットで議論すべき—中医協・薬価専門部会
製薬メーカーが新薬創出等加算の継続を強く要望―中医協・薬価専門部会
後発品の薬価、現在3区分の価格帯をさらに集約していくべきか-中医協・薬価専門部会
原価計算方式における薬価算定、製薬メーカーの営業利益率などどう考えるか-中医協・薬価専門部会
薬価調査において、医療機関に対する価格調査は継続すべきか-中医協・薬価専門部会
中間年の薬価見直し、対象品目の基準(乖離率など)を事前に示しておくべきか―中医協・薬価専門部会
新薬の薬価設定で、比較対象薬(類似薬)に付加された補正加算をどう考えるべきか―中医協・薬価専門部会
材料価格制度も「皆保険の維持」や「イノベーション」目的に、2018年度に抜本改革―医療材料専門部会
薬価の外国平均価格調整、診療・支払両側から「米国価格は参照対象から除外すべき」との指摘―中医協・薬価専門部会
効能追加などで市場拡大した医薬品の薬価再算定、対象や引き下げ方法の議論開始―中医協薬価専門部会
薬価の毎年改定方針を決定、DPC点数表も毎年改定へ―厚労省
一時的心臓ペーシング等に用いる「ラッソー2515」の再製造製品、初の「SUD再製造」対象として承認―厚労省
単回使用医療機器、医療安全確保のため「院内で洗浄・滅菌しての再利用」は認められない—厚労省



