医薬品の費用対効果評価、厳しすぎれば「日本市場の魅力」が減退―中医協・費用対効果評価合同部会
2018.12.27.(木)
医薬品・医療機器の価格設定における「費用対効果評価」の制度化(本格導入)にあたって、価格の引き下げが過度にならないよう、加算率の調整率は「最大50%」かつ「価格全体の10%以下まで」とするルールを設けるべきである―。
12月19日には、中央社会保険医療協議会の「費用対効果評価専門部会」「薬価専門部会」「保険医療材料専門部会」の合同部会(以下、合同部会)では、関係業界からの意見聴取が行われ、こういった意見が出されました。
また外資系の製薬メーカー団体からは、厳しい費用対効果評価の導入で「日本市場の魅力がなくなってきている」との、非常に厳しい指摘もなされています。
年明け早々にも、費用対効果評価の制度化に向けた骨子案が厚生労働省から示される見込みです。

12月19日に開催された、「第14回 中央社会保険医療協議会 費用対効果評価専門部会・薬価専門部会・保険医療材料専門部会 合同部会」
価格調整方法や企業側分析期間などについてメーカーサイドから要望
医薬品・医療機器をはじめとする医療技術の値決めにあたり、費用対効果評価結果を活用する仕組みが導入されます。「安全性」「有効性」というこれまでの評価軸に、新たな「費用対効果評価」という評価軸を加え、価格設定を行う仕組みです。
(1)既収載品13品目等を対象に費用対効果評価を試行導入し、2018年度の薬価・材料価格改定時に再算定を行う(暫定的に実施済)(2)2018年度中に制度化(本格導入)に向けた検討結果を取りまとめる—ことが決まっており、現在、(2)の制度化論議が精力的に進められています。
費用対効果評価の仕組みは非常に複雑ですが、概ね次のように価格調整を行います(今後の調整がありうる)。
(A)医療技術βの費用対効果を、類似の医療技術αと比較し、▼優れていればβの価格を維持または引き上げる▼劣っていればβの価格を引き下げる
(B)費用対効果の優劣は、ICER(増分費用効果)という概念を用いて判断する(高い効果を得るために、どれだけ余分な費用がかかるのか見て、大きな費用(ICERが高い)がかかれば「費用対効果が劣っている」と、小さな費用(ICERが小さい)ですめば「費用対効果が優れている」と判断する)
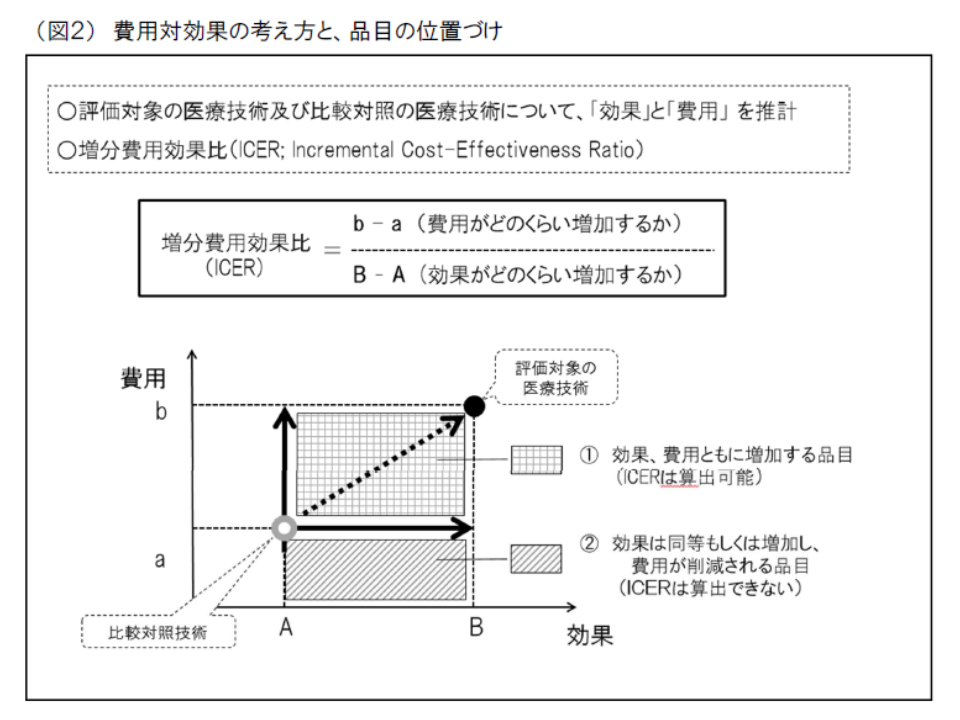
(C)費用と効果だけでは判断できない要素について総合的評価(アプレイザル)を行う(例えば、「小児疾患」の治療に有用な医薬品は、費用が高くなり『費用対効果が悪い』と判断されがちであるが、その社会的役割に鑑みた評価を行う)
(D)価格調整については、▼類似薬効比較方式等で価格設定する医薬品・医療機器では、「補正加算部分」のみを引き下げの対象とし、最大引き下げ幅を90%とする▼原価計算方式では、全体を引き下げの対象とするが、「営業利益本体と製品総原価の合計額」を下回らないように引き下げる(最大引き下げ幅は90%)
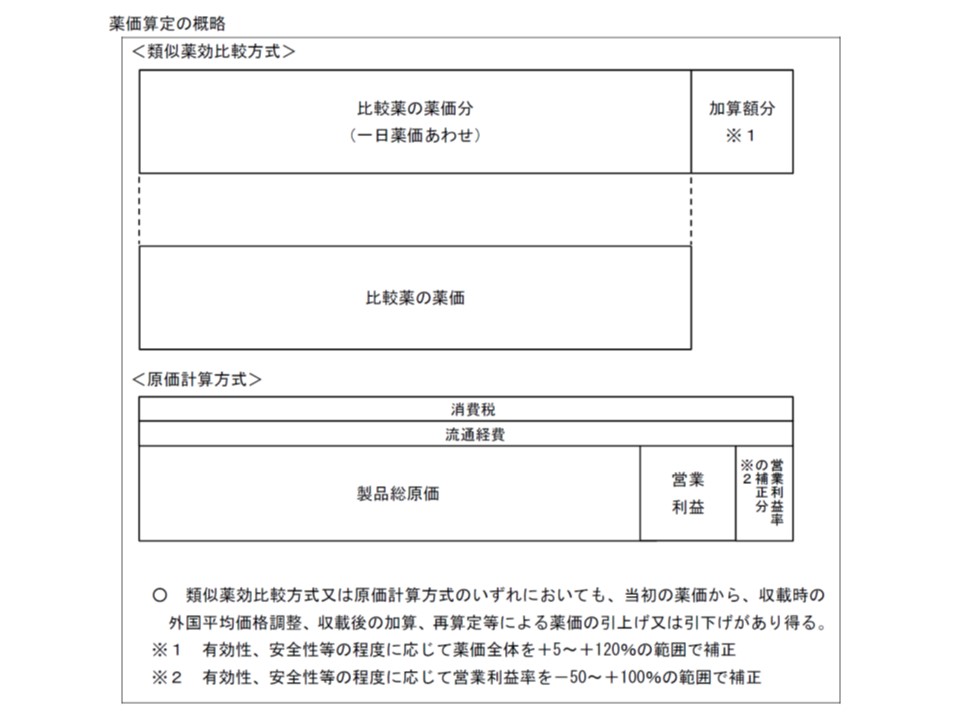
医薬品の薬価は、類似薬効算定方式(上段)では「再類似薬と同水準に設定される部分」と「加算部分」に分解することができる
(2)の制度化に向けては、(1)の試行導入結果を踏まえて、例えば、次のような見直し方向が概ね固まっています。
▽「補正加算があり市場規模の大きな新薬・新規医療機器」を主な対象とする(試行では既収載品を主な対象とし、新薬・新規医療機器では価格調整を行わないこととした)(関連記事はこちら)
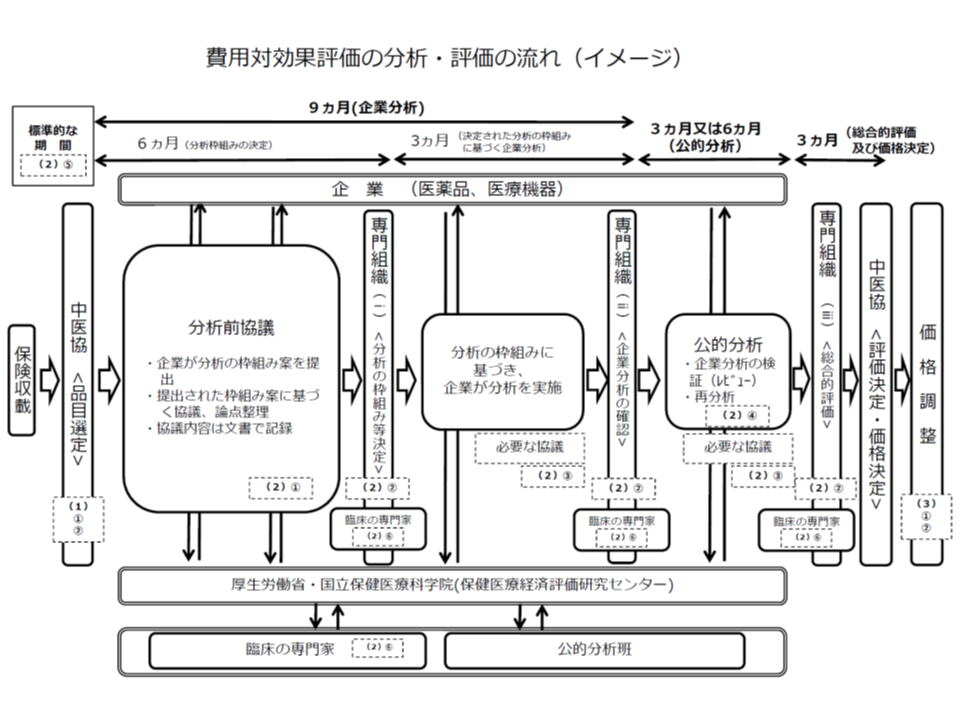
▽メーカー(企業)の分析結果と、公的機関の分析結果とに大きな齟齬が出ないよう、費用・効果の判断素材などについて事前協議を十分に行うとともに、費用対効果評価専門組織が適宜関与する(試行ではこのプロセスが十分でなく、結果、分析結果に大きな齟齬が出てしまった)(関連記事はこちら)
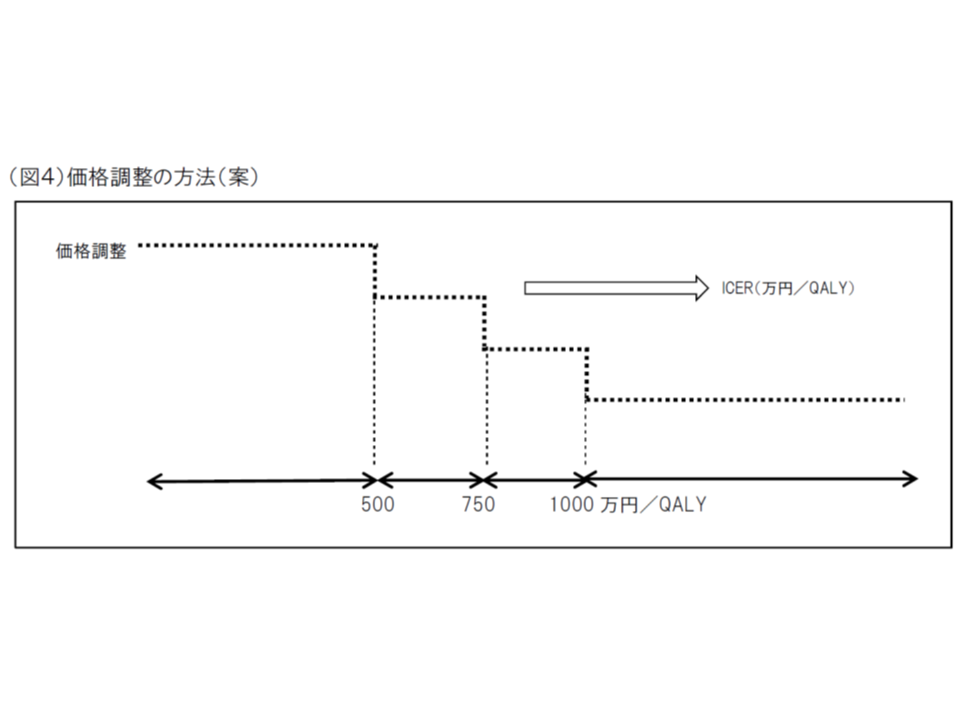
▽費用対効果の良し悪しは、ICER(一定の効果をあげるために、どれだけ余分な費用がかかるかを測る指標、増分費用効果比)の値が▼500万円以下であれば「良い」と判断して価格引下げは行わない▼500万円超750万円以下であれば「比較的悪い」と判断して一定の価格引き下げを行う(X%)▼750万円超1000万円以下であれば「悪い」と判断して更なる価格引き下げを行う(Y%)▼1000万円超であれば「悪い」と判断するがY%を超える引下げは行わない(試行では、500万円超1000万円以下であればICERの値に基づき連続的に価格引き下げを行った)(関連記事はこちら)
こうした制度の大枠や見直し内容について医薬品・医療機器のメーカー団体からは、「評価できる」との見解が寄せられましたが、一部注文も付いています。
例えば、価格調整方法について、試行では上記のように、例えば類似薬効比較方式等で価格設定された医薬品・医療機器では「補正加算部分の最大90%が引き下げられる」ことになりましたが、メーカーサイドは「過度な引き下げである」とし、「加算率の調整率は▼最大50%▼価格全体の10%以下まで―とするルールを設けるべき」と提案しています。確かに、薬価算定組織等で「有用である」と評価されて加算が設けられたにも関わらず、「費用対効果が悪い、その加算の9割部分はカットする」と判断されるのでは、「開発に向けたモチベーションが維持されるのか」との疑問もわきます。しかし、診療側の松本吉郎委員(日本医師会常任理事)からは「安定供給の重要性は理解できるが、価格引き下げに大きな制約を設ける提案には納得できない」との反論も出ています。関連して支払側の吉森俊和委員(全国健康保険協会理事)は「2018年度の薬価制度抜本改革で『原価の内訳を十分に開示した場合の評価』が導入されたが、開示が不十分である」との指摘も出ています。
また、メーカーと公的機関との「事前協議」について、メーカーサイドは高く評価していますが、「メーカー側の分析期間を十分に確保してほしい。厚労省案では『3か月』となっているが、当面は『6か月』は必要である。例えば、外資系の製薬メーカーでは、外国にある本社とのやりとりにも時間がかかる」との要望が出ています。
一方、医療機器メーカーサイドからは、「機能区分別に保険償還価格が設定される医療機器においては、複数製品がある機能区分に入ると考えられる製品について費用対効果評価が行われる際には、当該製品は別の機能区分とすべき」との要望が出されました。例えば、A機能区分について「1万円」の償還価格が設定されたとして、その機能区分に合致するa1製品が費用対効果評価の結果「9000円」と判断された場合、A機能区分の償還価格も、これに引っ張られて償還価格が下がってしまえば、他のA機能区分の製品が大きな痛手を受けてしまうという考えに基づく要望です。
近く(年明け早々にも)、費用対効果評価の制度化に向けた骨子案が厚労省から提示される見込みですが、その中で、こうした要望がどう反映されるのか注目したいところです。
なお、製薬メーカーサイド(特に外資系メーカー団体であるPhRMAやEFPIA)からは、「ここ数年、日本の医療用医薬品市場は魅力がなくなってきている。また、費用対効果評価の先進国とされるイギリスでは、新たな乳がん治療薬が公的保障内容に含まれず(イギリスでは、費用対効果評価を保険償還すべきか否かの判断に用いている)、乳がん患者の生存率が他の欧州諸国よりも低くなっている」ことが紹介されました。外資系の製薬メーカーなどが「日本では費用対効果評価によって償還価格が低く設定される。日本の市場は魅力的でない」と判断すれば、優れた医薬品の供給がなされなくなる可能性もあります(少なくとも遅くなる)。薬価や材料価格を考える上では、こうした「企業側の経営的視点」も勘案しなければなりません。もちろん、我が国においては「公的医療保険の1プレイヤー」としての責任がありますが、その一方で、営利企業であるため、「利益が出ない」と判断すれば、最終的に「撤退する」との選択もあり得るのです。今回の意見は、こうした点を改めて確認するもので、非常に厳しいものと受け止めるべきでしょう。厚労省や中医協では、これらの要素も勘案しなければならず、今後も難しい舵取りが迫られるでしょう。
【関連記事】
医療技術の費用対効果、500万・750万・1000万の3基準値に沿い「良し悪し」を判断へ―中医協・費用対効果評価合同部会
費用対効果評価、企業と公的機関の分析に齟齬が出ないよう、適宜「協議」を行う―中医協・費用対効果評価合同部会
医療技術の費用対効果、「連続的に評価」すべきか、「他技術より劣れば一律に評価」すべきか―中医協・費用対効果評価合同部会
費用対効果評価、「補正加算があり市場規模の大きな新薬・新規医療機器」を主な対象に―中医協・費用対効果評価合同部会
費用対効果データが複数ある場合、評価には一定の「幅」を持たせてはどうか―中医協・費用対効果評価専門部会
費用対効果評価、試行導入結果踏まえ「データ提出」や「再分析」の在り方検討―中医協・費用対効果評価合同部会(2)
費用対効果評価、「健康のためにいくら支払えるか」との調査は国では行わない―中医協・費用対効果評価合同部会(1)
費用対効果評価、オプジーボは価格引き下げ、川澄化学のステントグラフトは引き上げ―中医協・費用対効果評価合同部会
費用対効果評価、試行結果の検証踏まえ2019年度以降に制度化―中医協
使用実績を踏まえ材料機能区分を再申請(チャレンジ申請)できる仕組み新設―中医協・材料専門部会
薬価制度抜本改革案を修正、新薬創出等加算の厳格化を一部緩和―中医協薬価専門部会
新薬創出等加算の見直し、「容認できない」と製薬メーカー猛反発—中医協薬価専門部会
薬価制度抜本改革の具体案、費用対効果評価による価格引き上げも—中医協薬価専門部会
既存製品よりも費用が安く済み、効果の高い製品の価格は引き上げるべきか―費用対効果評価合同部会
医薬品などの費用対効果評価、業界は「加算のみへの反映」を切望—中医協・費用対効果評価合同部会
医薬品などの費用対効果評価、結果は加算のみに反映させるか、価格全体に及ぼすか—中医協・費用対効果評価関係
費用対効果評価、10月までに試行導入の詳細、年内に制度化の骨子を固める—中医協・費用対効果評価専門部会
費用対効果、試行導入には「支払い意思額調査」結果は用いず—中医協・費用対効果評価専門部会
費用対効果を判断するための「支払い意思額調査」、聞き方も含めて再検討—中医協・費用対効果評価専門部会
新医療技術の恩恵を受ける国民を対象に「いくらまで支払えるか」を調査—中医協・費用対効果専門部会
費用対効果評価の結果、どのタイミングで薬価などに反映させるか—中医協・費用対効果専門部会
費用対効果評価の結果、「保険償還価格の調整」に活用—中医協・費用対効果専門部会
医療技術の費用対効果評価、厚労省が仮想具体例で詳説—中医協・費用対効果評価専門部会
医療技術の費用対効果評価、「感染症対策への有用性」など6要素も勘案—中医協・費用対効果評価専門部会
医療技術の費用対効果、評価のための基準値を設定する方針に転換―中医協・費用対効果評価専門部会
費用対効果評価、新規収載の医薬品なども対象に2018年度から本格導入へ―費用対効果評価専門部会
2018年度の費用対効果評価に基づく再算定、オプジーボやハーボニーなど12品目に決定―中医協総会
2016年4月以降、費用対効果評価の対象として補正加算が高いものなど8品目程度を選定―中医協総会
費用対効果の良し悪しを判断する基準値、2016年度改定では定めず―費用対効果評価専門部会
費用対効果評価、対象は「保険収載後、1-2回の改定を経たもの」に―費用対効果評価専門部会
費用対効果評価、試行段階では社会的影響を評価する特別ルールは定めず―費用対効果評価専門部会
費用対効果評価の結果は医薬品・医療機器の再算定に活用―費用対効果評価専門部会
費用対効果評価はQALYを基本に実施、他の指標の使用も認める―中医協・専門部会
薬などの費用対効果、まず既収載品の再算定に活用、価格への反映は18年度改定時か―中医協・専門部会





