「効果が同じ、価格のみ高額」な医薬品、最も厳しい価格引き下げルール適用へ―中医協・費用対効果評価専門部会
2021.7.27.(火)
費用対効果評価制度の改善に向けて、例えば「費用対効果評価専門組織の検討期間標準を定める」「企業が理由なく分析期間を遅延した場合には、最も厳しい価格引き下げルールを適用する」「効果が同じで、価格のみ高額であるといった医薬品については、最も厳しい価格引き下げルールを適用する」などの改善に向けた検討を進めてはどうか―。
7月21日に開催された中央社会保険医療協議会の費用対効果評価専門部会(以下、専門部会)では、こうした方針を固めました。今後、専門部会で「費用対効果評価」制度改善案を詰め、中医協総会での審議につなげます。
目次
費用対効果評価の制度改善に向けて、専門組織から11の提案
我が国の公的医療保険制度では、安全性・有効性の確認された医療技術は「すべて保険適用する」ことが原則です。しかし、医療技術の高度化(例えば脊髄性筋萎縮症の治療薬「ゾルゲンスマ点滴静注」(1億6707万円)、白血病等治療薬「キムリア」(3350万円)といった超高額薬剤の保険適用など)が進み、医療保険財政が厳しくなる中では、新規の医療技術を保険適用する際などに「経済面を考慮する」ことが不可欠となってきています(端的に「効果に見合った価格設定」する)。
そこで、中医協では2012年度から「費用対効果評価」の導入に向けた検討を進め、試行錯誤を経て2019年4月から制度化(本格運用)されました。
費用対効果評価の仕組みは非常に複雑ですが、「高額である」「医療保険財政に大きな影響を及ぼす」などの要件を満たした新薬・新医療機器について、「類似の医薬品・医療技術等に比べて、費用対効果が優れているのか、あるいは劣っているか」をデータに基づいて判断。「費用対効果が優れている」と判断されれば価格(薬価、材料価格)は据え置きとなり、「費用対効果が劣っている」と判断されれば価格の引き下げが行われます。また、「費用が少なくなる一方で、効果が優れている・あるいは同じである」という、いわば「きわめて費用対効果が優れている」製品については、価格の引き上げも行われます。従前の「安全性」「有効性」に加えて、新たに「経済性」の評価軸を設けたものです(関連記事はこちら)。
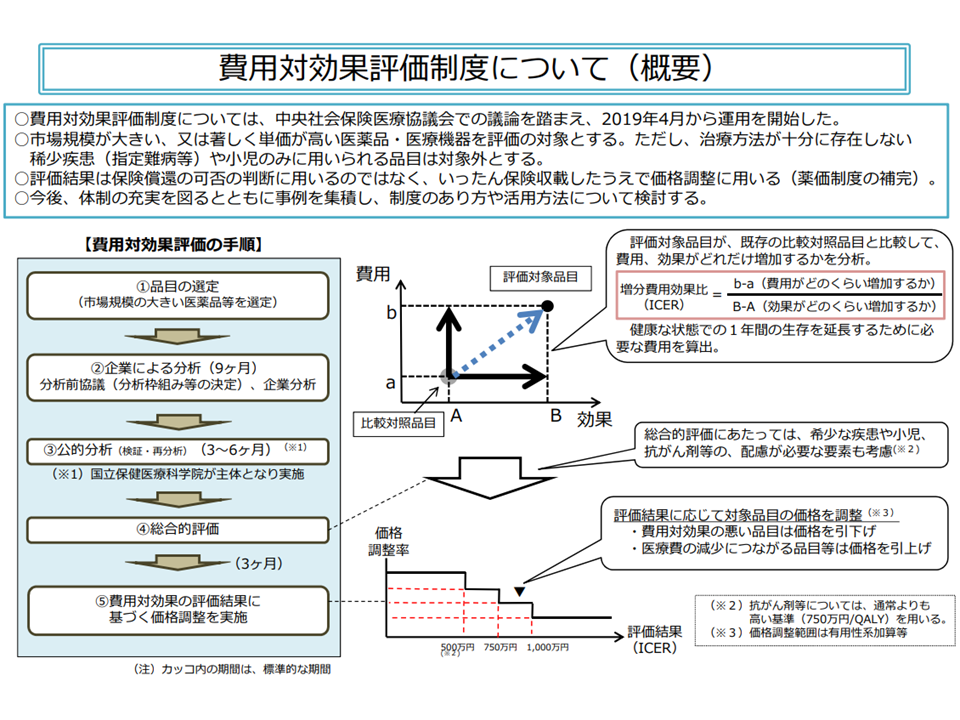
費用対効果評価制度の大枠(中医協・費用対効果評価専門部会2 210421)
これまでに、▼COPD(慢性閉塞性肺疾患)等治療薬の「テリルジー100エリプタ」▼白血病等治療薬の「キムリア」▼発作性夜間ヘモグロビン尿症等治療薬の「ユルトミリス」▼うつ病等治療薬の「トリンテリックス」▼慢性心不全等治療薬の「コララン」▼腎細胞がん等治療薬の「カボメティクス」▼乳がん等治療薬の「エンハーツ」▼脊髄性筋萎縮症の「ゾルゲンスマ」▼偏頭痛治療薬の「エムガルディ」—などが「費用対効果評価」の対象品目に設定され(例えば、有用性加算が設定された市場規模100億円以上の医薬品、市場規模が1000億円以上の医薬品、著しく薬価が高額であり中医協で「費用対効果評価の必要あり」と判断された医薬品、これらの類似品など)、テリルジーやキムリアについては「費用対効果評価に基づく薬価の再算定(引き下げ)」が実施されます(関連記事はこちら)。
費用対効果評価は、英国等の制度を参考にし、「我が国の医療制度・医療の実情にマッチした仕組み」ですが、初めて導入された仕組みでもあり「改善すべき点」も少なくありません。今般、中医協の下部組織である「費用対効果評価専門組織」(以下、専門組織)において、個別品目の費用対効果評価案を作成する中で「いくつかの課題」が浮上(関連記事はこちら)。次のような改善方向が田倉智之委員長(東京大学大学院医学系研究科医療経済政策学特任教授)から中医協の専門部会に報告されました。制度の説明をしながら、課題と改善方向を眺めてみましょう。
(1)「専門組織における検討に要する期間」について、これまで規定がなかったところを「2-3か月程度」に設定する
(2)専門組織の開催時期について、これまで「企業分析が提出された時点」とされているところ、「公的分析による検証が終了した時点」に見直すこととし、専門組織で「企業報告」と「公的分析」なども加味した検討を行えることとする
(3)「患者割合に係るデータ」は、原則として公表可能なものを用いることとし、公表が困難な場合には、その理由に係る説明を求めることとする
(4)「分析対象集団の一部が分析不能とされた場合」の取り扱いについては、現時点で一律のルール設定が困難であり、引き続き事例を積み重ねながら検討していく
(5)「分析期間を超過した場合」の取り扱いを明確化する
(6)「効能追加に係る分析期間の延長」について、「当初の効能」に係る分析期間中に一定の準備が可能であることを踏まえ、「妥当と考えられる期間」を設定する
(7)「評価終了後の再評価」(H3区分)について、引き続き事例を積み重ねながら検討していく
(8)「分析対象集団の規模が小さくなる場合」について、「実施することが困難な場合」にあたるものとして明確化する
(9)「比較対照技術に対し効果は同等であり、かつ費用が増加するもの」(費用増加)の取り扱いについて、区分を設け、原則として「最も小さな価格調整係数に該当する」ものとみ なして価格調整を行う
(10)薬価算定組織との連携に向けてまず情報共有を行う
(11)効果に関して、「公的介護費」は引き続き事例を積み重ねながら検討していく
まず(1)と(2)は、費用対効果評価専門組織の検討期間や検討内容を見直し、より円滑・効率的に費用対効果評価に係る分析を行うことを目指すものです。現行ルールでは、「企業分析→専門組織での確認→公的分析→専門組織での総合的評価(アプレイザル)」という流れで進みますが、これを「企業分析→公的分析→専門組織での確認→必要があれば再分析・追加分析の指示→専門組織での総合的評価(アプレイザル)」と見直すことで、▼相対的な観点で企業分析を評価できる▼再分析・追加分析を指示しやすくなる―などの改善が期待できます。診療側・支払側ともに反対しておらず、この方向で改善内容が詰められます。
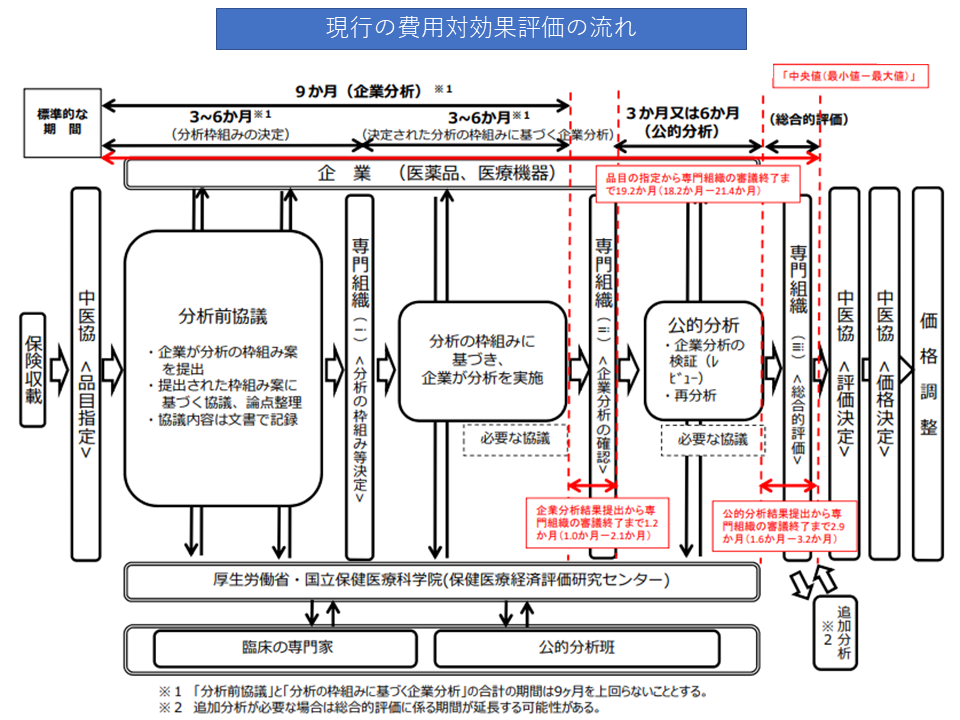
現行の費用対効果評価の流れ(中医協・費用対効果評価専門部会1 210721)
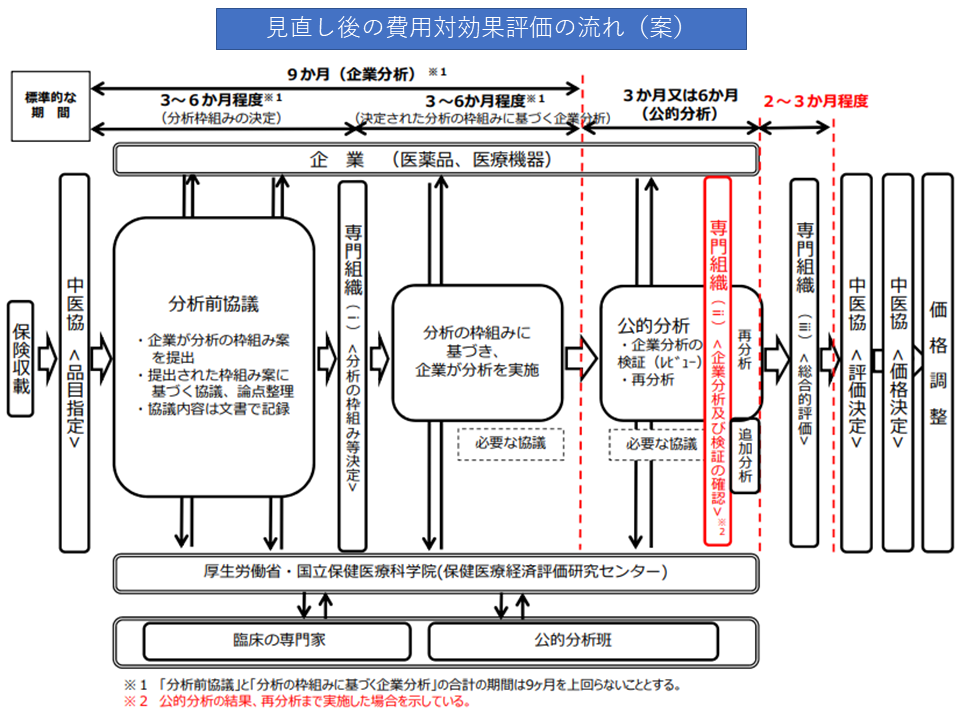
見直し後の費用対効果評価の流れ(案)(中医協・費用対効果評価専門部会2 210721)
患者割合データは原則「公表」を、できない場合にはその理由説明を
(3)は、メーカーサイドが「企業秘密である」として患者割合を公表しない場合のルール明確化です。
我が国の費用対効果評価制度では、「費用対効果が優れているか、劣っているか」を客観的に判断するために、専ら「ICER」(増分費用効果)という概念を用います。「類似技術βの費用(b)と新規医療技術αの費用(a)との差(つまりb-a)」を「類似技術βの効果(B)と新規医療技術αの効果(A)との差(つまりB-A)」で除したもので、いわば「高い効果を得るために、どれだけ余分な費用がかかるのか」と表現することができます。
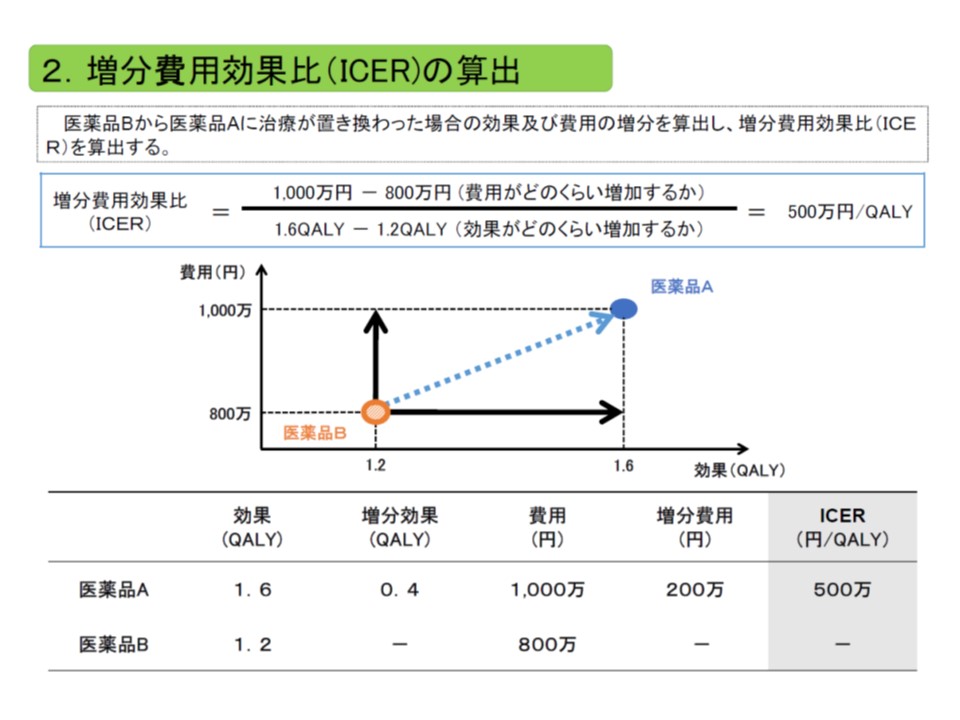
ICERは、「費用の増加分」を「効果の増加分」で除して計算する。費用には主に公的医療費が含まれ、効果のある医療技術で生存年が伸びれば、その分、医療費が増加し、費用が増加することになる点も考慮される
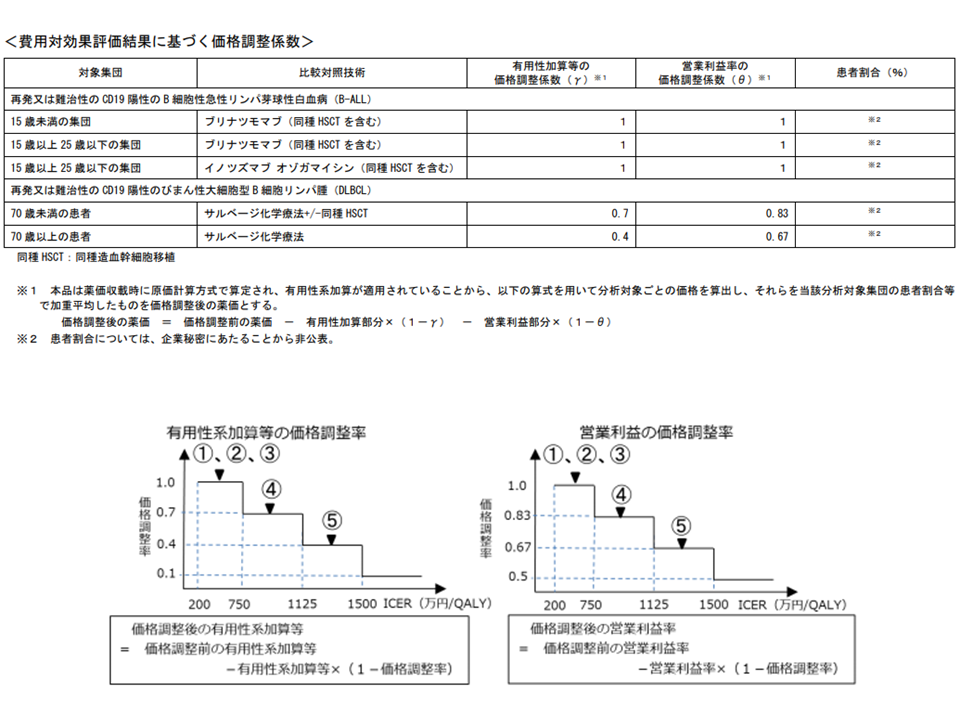
このICERを、次のような基準値に照らして「費用対効果が劣っている→価格を引き下げる」あるいは「費用対効果が優れている→価格を維持する」と判断するのです。
▽ICERが500万円未満の場合(総合的評価で指定難病等の適応がある場合には750万円未満に緩める):「費用対効果が優れている」と判断し、価格を維持する(試行段階と同じ)
▽ICERが500万円以上750万円未満の場合(同750万円以上1125万円未満に緩める):「費用対効果が劣っている」と判断し、有用性等加算部分については価格を30%、営業利益部分については17%引き下げる
▽ICERが750万円以上1000万円未満の場合(同1125万円以上1500万円未満に緩める):「費用対効果がさらに劣っている」と判断し、有用性等加算部分については価格を60%、営業利益部分については33%引き下げる
▽ICERが1000以上の場合(同1500万円以上に緩める):「費用対効果が非常に劣っている」と判断し、有用性等加算部分については価格を90%、営業利益部分については50%引き下げる
ところで、医薬品についてはさまざまな使い方があり、例えば「適応症が複数ある」場合には、比較対象となる医薬品も複数あり、「ICERの値が複数になる」ケースが生じえます。この場合には、「それぞれの集団で費用対効果評価を分析し、『患者割合』に応じた加重平均を行ったうえで価格調整を行う」というルールが設けられています。
しかし、製薬メーカーにおいては「患者割合が企業秘密となり、公表できない」ケースもあります。例えば、画期的な白血病等治療薬である「キムリア点滴静注」に関しては、患者割合が「企業秘密に該当する」として公開されませんでした。
キムリアに関する費用対効果評価(中医協総会(2)4 210414)
中医協では、支払側の幸野庄司委員(健康保険組合連合会理事)から「透明性確保ができない」との批判が出たため、(3)のようなルールが設けられることになります。
一部患者集団で分析ができない場合、当面は個々に対応を検討
また(4)は、例えば(3)のように複数の適応症がある医薬品について「A疾病では患者数が少ないなどの理由で、費用対効果評価の分析ができない」というケースが存在しえます。
現に、抗うつ剤の「トリンテックス」については、「中等度以上のうつ病等」等集団では「費用が増加する」との分析が可能でしたが、「軽度のうつ病等」集団では企業・公的分析のいずれもが「分析不能」と判断しました。
当該製品では「分析不能であった患者集団を除いて分析する」こととなりましたが、このルールを全てに適用することは困難です(例えば、ほとんどの適応症で分析不能だが、ごくごく一部の適応症集団でのみ「費用が減少して、効果が同等」となった場合に、当該製品の価格全体を引き上げることには異論が出てくると思われる)。そこで、専門組織では「引き続き検討する」との考えを示しており、支払側の幸野委員、診療側の城守国斗委員(日本医師会常任理事)ともにこの考えに賛同しています。
メーカーサイドの理由なきデータ遅延は、最も厳しい価格引き下げルールの対象に
一方、(5)はメーカーサイドが期間内(費用対効果評価の対象品目に指定されてから9か月)にデータを提示できなかった場合に「一定のペナルティを課してはどうか」という考え方です。支払側の幸野委員・診療側の城守委員ともに「特別な理由なく、期間内にデータ提示がなされない場合には、最も小さな係数の適用(つまり最も厳しい価格の引き下げ)を行うべき」との考えを示しました。両側の一致した意見であり、この方向で具体的なルール作りが今後、進められる見込みです。
効能効果追加における追加分析などの詳細ルールを設定へ
費用対効果評価には1年以上の期間がかかるため、その間に「効能追加」が認められる可能性があります(実際に生じている)。この際、新たな効能効果の患者群を新患者として、追加分析を求めることになります(企業分析までの効能効果追加に限る)が、その詳細なルール(新集団の分析に伴って、どこまで分析期間を延長してよいかなど)が存在しません。
そこで、今後、(6)として▼期間延長の目安▼追加された効能効果を含めた総合的評価(アプレイザル)▼複数の効能効果追加がなされた場合の対応—などを詰めていくことが確認されました。
また(7)は、費用対効果評価が終了した後に「評価結果に重要な影響を及ぼす知見」が判明した場合には、H3区分の1つとして費用対効果評価の対象となりえます。

費用対効果評価の対象品目選定ルール抜粋(その1)(中医協・費用対効果評価専門部会3 210721)

費用対効果評価の対象品目選定ルール抜粋(その2)(中医協・費用対効果評価専門部会4 210721)
しかし、その詳細なルールが定められていないことから、専門組織において▼H3区分の妥当性に係る国立保健医療科学院における知見の確保ルールにういて引き続き検討する▼国立保健医療科学院において重要な知見が得られた場合のH3区分の指定プロセスについては、まず専門組織で検討し、中医協総会で「指定が妥当」とされた場合に、対象品目として指定する―という考え方が提示され、支払側・診療側ともにこの案を妥当と評価しています。
なお、関連して城守委員は「例えば、希少疾病用の医薬品として高い薬価を手に入れ、その後に効能効果追加をするなどの企業戦略も考えられる(この場合、高い薬価が広範な疾病で維持されてしまう)。予め、総患者数などを企業側に予想させ、効能効果追加時などに迅速に対応できる方策も考えておく必要がある」と指摘しています。
一方、(8)は、適応症などが複数ある場合に「1つ1つ患者集団が小さくなり、分析に耐えられなくなってしまう」場合の取り扱いです。専門組織では「集団の規模が小さくなる場合も、『分析を実施することが困難な場合』に該当することを明確にしてはどうか」(つまり分析対象から除外する)と提案。
支払側・診療側ともに明確に反対してはいませんが、支払側の幸野委員は「除外となる場合には、企業サイドが明確に説明する必要があるのではないか」と、診療側の城守委員は「臨床実態を踏まえた集団設定に留意する必要がある」と付言しています。
「効果が同じで、高額な薬剤」は、最も厳しい価格引き下げルールの対象に
他方、(9)は現行ルールにない「比較対照技術と効果は同等で、費用が増加する」製品の価格設定ルールを設けてはどうかというもので、専門組織では「最も小さな係数の適用(つまり最も厳しい価格の引き下げ)を行うべき」との考えを示しました。
この考え方に異論は出ていませんが、支払側の幸野委員は「『効果が変わらないが、高額である』などという医薬品をあえて臨床の場で使うことがあるのだろうか」と疑問を投げたうえで、「患者特性に配慮した医薬品選択がなされると思うが、その場合でも、経済性も考慮してほしい」とコメントしています。
また(10)は、同じ医薬品の評価について「薬価専門組織では有用性を認めて加算を設定した」が、「費用対効果評価では、その加算のベースとなるデータを確認できなかった」追いうケースがあったことを踏まえたものです(発作性夜間ヘモグロビン尿症等治療薬の「ユルトミリス」で生じた)。
評価の視点や基礎データが異なるために、「薬価設定時に期待された効果が、データ上確認できない」ことが生じ、評価結果が異なることは十分にあり得、今後もそうしたケースが出てくるでしょう。どちらも「医薬品等の適切な評価」を目指すものであり、まずは「両組織間で情報共有を十分に行う」ことからスタートしていくことになりました。
医薬品等の効果測定に当たって、「公的介護費の縮減」を勘案すべきか
さらに(11)は、費用と効果(QALY等)だけからは判断できない要素として「介護費」を総合的評価(アプレイザル)で勘案すべきか、という論点です。
結論として「さらに研究を進める」ことになりましたが、支払側の幸野委員は「介護費以外にも、『疾病に伴う患者の生産性損失』なども考慮せよとの指摘もある。様々な要素を含めて検討していくべき」と注文しています。
今後、専門部会において、この11の論点をベースに議論を深め、年内(2021年内)にも費用対効果評価の制度改革案が固められる予定です。
【関連記事】
費用対効果評価、「ICER閾値の妥当性」「保険適用時価格への反映」などどう考えていくか―中医協・費用対効果評価専門部会
2022薬価改定、新規後発品の価格設定ルール・原価計算方式の在り方・イノベーション評価などが重要論点―中医協・薬価専門部会
白血病等治療薬のキムリア、費用対効果評価に基づく薬価を「3264万円」に引き下げ―中医協総会(2)
医薬品等の価格設定における「費用対効果評価」の概要固まる、2019年4月から実施―中医協総会(1)
費用対効果評価の骨子案、費用対効果評価が高い(ICER200万円未満)品目も価格引き上げ―中医協・費用対効果評価合同部会
医薬品の費用対効果評価、厳しすぎれば「日本市場の魅力」が減退―中医協・費用対効果評価合同部会
医療技術の費用対効果、500万・750万・1000万の3基準値に沿い「良し悪し」を判断へ―中医協・費用対効果評価合同部会
費用対効果評価、企業と公的機関の分析に齟齬が出ないよう、適宜「協議」を行う―中医協・費用対効果評価合同部会
医療技術の費用対効果、「連続的に評価」すべきか、「他技術より劣れば一律に評価」すべきか―中医協・費用対効果評価合同部会
費用対効果評価、「補正加算があり市場規模の大きな新薬・新規医療機器」を主な対象に―中医協・費用対効果評価合同部会
費用対効果データが複数ある場合、評価には一定の「幅」を持たせてはどうか―中医協・費用対効果評価専門部会
費用対効果評価、試行導入結果踏まえ「データ提出」や「再分析」の在り方検討―中医協・費用対効果評価合同部会(2)
費用対効果評価、「健康のためにいくら支払えるか」との調査は国では行わない―中医協・費用対効果評価合同部会(1)
費用対効果評価、オプジーボは価格引き下げ、川澄化学のステントグラフトは引き上げ―中医協・費用対効果評価合同部会
費用対効果評価、試行結果の検証踏まえ2019年度以降に制度化―中医協
使用実績を踏まえ材料機能区分を再申請(チャレンジ申請)できる仕組み新設―中医協・材料専門部会
薬価制度抜本改革案を修正、新薬創出等加算の厳格化を一部緩和―中医協薬価専門部会
新薬創出等加算の見直し、「容認できない」と製薬メーカー猛反発—中医協薬価専門部会
薬価制度抜本改革の具体案、費用対効果評価による価格引き上げも—中医協薬価専門部会
既存製品よりも費用が安く済み、効果の高い製品の価格は引き上げるべきか―費用対効果評価合同部会
医薬品などの費用対効果評価、業界は「加算のみへの反映」を切望—中医協・費用対効果評価合同部会
医薬品などの費用対効果評価、結果は加算のみに反映させるか、価格全体に及ぼすか—中医協・費用対効果評価関係
費用対効果評価、10月までに試行導入の詳細、年内に制度化の骨子を固める—中医協・費用対効果評価専門部会
費用対効果、試行導入には「支払い意思額調査」結果は用いず—中医協・費用対効果評価専門部会
費用対効果を判断するための「支払い意思額調査」、聞き方も含めて再検討—中医協・費用対効果評価専門部会
新医療技術の恩恵を受ける国民を対象に「いくらまで支払えるか」を調査—中医協・費用対効果専門部会
費用対効果評価の結果、どのタイミングで薬価などに反映させるか—中医協・費用対効果専門部会
費用対効果評価の結果、「保険償還価格の調整」に活用—中医協・費用対効果専門部会
医療技術の費用対効果評価、厚労省が仮想具体例で詳説—中医協・費用対効果評価専門部会
医療技術の費用対効果評価、「感染症対策への有用性」など6要素も勘案—中医協・費用対効果評価専門部会
医療技術の費用対効果、評価のための基準値を設定する方針に転換―中医協・費用対効果評価専門部会
費用対効果評価、新規収載の医薬品なども対象に2018年度から本格導入へ―費用対効果評価専門部会
2018年度の費用対効果評価に基づく再算定、オプジーボやハーボニーなど12品目に決定―中医協総会
2016年4月以降、費用対効果評価の対象として補正加算が高いものなど8品目程度を選定―中医協総会
費用対効果の良し悪しを判断する基準値、2016年度改定では定めず―費用対効果評価専門部会
費用対効果評価、対象は「保険収載後、1-2回の改定を経たもの」に―費用対効果評価専門部会
費用対効果評価、試行段階では社会的影響を評価する特別ルールは定めず―費用対効果評価専門部会
費用対効果評価の結果は医薬品・医療機器の再算定に活用―費用対効果評価専門部会
費用対効果評価はQALYを基本に実施、他の指標の使用も認める―中医協・専門部会
薬などの費用対効果、まず既収載品の再算定に活用、価格への反映は18年度改定時か―中医協・専門部会
超高額薬剤等の保険収載、薬価制度だけでなく税制等も含め幅広い対応を―社保審・医療保険部会





